
- •Тверской государственный технический университет
- •Е.А. Панкратов, н.Ю. Старовойтова, т.Л. Кравец
- •Химия и физика полимеров
- •Часть 2
- •Глава I. Молекулярное строение полимеров
- •Зависимость свойств полимеров от топологии макромолекул
- •Конфигурация макромолекулы и конфигурационная изомерия
- •Конформация макромолекулы и конформационная изомерия
- •Внутримолекулярное вращение
- •Гибкость полимерной цепи
- •Количественные характеристики гибкости
- •Потенциальная энергия макромолекулы
- •Механическая модель молекулы
- •Ближние и дальние взаимодействия
- •Межмолекулярные взаимодействия
- •Глава II. Полимерные тела
- •Фазовые, агрегатные и физические состояния высокомолекулярных соединений
- •Кристаллическое состояние полимеров
- •Основные условия кристаллизации полимеров
- •Влияние различных факторов на скорость и глубину кристаллизации
- •Механизм кристаллизации
- •Кинетические особенности кристаллизации
- •Характер деформации кристаллических полимеров
- •Лиотропные и термотропные жидкокристаллические полимеры
- •Стеклообразное состояние
- •Характеристика состояния
- •Температура хрупкости и температура стеклования
- •Деформация стеклообразных полимеров и явление вынужденной эластичности
- •Высокоэластическое состояние полимеров
- •Особенности высокоэластического состояния
- •Два типа упругих тел и характер высокоэластической деформации
- •Термодинамическое рассмотрение природы упругих сил
- •Кинетическая теория высокоэластичности
- •Релаксационный характер процесса деформации эластомеров
- •Явление гистерезиса
- •Вязкотекучее состояние полимеров
- •Характеристика состояния
- •Температура текучести
- •Ориентация макромолекул при течении полимера. Структурная вязкость
- •Механическое стеклование. Химическое течение
- •Пластическая и общая деформация полимеров
- •Надмолекулярные структуры в полимерах
- •Глава III. Растворы полимеров
- •Общая характеристика
- •Разбавленные растворы полимеров
- •Теория Флори-Хаггинса
- •Качество растворителя и -точка
- •Уравнение Марка-Куна-Хувинка
- •Полуразбавленные растворы полимеров. Явления ассоциации и гелеобразования
- •Концентрированные растворы полимеров и расплавы
- •Характеристика концентрированных растворов
- •Пластификация полимеров. Пластификаторы
- •Основы термодинамики растворов полимеров
- •Самопроизвольный характер процессов растворения
- •Тепловой эффект процессов растворения
- •Модель полимерного раствора Флори-Хаггинса
- •Фазовые равновесия системы «полимер-растворитель»
- •Набухание и растворение полимеров
- •Методы исследования растворов полимеров
- •Методы определения средних молекулярных масс
- •Осмометрия
- •3.7.3. Эластоосмометрия
- •Криоскопия и эбулиоскопия
- •Вискозиметрия
- •Светорассеяние
- •Фракционирование. Гельпроникающая хроматография и седиментация
- •Метод концевых групп
- •Глава IV. Физические свойства полимеров
- •Прочность и долговечность
- •Механическая прочность
- •Долговечность
- •Механизм разрушения полимеров
- •Факторы, влияющие на прочность образца
- •Кинетика процесса разрушения
- •Адгезия и аутогезия
- •Основные понятия и определения
- •Теории адгезии
- •Влияние различных факторов на величину адгезии полимеров
- •Образование аутогезионной связи
- •Проницаемость полимеров
- •Сорбция и диффузия газов и жидкостей. Газопроницаемость
- •Влияние физических факторов на газопроницаемость полимера
- •Паропроницаемость
- •Электрические свойства полимеров
- •Классификация полимеров по электропроводности
- •Характер электропроводности
- •Электропроводность полимеров с сопряженными двойными связями
- •Полимеры как диэлектрики. Основные характеристики диэлектриков
- •Библиографический список
- •Химия и физика полимеров
- •Часть 2
- •Учебное пособие
- •170026, Г. Тверь, наб. А. Никитина, 22
Методы исследования растворов полимеров
Методы определения средних молекулярных масс
Методы определения средних молекулярных масс можно классифицировать по принципу, на котором они основаны, на четыре группы: термодинамические, гидродинамические, оптические и химические.
Термодинамические методы (криоскопия, эбулиоскопия, осмометрия) основаны на изучении термодинамики разбавленных растворов полимеров и использовании их коллигативных свойств. Коллигативные свойства – свойства растворов, которые могут быть охарактеризованы экспериментально определяемыми величинами (понижение давления пара растворителя, осмотическое давление и т.д.) и являются мерой химического потенциала растворителя. Эти величины часто используются для вычисления молекулярных масс полимера при условии, что раствор подчиняется законам идеальных систем (законы Рауля, Вант-Гоффа и т.д.).
Гидродинамические, или молекулярно-кинетические, методы (вискозиметрия, седиментация) основаны на изучении гидродинамических свойств растворов, проявляющихся при движении макромолекул в среде растворителя и сильно зависящих от размеров и формы, которую макромолекулы принимают в растворе.
Как на термодинамические, так и на гидродинамические свойства большое влияние оказывает степень разбавления раствора, поэтому для получения требуемых характеристик делают измерения при нескольких значениях концентраций и затем проводят экстраполяцию к нулевой концентрации.
Оптические методы (светорассеяние) основаны на изучении оптических свойств растворов.
Осмометрия
Метод осмометрии используется для определения молекулярной массы полимера в разбавленных растворах.
Осмос – явление одностороннего проникновения молекул растворителя в раствор через полупроницаемую перегородку (мембрану).
Осмотическое давление раствора – это термодинамическое сродство между компонентами, отнесенное к единице объема растворителя:
![]() ,
,
где
![]() – разность химических потенциалов
чистого растворителя и компонента в
растворе;
– разность химических потенциалов
чистого растворителя и компонента в
растворе;
![]() – объем растворителя.
– объем растворителя.
Для низкомолекулярных соединений осмотическое давление связано с молекулярной массой законом Вант-Гоффа:
![]() ,
,
![]() ,
,
отсюда
![]() ,
,
где V – объем; Т – температура; n – число моль вещества в растворе; m – масса растворенного вещества; М – молекулярная масса растворенного вещества; с – концентрация раствора.
В случае растворов ВМС закон Вант-Гоффа не работает, поэтому для исследования полимеров методом осмометрии используется теория Флори-Хаггинса (см. п. 3.2.1.).
В области больших
разбавлений зависимость приведенного
осмотического давления
![]() от концентрации с
выразится прямой (см. рис. 40):
от концентрации с
выразится прямой (см. рис. 40):
![]() , (11)
, (11)
где , – плотность и молекулярная масса растворителя; , – плотность и молекулярная масса полимера; – параметр взаимодействия Флори-Хаггинса, с – концентрация.
При
![]() уравнение (11) принимает вид
уравнение (11) принимает вид
![]() ,
,
что
позволяет экспериментально определить
среднечисловую молекулярную массу
![]() ,
которая зависит от числа частиц,
находящихся в растворе.
,
которая зависит от числа частиц,
находящихся в растворе.
Порядок определения молекулярной массы
по осмотическому давлению
Измеряют осмотическое давление при нескольких концентрациях раствора с в области больших разбавлений.
Н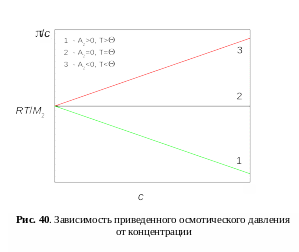 аходят
отношение
аходят
отношение
![]() .
Строят зависимость приведенного
осмотического давления
от концентрации с
(см. рис. 40).
.
Строят зависимость приведенного
осмотического давления
от концентрации с
(см. рис. 40).
Прямую экстраполируют
к с =
0, при этом получают значение
,
численно равное
![]() .
Отсюда получают значение молекулярной
массы полимера
.
Отсюда получают значение молекулярной
массы полимера
![]() .
.
Метод является одним из наиболее точных, но трудоемких, требует тщательного фракционирования. Надежные результаты дает для фракций с молекулярной массой от 104 до 106.
Наклон
прямых определяется величиной второго
вириального коэффициента А2,
зависящей от характера взаимодействия
«полимер-растворитель». Тангенс угла
наклона прямой
![]() соответствует значению второго
вириального коэффициента А2
(
соответствует значению второго
вириального коэффициента А2
(![]() ).
).
Большое практическое значение имеет явление обратного осмоса, основанное на том, что при приложении к раствору давления, превышающего осмотическое, растворитель, проходя через полупроницаемую мембрану в противоположном по сравнению с обычным осмосом направлении, освобождается от растворенного вещества. На этом явлении основаны методы ультра- и суперфильтрации (используются для опреснения и биоочистки воды, концентрирования соков, разделения газов и т.д.).
