- •Тверской государственный технический университет
- •Е.А. Панкратов, н.Ю. Старовойтова, т.Л. Кравец
- •Химия и физика полимеров
- •Часть 2
- •Глава I. Молекулярное строение полимеров
- •Зависимость свойств полимеров от топологии макромолекул
- •Конфигурация макромолекулы и конфигурационная изомерия
- •Конформация макромолекулы и конформационная изомерия
- •Внутримолекулярное вращение
- •Гибкость полимерной цепи
- •Количественные характеристики гибкости
- •Потенциальная энергия макромолекулы
- •Механическая модель молекулы
- •Ближние и дальние взаимодействия
- •Межмолекулярные взаимодействия
- •Глава II. Полимерные тела
- •Фазовые, агрегатные и физические состояния высокомолекулярных соединений
- •Кристаллическое состояние полимеров
- •Основные условия кристаллизации полимеров
- •Влияние различных факторов на скорость и глубину кристаллизации
- •Механизм кристаллизации
- •Кинетические особенности кристаллизации
- •Характер деформации кристаллических полимеров
- •Лиотропные и термотропные жидкокристаллические полимеры
- •Стеклообразное состояние
- •Характеристика состояния
- •Температура хрупкости и температура стеклования
- •Деформация стеклообразных полимеров и явление вынужденной эластичности
- •Высокоэластическое состояние полимеров
- •Особенности высокоэластического состояния
- •Два типа упругих тел и характер высокоэластической деформации
- •Термодинамическое рассмотрение природы упругих сил
- •Кинетическая теория высокоэластичности
- •Релаксационный характер процесса деформации эластомеров
- •Явление гистерезиса
- •Вязкотекучее состояние полимеров
- •Характеристика состояния
- •Температура текучести
- •Ориентация макромолекул при течении полимера. Структурная вязкость
- •Механическое стеклование. Химическое течение
- •Пластическая и общая деформация полимеров
- •Надмолекулярные структуры в полимерах
- •Глава III. Растворы полимеров
- •Общая характеристика
- •Разбавленные растворы полимеров
- •Теория Флори-Хаггинса
- •Качество растворителя и -точка
- •Уравнение Марка-Куна-Хувинка
- •Полуразбавленные растворы полимеров. Явления ассоциации и гелеобразования
- •Концентрированные растворы полимеров и расплавы
- •Характеристика концентрированных растворов
- •Пластификация полимеров. Пластификаторы
- •Основы термодинамики растворов полимеров
- •Самопроизвольный характер процессов растворения
- •Тепловой эффект процессов растворения
- •Модель полимерного раствора Флори-Хаггинса
- •Фазовые равновесия системы «полимер-растворитель»
- •Набухание и растворение полимеров
- •Методы исследования растворов полимеров
- •Методы определения средних молекулярных масс
- •Осмометрия
- •3.7.3. Эластоосмометрия
- •Криоскопия и эбулиоскопия
- •Вискозиметрия
- •Светорассеяние
- •Фракционирование. Гельпроникающая хроматография и седиментация
- •Метод концевых групп
- •Глава IV. Физические свойства полимеров
- •Прочность и долговечность
- •Механическая прочность
- •Долговечность
- •Механизм разрушения полимеров
- •Факторы, влияющие на прочность образца
- •Кинетика процесса разрушения
- •Адгезия и аутогезия
- •Основные понятия и определения
- •Теории адгезии
- •Влияние различных факторов на величину адгезии полимеров
- •Образование аутогезионной связи
- •Проницаемость полимеров
- •Сорбция и диффузия газов и жидкостей. Газопроницаемость
- •Влияние физических факторов на газопроницаемость полимера
- •Паропроницаемость
- •Электрические свойства полимеров
- •Классификация полимеров по электропроводности
- •Характер электропроводности
- •Электропроводность полимеров с сопряженными двойными связями
- •Полимеры как диэлектрики. Основные характеристики диэлектриков
- •Библиографический список
- •Химия и физика полимеров
- •Часть 2
- •Учебное пособие
- •170026, Г. Тверь, наб. А. Никитина, 22
Модель полимерного раствора Флори-Хаггинса
Простейшей моделью полимерного раствора является модель Флори-Хаггинса. Это атермический раствор, в котором компоненты не взаимодействуют, а энтропия смешения определяется только перестановками частиц компонентов раствора. Раствор представляет собой жесткую трехмерную квазикристаллическую решетку, все ячейки которой заполнены таким образом, что в каждой из них находятся одна молекула растворителя или сегмент полимерной цепи, способные в процессе теплового движения обмениваться местами с молекулами растворителя или другими сегментами. В таком представлении цепь полимера должна быть достаточно гибкой.
Учитывая разницу в размерах молекул растворителя и макромолекул, а также взаимосвязанность сегментов в цепях, Флори и Хаггинс вывели выражение для изменения свободной энергии раствора для атермического смешения ( ):
![]() ,
,
где
![]() и
и
![]() – объемные доли растворителя и полимера
соответственно;
– объемные доли растворителя и полимера
соответственно;
![]() и
и
![]() – число молей компонентов.
– число молей компонентов.
В
действительности при растворении
![]() ,
,
![]() ,
а
,
а
![]() отличается от теоретической
из-за наличия взаимодействия
«полимер-растворитель». Для учета этого
взаимодействия вводят дополнительное
слагаемое, в котором содержится
безразмерный параметр
отличается от теоретической
из-за наличия взаимодействия
«полимер-растворитель». Для учета этого
взаимодействия вводят дополнительное
слагаемое, в котором содержится
безразмерный параметр
![]() – параметр Флори-Хаггинса. Он учитывает
энтальпийный и энтропийный вклад
взаимодействия растворителя с
макромолекулами в изменение свободной
энергии смешения при образовании
полимерного раствора:
– параметр Флори-Хаггинса. Он учитывает
энтальпийный и энтропийный вклад
взаимодействия растворителя с
макромолекулами в изменение свободной
энергии смешения при образовании
полимерного раствора:
![]() .
.
Несмотря на ряд существенных приближений и ограничений решеточной модели, полученные с ее помощью уравнения свободной энергии смешения позволили объяснить обнаруженные на опыте важнейшие особенности поведения растворов полимеров – отрицательное отклонение от закона Рауля, повышенное осмотическое давление и т.п.
Фазовые равновесия системы «полимер-растворитель»
Для растворов полимеров характерно явление ограниченной растворимости. При достижении предельной растворимости полимера в результате изменения температуры или концентрации раствор разделяется на фазы. Равновесие в многокомпонентной системе (двухкомпонентной для пары «полимер-растворитель») определяется правилом фаз Гиббса:
![]() ,
,
где
F
– число степеней свободы; k
– число компонентов;
![]() – число фаз в системе.
– число фаз в системе.
Число степеней свободы показывает, сколько термодинамических переменных, определяющих состояние системы (давление, температура и т.д.), можно произвольно менять, не вызывая изменения числа фаз в системе, т.е. не нарушая ее равновесия.
Двухкомпонентная однофазная система (раствор полимера) имеет две степени свободы: состояние системы определяется температурой и концентрацией одного из компонентов.
Двухкомпонентная двухфазная конденсированная система имеет одну степень свободы: изменение температуры вызывает изменение компонентов в каждой фазе.
При определенной температуре однофазный гомогенный раствор может разделиться на две фазы (расслоиться) – это температура фазового разделения .
Первым признаком расслоения гомогенной прозрачной системы на две фазы является опалесценция (рассеяние света).
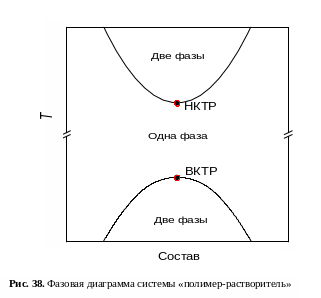
Для системы «полимер-растворитель» возможно несколько видов фазовых диаграмм. Пример фазовой диаграммы приведен на рис. 38. Кривая, разделяющая области составов, отвечающих одно- и двухфазной системам, называется бинодалью. Любая точка, лежащая внутри бинодали, отвечает двухфазной системе «жидкость-жидкость». Точки, лежащие вне бинодали, отвечают однофазным растворам (составы растворов определяются координатами точек): НКТР – нижняя критическая точка растворения; ВКТР – верхняя критическая точка растворения.
НКТР имеют растворы, расслаивающиеся при нагревании (происходит разрушение водородных или донорно-акцепторных связей, возникает различие в коэффициентах объемного расширения полимера и растворителя – растворитель расширяется сильнее). ВКТР имеют растворы, расслаивающиеся при охлаждении.