
- •1. Постійний електричний струм та його характеристики
- •1.1. Електричний струм. Сила і густина струму
- •Рівняння неперервності
- •Електрорушійна сила
- •Закон Ома. Опір провідників
- •Закон Джоуля – Ленца. Закон збереження електричної енергії
- •Розгалужені кола. Правила Кірхгофа
- •1.7. Робота і потужність електричного струму
- •2. Електричний струм у металах
- •2.1. Електронна провідність металів
- •2.2. Основи класичної електронної теорії провідності металів
- •2.3. Основні закони постійного струму з точки зору класичної електронної теорії провідності металів
- •2.4. Недоліки класичної електронної теорії провідності металів
- •3.2. Термоелектричні явища та їх застосування
- •3.3. Емісійні явища
- •4. Електричний струм у рідинах
- •4.1. Електроліз. Закони Фарадея
- •4.2. Електролітична дисоціація
- •4.3. Електролітична провідність рідин
- •4.4. Застосування електролізу в техніці
- •5. Електричний струм у газах
- •5.1. Електропровідність газів
- •5.2. Несамостійний газовий розряд
- •5.3. Самостійний газовий розряд
- •5.4. Тліючий розряд
- •5.5. Самостійний розряд при нормальному і великих тисках
- •6. Приклади розв’язування задач
- •Р озв’язування
- •Р озв’язування
- •Розв’язування
- •Р озв’язування
- •Р озв’язування
- •Р озв’язування
- •Р озв’язування
- •Р озв’язування
- •Р озв’язування
- •Р озв’язування
- •Р озв’язування
- •Р озв’язування
- •Р озв’язування
- •Розв’язування
- •Розв’язування
- •Розв’язування
- •7. Задачі для самостійного розв'язування
- •Постійний електричний струм та його характеристики……….…………….3
- •Електричний струм. Сила і густина струму………………….……….….3
- •Література
4.3. Електролітична провідність рідин
Я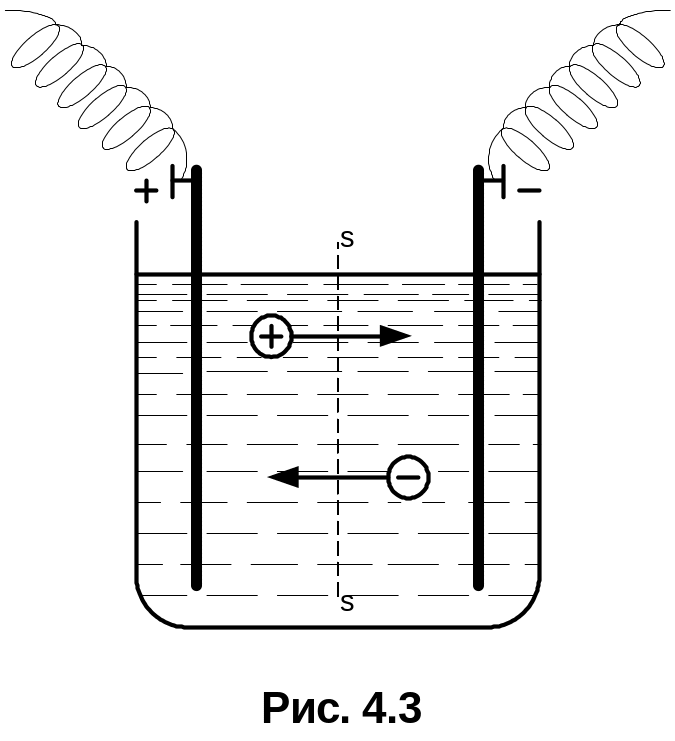 кщо
зовнішнього електричного поля немає,
то іони в електроліті перебувають у
хаотичному тепловому русі, всі напрями
якого рівноймовірні, переважаючого
напряму перенесення іонів немає, струм
відсутній. За наявності зовнішнього
електричного поля на іони діє сила
кщо
зовнішнього електричного поля немає,
то іони в електроліті перебувають у
хаотичному тепловому русі, всі напрями
якого рівноймовірні, переважаючого
напряму перенесення іонів немає, струм
відсутній. За наявності зовнішнього
електричного поля на іони діє сила
![]() .
Позитивні іони набувають додаткової
швидкості в напрямі напруженості
електричного поля, а негативні – у
протилежному напрямі (рис. 4.3). Цей
додатковий рух створює електричний
струм, густина якого складаються з
густини струму
.
Позитивні іони набувають додаткової
швидкості в напрямі напруженості
електричного поля, а негативні – у
протилежному напрямі (рис. 4.3). Цей
додатковий рух створює електричний
струм, густина якого складаються з
густини струму
![]() рухомих позитивних іонів та густини
струму
рухомих позитивних іонів та густини
струму
![]() рухомих негативних іонів, тобто
рухомих негативних іонів, тобто
![]() . (4.8)
. (4.8)
Якщо
молекула ділиться на два іони, то їх
концентрації однакові, тобто
![]() .
Оскільки електроліт в цілому
електронейтральний, то
.
Оскільки електроліт в цілому
електронейтральний, то
![]() .
За таких умов рівнянню (4.8) можна надати
вигляду:
.
За таких умов рівнянню (4.8) можна надати
вигляду:
![]() .
(4.9)
.
(4.9)
Якщо
припустити, що при русі іона сила тертя
пропорційна його швидкості
![]() ,
де
– коефіцієнт тертя, то рівняння динаміки
напрямленого руху іонів матимуть вигляд:
,
де
– коефіцієнт тертя, то рівняння динаміки
напрямленого руху іонів матимуть вигляд:
![]() ;
;
![]() ,
(4.10)
,
(4.10)
де
![]() і
і
![]() – прискорення відповідно позитивних
і негативних іонів.
– прискорення відповідно позитивних
і негативних іонів.
Досліди
показують, що при незначній величині
сила струму під час електролізу не
змінюється. Це свідчить про те, що іони
рухаються без прискорень
![]() .
Тоді з рівнянь (4.10) одержимо:
.
Тоді з рівнянь (4.10) одержимо:
![]() ;
; ![]() , (4.11)
, (4.11)
де
величини
![]() і
і
![]() називають рухливостями позитивних і
негативних іонів. З рівнянь (4.11) видно,
що рухливість іона чисельно дорівнює
швидкості його напрямленого руху при
напруженості електричного поля
називають рухливостями позитивних і
негативних іонів. З рівнянь (4.11) видно,
що рухливість іона чисельно дорівнює
швидкості його напрямленого руху при
напруженості електричного поля
![]() .
На основі формул (4.9) та (4.11) одержимо:
.
На основі формул (4.9) та (4.11) одержимо:
![]() . (4.12)
. (4.12)
Якщо
коефіцієнт дисоціації ,
то
![]() (n0–
концентрація розчиненої речовини) і
вираз (4.12) можна записати так:
(n0–
концентрація розчиненої речовини) і
вираз (4.12) можна записати так:
![]() . (4.13)
. (4.13)
Формула (4.13) виражає закон Ома в диференціальній формі для електролітів. Питома електропровідність електроліту
![]() . (4.14)
. (4.14)
Заряд іона q дорівнює елементарному заряду , домноженому на валентність Z іона. Згідно з (4.6), (4.13) та (4.14) отримаємо:
![]() , (4.15)
, (4.15)
 . (4.16)
. (4.16)
Тут F – число Фарадея, NA – число Авогадро.
Якщо
при дисоціації молекули розчиненої
речовини утворюється k+
позитивних і k–
негативних іонів, то k+Z+=
k–Z–;
![]() ;
;
![]() і, згідно (4.16)
і, згідно (4.16)
![]() . (4.17)
. (4.17)
Відношення
![]() – число позитивних іонів в одному
кілограм-еквіваленті, а
– число позитивних іонів в одному
кілограм-еквіваленті, а
![]() (4.18)
(4.18)
C – число кілограм-еквівалентів іонів одного знака, що містяться в одиниці об’єму електроліту (у вільному стані і зв’язаних у молекулах). Величину C називають еквівалентною концентрацією розчину. Об’єднавши формули (4.17) та (4.18), отримаємо такий вираз для питомої електропровідності електроліту:
![]() . (4.19)
. (4.19)
З
підвищенням температури електроліту
його питома електропровідність
збільшується, оскільки, по-перше,
збільшується коефіцієнт дисоціації ,
по-друге, зменшується в’язкість рідини,
а тому зростає рухливість іонів
![]() і
і
![]() .
.
Залежність
від концентрації розчину досить складна.
При зміні концентрації змінюється ,
C
і рухливість іонів. При малих концентраціях
(як свідчить дослід)
збільшується зі збільшенням концентрації
( величини
і
![]() змінюються мало і
змінюються мало і
![]() ).
При подальшому збільшенні концентрації
до певної величини
).
При подальшому збільшенні концентрації
до певної величини
![]() збільшується, а потім починає зменшуватись
внаслідок зменшення як коефіцієнта
дисоціації ,
так і рухливості іонів.
збільшується, а потім починає зменшуватись
внаслідок зменшення як коефіцієнта
дисоціації ,
так і рухливості іонів.
Досліди
показали, що при високій напруженості
електричного поля в електролітах
![]() спостерігається відхилення від закону
Ома і залежність
спостерігається відхилення від закону
Ома і залежність
![]() має нелінійний характер.
має нелінійний характер.
