
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Закони електролізу (м.Фарадей)
- •2. Рівні кількості електрики виділяють при електролізі з різних хімічних сполук еквівалентні кількості речовин.
- •Масу речовини, що виділилася при електролізі, розраховують за формулою
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Рівняння Менделєєва-Клапейрона
Якщо
величину
![]() віднести до кількості газу, рівній 1
моль, то вона буде мати певне значення,
однакове для всіх газів. Ця величина
називається універсальною
газовою сталою
і позначається через R.
Відповідно, для будь-якого газу кількістю
1 моль
= R.
Тоді
=
R або рV=RT
– це рівняння
називається
рівнянням Менделєєва-Клапейрона. Якщо
газ узятий кількістю
моль, то рівняння Менделєєва-Клапейрона
приймає вигляд РV=RT;
=
віднести до кількості газу, рівній 1
моль, то вона буде мати певне значення,
однакове для всіх газів. Ця величина
називається універсальною
газовою сталою
і позначається через R.
Відповідно, для будь-якого газу кількістю
1 моль
= R.
Тоді
=
R або рV=RT
– це рівняння
називається
рівнянням Менделєєва-Клапейрона. Якщо
газ узятий кількістю
моль, то рівняння Менделєєва-Клапейрона
приймає вигляд РV=RT;
=![]() ;
РV=
RT.
;
РV=
RT.
Тестові завдання:
Виберiть з наведених нижче частинок: А – атоми, Б – iони, В – молекули. 1) Cl2; 2) Cl; 3) Cl–; 4) N2; 5) N; 6) S2–; 7) SO42–; 8) S.
Якi з наведених нижче сполук потрiбно вiднести до простих: 1) H2O; 2) CuSO4; 3) Cu; 4) O2; 5) O3; 6) Na2SO4.
Якi з наведених нижче сполук слiд вiднести до складних: 1) H2O; 2) N2; 3) Ar; 4) CuCl2; 5) FeS2; 6) Fe.
Зразки мiдi одержанi рiзними способами з таких речовин: червоного Cu2O, чорного CuO, бiлого CuSO4, синього CuSO4 5H2O. Чи вiдрiзняються зразки мiдi один вiд одного за фiзичними i хiмiчними властивостями?
Внаслiдок рiзних реакцiй отримано воду: 1) NaOH + HCl = NaCl + H2O; 2) CuSO4 5H2O CuSO4+ 5 H2O; 3) C2H5OH C2H4+ H2O. Чи можна стверджувати, що пiсля дистиляції вода має склад: а) однаковий у всiх випадках; б) рiзний у всiх випадках; в) однаковий у першому i другому випадках.
До яких явищ (фiзичних чи хімічних) можна вiднести прожарювання залізної дротини на повiтрi, видiлення кристалiв хлористого натрiю iз його водного розчину. Дайте мотивовану вiдповiдь. Сформулюйте основнi ознаки, якi характеризують фiзичнi i хiмiчнi явища.
Які з приведених гідроксидів можуть утворювати основні солі: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
Які кислоти може утворити Р2О5 при взаємодії з водою: а) фосфористу; б) пірофосфорну; в) ортофосфорну; г) метафосфорну.
Назвіть солі: (CuOH)2CO3; Al(OH)2NO3; Ca(HCO3)2; Al(H2PO4)3; CrOHCl2; Fe(OH)2NO2; Ca(H2PO4)2; BaHPO4; AlOHCl2.
Напишiть графiчнi формули та знайдiть валентнiсть Мангану у сполуках KMnO4 та MnSO4.
Напишiть графiчнi формули та знайдiть валентнiсть Хрому в сполуках K2Cr2O7 та CrCl3.
Напишiть графiчнi формули та знайдiть валентнiсть Хлору в сполуках KClO3 та KClO4.
Напишiть графiчну формулу та знайдiть валентнiсть Фосфору в сполуках К3РО4 та К2H2Р2О7.
Напишiть графiчнi формули та знайдiть валентнiсть Хрому в сполуцi Na2CrO4 та Cr2(SO4)3.
Напишiть графiчнi формули та знайдiть валентнiсть Феруму в сполуцi Fe(OH)2NO3 та FeOHCl.
Розрахункові задачі:
Визначити: а) число моль Магнію в 0,486 г Mg; б) число моль сульфату алюмінію в 34,2 г Al2(SO4)3; число моль води в 1 л при 4оС і 1,013·105 Па. (Відповідь: а) 0,02 моль; б) 0,1 моль; в) 55,6 моль.)
Визначити вiдносну молекулярну масу дигiдрофосфату залiза(II).
Знайдiть масу гiдроксосульфату алюмiнiю кiлькiстю речовини 0,3 моль.
Виразити в молях і грамах: а) 6,02·1021 молекул ацетилену С2Н2; б) 2,00·1023 молекул фосгену СОCl2. (Відповідь: а) 0,01 моль; 0,26 г; б) 1/3 моль і 33 г.)
Чи однакове число молекул: а) в 1 г водню і в 1 г кисню; б) в 1 молі водню і в 1 молі кисню?
Скiльки молей мiститься в 1л води?
При вiдновленнi воднем 1,34 г оксиду металу до металу утворилося 0,34 г води. Вирахувати еквiвалентну масу металу.
Знайдiть масу мiдного купоросу кiлькiстю речовини 0,5 моль.
1з якої кiлькостi оксиду ртутi(ІІ) видiлиться 16 г кисню?
Оксид мiстить 78,7% металу i 21,3% Оксигену. Питома теплоємнiсть металу 0,21. Визначити його атомну масу.
Пiд час прожарювання СаСО3 масою 1 г отримано СаО масою 0,56 г i СО2 об’ємом 224 мл (н.у.). Чи пiдтверджують цi данi закон збереження маси речовин?
Знайдiть масу гiдроксохлориду залiза(II) кiлькiстю речовини 2,5 моль.
При взаємодiї з кислотою 0,608 г металу витiсняється 560 мл водню (н.у.). Питома теплоємнiсть металу 1,09. Визначити його атомну масу.
Яка маса 1 л кисню при н.у.?
Кiлькiсть сірчаної кислоти 0,2 моль. Якiй масi в грамах це вiдповiдає?
Сполука мiстить 46,15% Карбону, iнше – Нітроген. Густина за повiтрям 1,79. Знайти iстинну формулу сполуки.
Густина газiв за повiтрям рiвна: а) 0,9 б) 2,45. Визначити їх молярнi маси.
Для повного вiдновлення 1,59 г оксиду до металу використано 478 мл водню (при 7оС i 100 кПа). Вирахувати еквiвалент металу.
Найбiльшу кiлькiсть молекул вмiщує 1 л (н.у.) а) хлороводню; б) сiрководню; в) водню; г) води.
Знайдiть масу дигiдрофосфату натрiю кiлькiстю речовини 0,2 моль.
Сполука Бору з Гідрогеном мiстить 78,18% Бору, iнше – Гідроген. Густина за воднем 13,7. Знайти iстинну формулу.
0,2 г металу витiснили 197 мл водню, який був зiбраний над водою i вимiряний при 20оС i 102 кПа. Тиск водяних парiв при цiй температурi 2,37 кПа. Знайти еквiвалент металу.
Знайти найпростішу і дійсну формулу газу, який має такий склад: 82,76% С; 17,24% Н. Густина газу за повітрям 2,01.
При прокалюванні 2,94 г кристалогідрату хлориду кальцію виділилося 1,45 г води. Вивести формулу цього кристалогідрату.
Який об’єм при Р = 1,013·105 Па і t = 0оС займе 1 кг суміші газів: а) 20% NO; 40% N2; 40% CO2; б) 20% C2H2; 40% CH4; 40% CO.
Визначити молекулярні маси газів, якщо: а) 0,29 л газу при температурі 27оС і тиску 1,064·105 Па мають масу 0,32 г; б) 1,56 л газу при 27оС і тиску 1,037·105 Па має масу 2,86 г.
Густина газів за повітрям рівні: а) 0,9; б) 2,45. Визначити масу 1 л кожного газу.
Із скількох атомів складаються молекули: а) парів сірки при температурі 950оС, якщо густина їх за повітрям рівна 2,2; б) парів сурми при 2000оС, якщо густина їх за воднем рівна 60,88?
При прокалюванні деякої кількості Pb(NO3)2 маса його зменшилася на 2,16 г. Визначити масу в грамах і число молів взятої солі і об’єми одержаних кисню і диоксиду азоту при нормальних умовах.
Скільки треба взяти карбонату кальцію, щоб одержаним при його розкладі вуглекислим газом наповнити балон об’ємом 40 л при температурі 15оС і тиску 1,013·106 Па.
Який об’єм кисню, взятого при 300оС і тиску 5,06·105 Па витрачений на згоряння 10 кг кам’яного вугілля до утворення СО2, якщо у вугіллі містилося 94% С. Який об’єм при цих умовах займе утворений СО2?
Визначити процентний вміст карбонату кальцію у вапняку, якщо при прокалюванні 1 г цього вапняку одержано 0,225 л СО2 при 0оС і Р= 0,904·105 Па.
Визначити еквівалентні маси наступних елементів: а) олова, якщо при нагріванні 0,92 г його в струмені кисню утворюється 1,17 г оксиду олова; б) олова, якщо при відновленні 1,17 г оксиду олова воднем одержано 0,16 г води; в) магнію, якщо при нагріванні в струмені кисню його маса збільшилася на 66,7%; г) мангану, якщо при відновленні 2,17 г оксиду мангану алюмінієм утворилося 1,7 г оксиду алюмінію Al2O3.
1 г калію з’єднується з 0,9 г хлору, а також з 2 г брому. Знайти еквівалентні маси калію і брому, якщо еквівалентна маса хлору рівна 35,5.
Скільки оксиду одержиться при окисненні 3 г металу, еквівалентна маса якого рівна 9 г.
Написати формулу сполуки Стибію: а) з Сульфуром; б) з Оксигеном, якщо відомо, що атомна маса Стибію рівна 121,8 г, еквівалентна її маса 40,6 г, атомна маса Сульфуру 32, еквівалентна її маса 16.
Визначити еквівалентні маси кислот і основ в наступних реакціях: а) HNO3+Bi(OH)3 Bi(OH)2NO3+H2O б) H2S+NaOH NaHS+H2O в) 3H2SO4+2Al(OH)3 Al2(SO4)3+6H2O г) H3PO4+Ca(OH)2 CaHPO4+2H2O д) 2HCl+Bi(OH)3 BiOHCl2+2H2O е) 3Ca(OH)2+2H3PO4 Ca3(PO4)2+6H2O
Які об’єми займуть при нормальних умовах маси одного еквіваленту кисню і одного еквіваленту водню.
Визначити еквівалентну масу металу, якщо 0,046 г його витіснили з кислоти 62,35 мл водню, зібраного над водою при температурі 17оС і тиску 1,017·105 Па. Тиск водяної пари при 17оС рівний 0,193·105 Па.
Визначити процентний вміст домішок в технічному сульфіді заліза, якщо при взаємодії 5 г його з кислотою виділилося 0,8 л сірководню при температурі 39оС і тиску 1,617·105 Па.
Густина газу за гелієм рівна 19,5. Яка молекулярна маса цього газу?
Визначити парціальний тиск кисню і азоту в повітрі, якщо їх об’ємні долі складають 21% О2 і 78% N2 (1% припадає на інші гази). Тиск повітря прийняти рівним 1,013·105 Па.
Невідома речовина масою 1,215 г, будучи переведеною в газоподібний стан при температурі 300 К і тиску 0,99·105 Па займає об’єм 375 мл. Визначити його молекулярну масу.
Визначити еквіваленті маси елементів у сполуках HBr, H2O, NH3.
При з’єднанні 5,6 г заліза з сіркою утворилося 8,8 г сульфіду заліза. Знайти еквівалент заліза, якщо відомо, що еквівалента маса сірки рівна 16 г/моль.
Деяка кількість металу, еквівалентна маса якого рівна 28 г/моль, витісняє з кислоти 0,7 л водню, виміряного при н.у. Визначте масу металу.
Фосфор утворює два різних по складу хлориди. Еквівалент якого елемента зберігається в цих сполуках постійним?
Еквівалентна маса металу рівна 12 г/моль. Чому рівна еквівалентна маса його оксиду?
Як слід змінити умови, щоб збільшення маси одного газу не привело до зростання його об’єму: а) понизити температуру; б) збільшити тиск; в) умови підібрати не можна.
При однакових умовах взяті рівні об’єми N2 i O2. Яке співвідношення мас обох газів: а)mO2 mN2 ; б)mN2 mO2 ; в)mN2=mO2 .
Змішали рівня об’єми O2 i Сl2. Як зміниться об’єм газів після проходження між ними хімічної реакції: а) не зміниться; б) збільшиться у 2 рази; в) зменшиться у 2 рази.
Чому рівна густина хлору за повітрям?
Газоподібний оксид містить 30,4 % Нітрогену. В молекулу оксиду входить один атом Нітрогену. Чому рівна густина газу за киснем: а) 0,94; б) 1,44; в) 1,5?
Маса 2,24 л газу (н.у.) рівна 2,8 г. Чому рівна молекулярна маса газу?
Простіша формула гідразину NH2. Яка його дійсна формула, якщо густина пари гідразину за повітрям рівна 1,1: а) NH2; б) N2H4; в) N3H6.
Метал витісняє з кислоти 16,8 мл Н2 (н.у.). Який об’єм N2 необхідний для зв’язування цієї кількості водню в NH3: а) 11,2 мл; б) 5,6 мл; в) 8,4 мл.
При розкладі CaCO3 виділилося 11,2 л CO2 (н.у.). Чому рівна маса KOH, необхідного для зв’язування виділеного газу в карбонат: а) 56 г; б) 112 г; в) 28 г.
Визначити реакцію середовища в розчині після взаємодії 90 г NaOH з 73 г HCl: а) нейтральне; б) кисле; в) лужне.
Лабораторна робота:
Дослід 1. Визначення еквівалентної маси металу прямим способом.
Для визначення еквівалентної маси металу цим методом потрібно одержати оксид металу і експериментально встановити, яка маса кисню сполучається із взятою для досліду масою магнію.
Хід роботи:
Зважити на вагах 0,2 г магнію і перенести його в попередньо зважений фарфоровий тигель.
Розрахувати, який об’єм 4 н розчину азотної кислоти треба взяти для повного розчинення наважки магнію. Послідуючі операції виконувати у витяжній шафі! Приливати розчин азотної кислоти в тигель невеликими порціями до повного розчинення металу.
Одержаний розчин нітрату магнію обережно випарити до сухого стану, а потім прожарити. Написати відповідні рівняння реакцій. Прожарений тигель з оксидом магнію охолодити в ексикаторі і зважити. Потім повторно прожарити тигель і після охолодження в ексикаторі знову зважити, для того, щоб переконатися в сталості його маси.
Користуючись даними, одержаними під час експерименту, визначити еквівалент магнію.
Форма запису спостережень:
Маса фарфорового тиглю.
Маса магнію
Маса фарфорового тигля з оксидом магнію.
Обробка результатів:
Обчислити: 1) масу одержаного оксиду магнію – m1;
масу кисню, з’єднаного з магнієм – m2;
еквівалентну масу магнію за еквівалентною масою кисню – mE(експ.)
теоретичну еквівалентну масу магнію mE(теор.)=
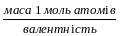
абсолютну похибку досліду δ = mE(теор.)–mE(експ.)
відносну похибку досліду δ % =
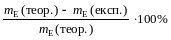
Дослiд 2. Визначення хiмiчного еквiваленту металу за об’ємом витiсненого водню.
В данiй роботi кожному студенту видається попередньо зважена пластинка з металу, еквiвалент якого потрiбно визначити. Дослiд виконується в спецiальному приладi.
Опис приладу:
Прилад для визначення хiмiчного еквiваленту (рис.1) складається з бюретки (1), двоколiнноi пробiрки (пробiрки Оствальда)(2), вiдкритої трубки, що служить урiвнювальною склянкою (3), трiйника iз зажимом на одному кiнцi (4). Для сполучення використовуються гумовi трубки i пробки з просвердленими отворами. Для закрiплення приладу використовується штатив з тримачами і зажимами.
Виконання роботи:
У вiдповiдностi з рисунком складiть прилад, при цьому залишайте затискач вiдкритим. В урiвнювальну склянку налийте воду, яка заповнить бюретку i витiснить з приладу надлишок повiтря. Бюретку закрiпiть в штативi таким чином, щоб рiвнi води в бюретцi i у вiдкритiй трубцi спiвпадали з нульовою подiлкою. (Вiдрахунок рiвня рiдини проводиться по нижньому краю менiска.)
В одне з колiн пробiрки помiстiть виданий шматочок металу, а в друге налийте близько 10 мл 2н. розчину соляної кислоти. Пробiрку закрийте пробкою з трубкою, сполученою з трiйником. Зажим закрийте i перевiрте прилад на герметичнiсть. Для цього знiмiть з тримача урiвнювальну склянку i опустiть її вниз на 15-20 см. При цьому рiвень води в бюретцi трошки понизиться, а далi залишатиметься без змiн. При поверненнi склянки на попереднє мiсце вода в нiй i в бюретцi повинна бути на тому ж нульовому рiвнi. Якщо прилад не герметичний, то знайдiть мiсце пропускання повiтря i добийтеся герметичностi в цьому мiсцi.
Пiсля встановлення герметичностi приладу повернiть двоколiнну пробiрку таким чином, щоб кислота перелилася в колiно з металом. Водень, що видiляється в результатi взаємодiї металу з кислотою, витiсняє з бюретки воду. Урiвнювальну склянку при цьому потрiбно опускати i пiд час дослiду намагатися тримати воду в нiй i в бюретцi на одному рiвнi, щоб тиск газу всередині приладу був весь час близьким до атмосферного. Пiсля того, як температура в двоколiннiй пробiрцi зрiвняється з кiмнатною (приблизно через 10-15 хв), вiдмiтьте рiвень води в бюретцi, визначивши тим самим об’єм (в мл) водню, що видiлився в результатi реакцii.
Запишiть покази термометра i барометра в лабораторії.
Форма запису результатiв вимiрювань:
Маса зразка металу m, г
Об’єм витiсненого газу в умовах дослiду V, мл
Температура дослiду t,С
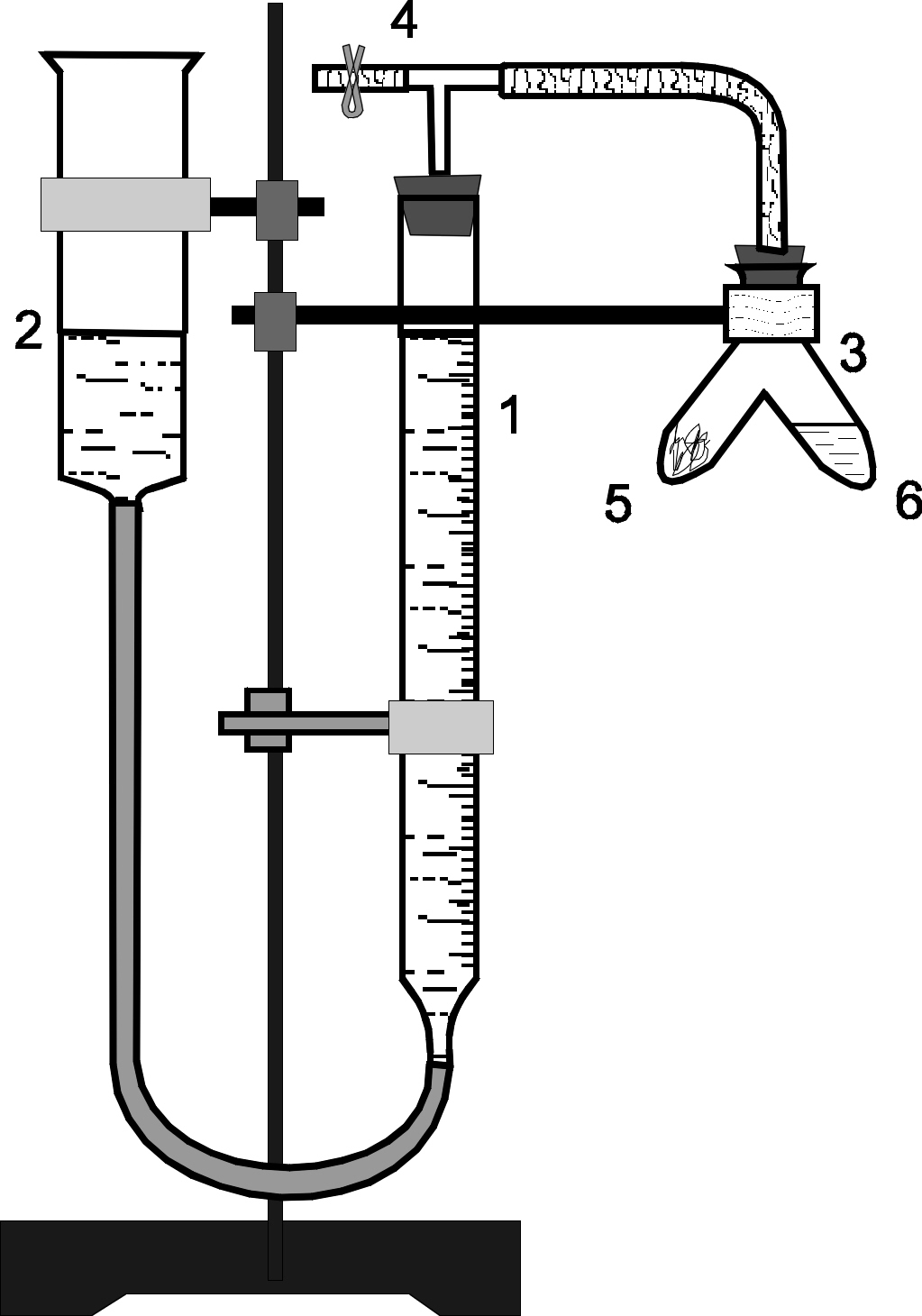
Рис.1. Прилад для визначення еквівалентної маси металу: 1 – бюретка; 2 – урівнювальна склянка; 3 – двоколінна пробірка; 4 – трійник з зажимом; 5 – метал; 6 – соляна кислота.
Атмосферний тиск (по барометру) P, кПа
Проведення розрахункiв:
Розрахувати об’єм виділеного водню при н.у.
Водень, що збирається над водою, мiстить водяну пару i загальний тиск газу в бюретцi (рiвний атмосферному) складається з парцiальних тискiв водню i водяної пари. Значення тиску водяної пари h беруться з вiдповiдноi таблицi:
t,С |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
P, мм рт.ст. |
9,21 |
10,52 |
11,99 |
13,63 |
15,48 |
17,54 |
19,83 |
Тодi
об’єм водню при н.у. визначається по
рiвнянню
![]() ,
при цьому поперденьо необхідно атмосферний
тиск (покази барометра) виразити в мм
рт.ст.
,
при цьому поперденьо необхідно атмосферний
тиск (покази барометра) виразити в мм
рт.ст.
Розрахувати еквiвалент металу по формулi
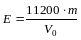 (еквівалент вiдповiдає масі металу, яка
витісняє 11200 мл (н.у.) Н2).
(еквівалент вiдповiдає масі металу, яка
витісняє 11200 мл (н.у.) Н2).
Дослiд проведiть два рази. Величину хiмiчного еквiваленту металу розрахуйте як середню з двох визначень. Знаючи, що хiмiчний еквiвалент елементу дорiвнює частцi вiд дiлення атомної маси на валентнiсть, порiвняйте визначену експериментально величину еквiваленту з її теоретичним значенням, взятим з таблицi Менделеєва.
3. Вирахуйте величину абсолютної i вiдносної похибки.
Дослiд 3. Визначення еквiваленту невiдомої кислоти.
Дайте лаборанту чисто вимиту мiрну колбу на 100 мл, в яку вам видадуть кiлька мiлiлiтрiв розчину невiдомої вам кислоти. Маса кислоти (г), що мiститься в мiрнiй колбочцi, студенту вказується. Мiрну колбу обережно заповнiть водою до мiтки i перемiшайте. Пiпеткою вiдберiть 5 мл дослiджуваної кислоти, вилийте її в конiчну колбочку, додайте туди 2-3 краплi фенолфталеїну i вiдтитруйте розчин кислоти розчином лугу.
Проведення титрування:
Заповнiть бюретку титрованим розчином лугу. Для цього закрiпiть бюретку в штативi, вставте лiйку i наливайте з стаканчика в бюретку розчин лугу, кран бюретки при цьому повинен бути закритим. Пiдставте пiд бюретку конiчну колбочку i повнiстю вiдкрийте кран бюретки. При цьому носик бюретки повинен заповнитися лугом повнiстю. Якщо таке заповнення носика лугом не вiдбудеться, то слiд випустити весь розчин лугу в колбочку, опустити в неї носик бюретки i затягнути розчин в бюретку через носик з допомогою спецiальної грушi (при вiдкритому кранi). Втягування розчину проводити тiльки до рiвня трохи вище крану. Повне заповнення бюретки до нульового рiвня проводити вказаним вище способом.
Кислоту, об’єм якої точно встановлений, помiстити в конiчну колбу, додати туди кiлька крапель iндикатору. Колбочку помiстити пiд носиком бюретки так, щоб при вiдкритому кранi луг iз бюретки по краплям доливався до кислоти. Вiдкрити кран так, щоб луг капав в колбу i пiсля кожної краплi перемiшувати вмiст конiчної колби круговими рухами. Таке додавання лугу по краплям слiд проводити до змiни кольору iндикатору. При змiнi кольору iндикатору вiдмiтити об’єм затраченого лугу.
Значення об’ємiв лугу i кислоти використовують для проведення розрахункiв.
Розрахунок еквiваленту кислоти:
Нехай видано кислоти m, г
Тодi маса кислоти в пробi 5 мл 0,05 m, г
Oб’єм лугу, що затрачається на титрування проби V мл
Маса
лугу, що затрачається на титрування
проби:
![]() (для NaOH)
(для NaOH)
Тодi
еквiвалент кислоти буде складати
![]()
Дослід 4. Визначення молекулярної маси вуглекислого газу.
Для одержання вуглекислого газу використовується установка, що складається з апарата Кiппа (зарядженого кусками мармуру і соляною кислотою), двох промивних склянок (перша заповнена водою для очистки вуглекислого газу вiд хлороводню, друга – концентрованою сiрчаною кислотою для осушування газу) i колби для збирання газу(рис.2).
Порядок виконання роботи:
Рис.2. Прилад для визначення молекулярної
маси вуглекислого газу: 1 – апарат
Кiппа; 2,3 – промивні склянки; 4 –
газовiвiдна трубка; 5 – колба для збирання
газу
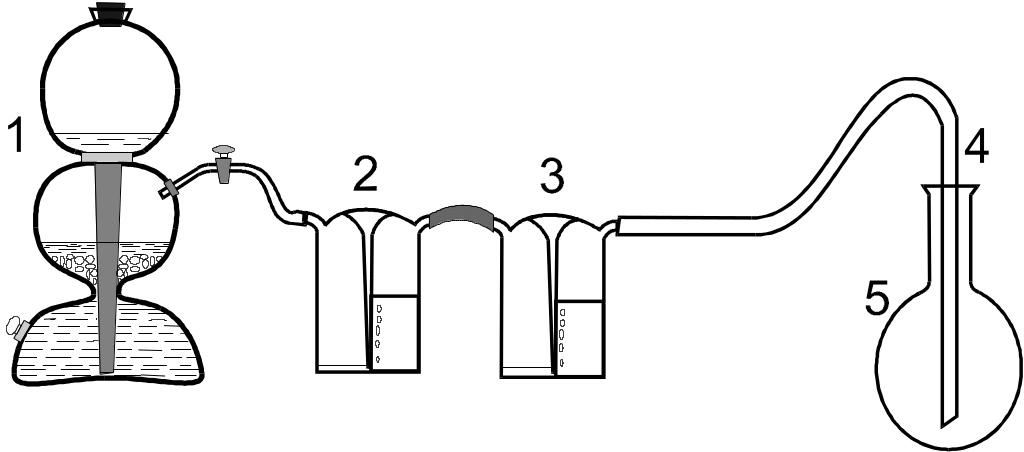
Заповнити колбу вуглекислим газом з апарату Кiппа. Для цього газовiдвiдну трубку опустити на дно колби i вiдкрити кран апарату. Газ пропускати протягом 1–1,5 хвилин. Повноту заповнення можна перевiрити за допомогою запаленого сiрника (в атмосферi вуглекислого газу сiрник гасне). Колбу, заповнену вуглекислим газом, закрити пробкою i зважити (на тих же вагах i з тiєю ж точнiстю). Операцiю заповнення колби газом i зважування слiд провести кiлька разiв до одержання сталого значення маси, при цьому слiдкувати, щоб колба була закрита пробкою до мiтки.
Для визначення об'єму колби заповнити її водою до мiтки, потiм воду з колби вилити в мiрний цилiндр.
Записати покази термометра i барометра пiд час дослiду.
Форма запису спостережень:
1. Маса колби (з пробкою) з повiтрям m1 (г)
2. Маса колби (з пробкою) з СО2 m2 (г)
3. Об’єм колби V (мл)
4. Температура t (C)
5. Тиск р (кПа)
Порядок проведення розрахункiв:
Об'єм повiтря в колбi V привести до нормальних умов (То=273 К, ро=101,3 кПа) по формулi
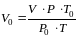 .
.Вирахувати масу повiтря m3, що знаходиться в колбi, знаючи, що маса 1 л повiтря при н.у. складає 1,29 г.
Вирахувати масу вуглекислого газу в колбi m(СО2) по формулi: m(СО2) = m2 –(m1-m3).
Вирахувати густину СО2 за повiтрям по формулi:
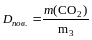 .
.Вирахувати вiдносну молекулярну масу вуглекислого газу Mr(CO2) = 29·Dпов.
Вирахувати абсолютну i вiдносну похибки дослiду.
Користуючись результатами експерименту, здiйснити розрахунки вiдносної молекулярної маси iншими методами:
а) за густиною СО2 за воднем по формулi
![]() (1
л водню має масу 0.089 г);
(1
л водню має масу 0.089 г);
б) за молярним об’ємом
Mr(CO2)
=![]() ;
;
в) за рiвнянням Менделєєва-Клапейрона
![]()
ОСНОВНІ ЗАКОНОМІРНОСТІ ХІМІЧНИХ ПРОЦЕСІВ
Енергетика хімічних процесів
Хімічна кінетика і рівновага
Програмні вимоги до теми:
Термодинамічні системи. Параметри, що характеризують стан системи. Поняття про функцію стану системи. Фізичний зміст внутрішньої енергії системи як функції стану. Ентальпія системи. Тепловий ефект реакції. Одиниці вимірювання теплового ефекту реакції. Термохімічні рівняння реакції. Екзотермічний та ендотермічний процес. Стандартна ентальпія утворення хімічної сполуки. Закон Гесса і наслідки з нього. Ентропійний фактор процесу. Стандартна ентропія речовини. Ізобарно-ізотермічний потенціал та енергія Гіббса.
Швидкість хімічної реакції. Середня і дійсна швидкість хімічної реакції. Гомогенні та гетерогенні хімічні реакції. Фактори, що впливають на швидкість хімічних реакцій. Закон діючих мас. Константа швидкості хімічної реакції. Фізичний зміст константи швидкості. Закон діючих мас для гетерогенних реакцій. Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт швидкості хімічних реакцій.
Активні молекули. Енергія активації хімічної реакції. Вплив величини енергії активації на швидкість реакції. Класифікація хімічних реакцій по числу часток, що приймають участь в ній участь. Ланцюгові реакції. Механізм їх проходження.
Каталіз. Каталізатори та інгібітори. Вплив каталізатора на енергію активації хімічної реакції. Гомогенний і гетерогенний каталіз. Вибіркова дія каталізатора. Механізм гомогенного і гетерогенного каталізу. Роль адсорбції в гетерогенному каталізі. Каталітичні отрути і промотори.
Оборотні та необоротні хімічні реакції. Стан хімічної рівноваги. Константа хімічної рівноваги. Особливості вираження константи рівноваги для гетерогенних хімічних реакцій. Зв’язок константи рівноваги з енергією Гіббса. Умови, що впливають на зміну хімічної рівноваги. Принцип Ле-Шательє. Вплив зміни температури, тиску і концентрації на зміщення рівноваги.
Короткий виклад теоретичних питань:
