
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Закони електролізу (м.Фарадей)
- •2. Рівні кількості електрики виділяють при електролізі з різних хімічних сполук еквівалентні кількості речовин.
- •Масу речовини, що виділилася при електролізі, розраховують за формулою
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Окисно-відновні процеси електрохімічні процеси корозія
Програмні вимоги до теми:
Хімічні реакції та принципи їх класифікації. Ступінь окиснення, окисник, відновник, процес окиснення, процес відновлення. Окисно-відновні реакції. Класифікація окисно-відновних реакцій. Зміна окисно-відновних властивостей простих речовин в залежності від положення відповідних елементів в періодичній системі Д.І.Менделєєва. Правила розстановки коефіцієнтів методом електронного та електронно-іонного балансу. Вплив середовища на протікання окисно-відновних реакцій. Визначення еквівалентних мас окисника і відновника.
Поняття про електродні потенціали і методи їх визначення. Ряд стандартних електродних потенціалів. Водневий електрод і вимірювання електродних потенціалів металів. Залежність електродного потенціалу від концентрації і температури. Рівняння Нернста. Будова і принцип роботи гальванічних елементів.
Електроліз. Поняття “катод”, “анод”, “катіон”, “аніон”, “катодний процес”, “анодний процес”. Електроліз розплавів солей Електроліз водних розчинів солей на інертних та розчинних електродах. Фактори, що визначають характер катодного та анодного процесів при електролізі водних розчинів електролітів. Закони Фарадея. Вихід по струму.
Визначення і класифікація корозійних процесів. Хімічна корозія. Електрохімічна корозія. Захист металів від корозії.
Короткий виклад теоретичних питань:
ССтупінь окиснення елементу
тупенем окиснення прийнято
називати заряд атома в молекулі,
розрахований на основі припущення, що
всі зв’язки в молекулі носять іонний
характер, тобто, що зв’язок між атомами
в молекулі виникає за рахунок переходу
електрона від менш електронегативного
до більш електронегативного атома. У
простих речовинах ступінь окиснення
завжди дорівнює нулю, оскільки всі атоми
мають одинакову електронегативність.
У сполуках ступені окиснення елементу
можуть мати як позитивні значення (у
випадку зміщення електронів від даного
атома), так і негативні (у випадку зміщення
електронів до даного атома). Тому в
сполуці негативний ступінь окиснення
мають елементи, електронегативнь яких
більша, а позитивний – ті елементи,
електронегативність яких менша. Ступінь
окиснення не завжди співпадає з
валентністю. Наприклад, у гідразині
![]() ступінь окиснення Нітрогену +2, а
валентність 3.
ступінь окиснення Нітрогену +2, а
валентність 3.
Фізичний зміст поняття ступеня окиснення (с.о.):
с.о. якогось елементу в сполуці +n означає, що атом даного елементу віддав n електронів на утворення зв’язків (нестача електронів);
с.о. якогось елементу в сполуці –n означає, що атом даного елементу при утворенні зв’язків прийняв n електронів (надлишок електронів);
с.о. 0 означає, що кількість протонів і електронів у атому рівна, а молекула утворена за рахунок ковалентних неполярних зв’язків (такий ступінь окиснення властивий простим речовинам).
Правила встановлення с.о. елементу в сполуці:
молекула в цілому електронейтральна (алгебраїчна сума позитивних та негативних зарядів атомів в молекулі дорівнює нулю);
алгебраїчна сума позитивних і негативних с.о. всіх атомів, що утворюють складний іон, дорівнює заряду іона;
с.о. елементу в простих речовинах дорівнює нулю;
с.о. Оксигену в усіх сполуках дорівнює –2 (крім пероксидів типу
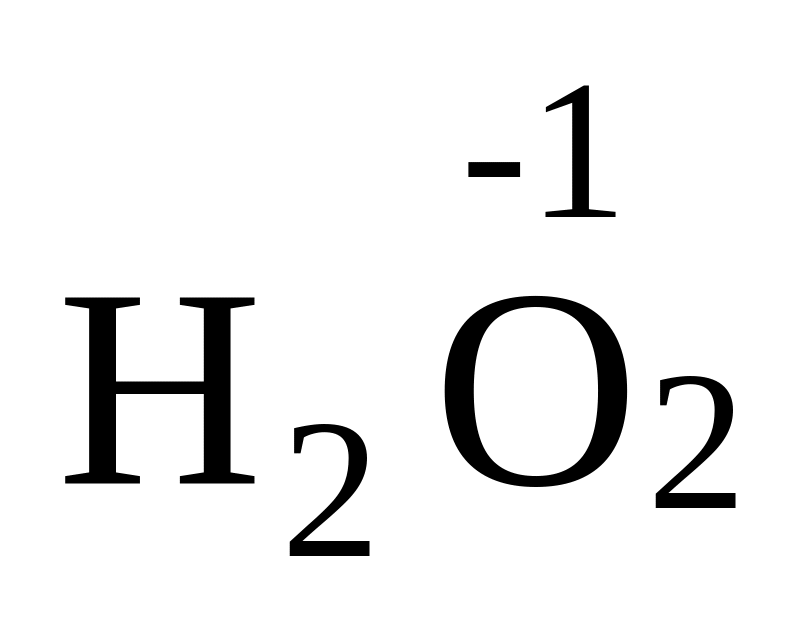 ,
Na2
,
Na2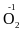 ,
надпероксидів типу
,
надпероксидів типу
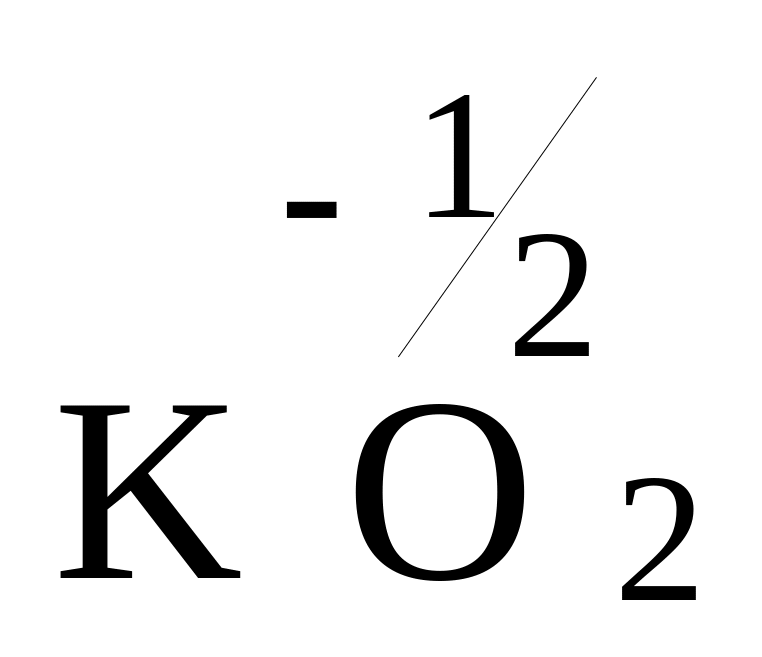 ,
сполук Оксигену з Флуором (
,
сполук Оксигену з Флуором (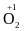 F2,
F2,
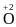 F2);
F2);с.о. Гідрогену в усіх сполуках дорівнює +1 (крім гідридів типу Na
 );
);с.о. катіонів металів в основах та солях співпадає з зарядом катіону;
с.о. елементів, що входять в склад аніону солі, така ж, як і у аніоні відповідної кислоти;
с.о. лужних металів в сполуках завжди +1, лужноземельних – +2, Алюмінію – +3;
с.о. Флуору в сполуках завжди –1.
Слід мати на увазі, що позитивний ступінь окиснення не може перевищувати величину, що дорівнює номеру групи періодичної системи.
Користуючись цими правилами, в результаті нескладних арифметичних підрахунків можна оцінити с.о. атомів, які утворюють молекули чи іони. Алгебраїчний спосіб визначення ступеня окиснення показано на прикладі відомих сполук Сульфуру:
H2S:
![]() (+1)·2
+ (x)·1
= 0 x
= –2 Н2
(+1)·2
+ (x)·1
= 0 x
= –2 Н2![]()
SО2: ![]()
![]() (x)·1
+ (–2)·2
= 0 x
= +4
(x)·1
+ (–2)·2
= 0 x
= +4 ![]() О2
О2
H2SО4: ![]()
![]() (+1)·2
+ (x)·1
+ (–2)·4
= 0 x
= +6 Н2
(+1)·2
+ (x)·1
+ (–2)·4
= 0 x
= +6 Н2![]() О4
О4
Йон SО42–: (x)·1 + (–2)·4 = –2 x = +6 О42–
Na2S2O7: ![]()
![]()
![]() (+1)·2
+ (x)·2
+ (–2)·7
= 0 x
= +6 Na2
2O7
(+1)·2
+ (x)·2
+ (–2)·7
= 0 x
= +6 Na2
2O7
З розглянутих прикладів видно, що виконується така послідовність операцій:
над символами елементів проставляють відомі з правил с.о.; при цьому визначуваний с.о. позначають x ;
складають рівняння з одним невідомим x: для цього заряд кожного елементу (вказаний в круглих дужках) множиться на кількість атомів цього елементу, складається алгебраїчна сума цих зарядів в сполуці, яка прирівнюється до 0 для сполуки або дорівнює його заряду для іона.
розв’язують рівняння з одним невідомим і визначають x, тобто значення с.о. елементу.
