
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Закони електролізу (м.Фарадей)
- •2. Рівні кількості електрики виділяють при електролізі з різних хімічних сполук еквівалентні кількості речовин.
- •Масу речовини, що виділилася при електролізі, розраховують за формулою
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Окисно-відновні електроди
Окисно-відновними прийнято
називати такі електроди, метал яких не
приймає участі в окисно-відновній
реакції, а тільки переносить електрони.
Процес окиснення та відновлення
відбувається між речовинами, що
знаходяться в розчині, у який занурено
електрод. Отже, до окисно-відновних, або
редокс-електродів, належать електроди,
які складаються з інертного металу (Pt,
Au), зануреного в розчин, в якому містяться
окиснена та відновлена форми одного і
того ж елементу.
При зануренні платинової дротинки у розчин, що містить іони Fe2+ та Fe3+, утвориться напівелемент, схематичне зображення якого Pt | Fe2+, Fe3+. Електродна реакція:
Fe3+ + e– = Fe2+
Іони Fe3+ відновлюються до Fe2+ за рахунок електронів, одержаних від платини, яка є провідником електронів. У результаті цього процесу електрод отримує додатній заряд і притягує аніони з розчину. На поверхні платини утворюється подвійний електричний шар з певним стрибком потенціалу. Величина цього електродного потенціалу залежить від активності іонів Fe2+ i Fe3+ і визначається рівнянням Нернста:
![]()
Іонселективні електроди
Це
електрохімічні датчики, потенціали
яких однозначно визначаються активністю
певного виду іонів у розчині. Ці іони
називаються потенціало-утворюючими,
а електроди – іонселективними.
Рис.12.
Іонселективний
електрод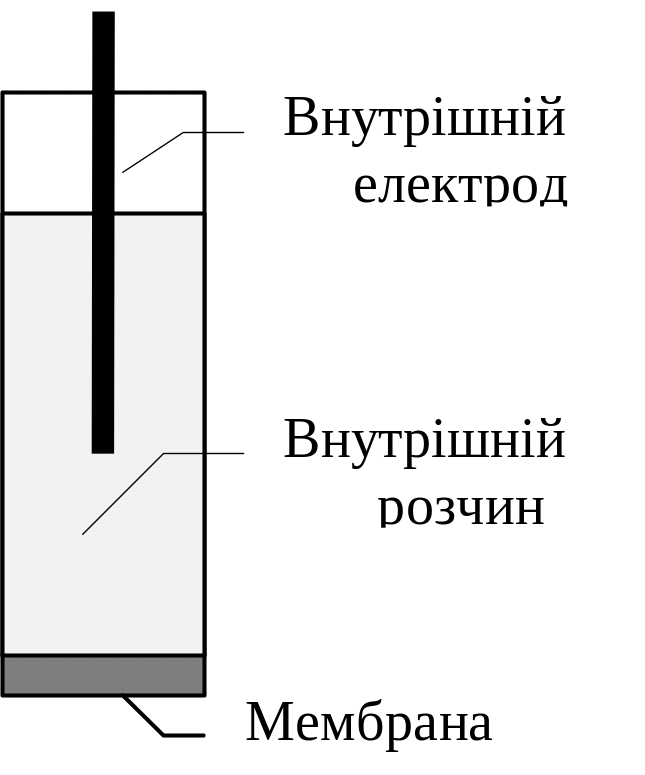
Електроліз
Електролізом
називають сукупність хімічних процесів,
що протікають на електродах, занурених
у розчин або розплав електроліту, під
дією електричного струму. Сутність
електролізу полягає в тому, що при
пропусканні електричного струму через
розчин (або розплав) електроліту позитивно
заряджені іони (катіони) переміщуються
до катода, а негативно заряджені (аніони)
– до анода. Досягши електродів, іони
розряджаються, у результаті чого на
електродах виділяються складові частини
розчиненого електроліту або водень і
кисень з води.
Рис.13.
Схема
роботи електролізера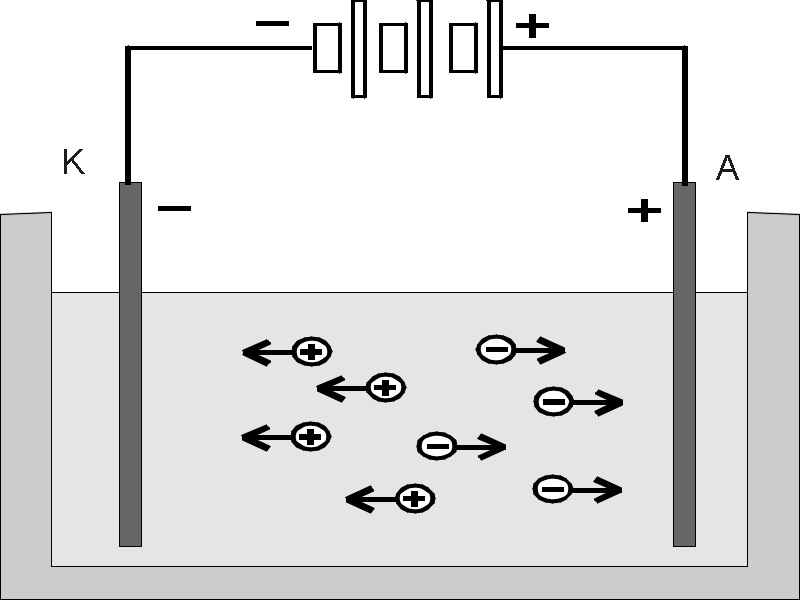
Величина потенціалу металу залежить також і від концентрації його іонів у розчині, тому так само змінюється і легкість розряду іонів кожного металу в залежності від їхньої концентрації: збільшення концентрації полегшує розряд іонів, зменшення – утруднює. Тому при електролізі розчину, що містить іони декількох металів може статися, що виділення більш активного металу буде відбуватися раніш, ніж виділення менш активного (якщо концентрація іонів першого металу значна, а другого – дуже мала).
У водних розчинах солей, крім іонів солі, завжди існують ще й іони Н+ і ОН– (внаслідок незначної дисоціації Н2О). Іони Н+ будуть розряджатися легше, ніж іони всіх металів, що стоять в ряді напруг до Н. Однак через незначну концентрацію іонів Н+ при електролізі всіх солей, крім солей найбільш активних металів, на катоді відбувається виділення металу, а не водню. Тільки при електролізі солей натрію, кальцію й інших металів до алюмінію включно розряджаються іони Н+ і виділяється водень.
На аноді можуть розряджатися іони кислотних залишків, а також гідроксильні іони ОН–. Якщо іони кислотних залишків не містять кисню (Cl–, S2–, CN– і ін.), то звичайно розряджаються саме ці іони, і на аноді виділяються Cl2, S і т.д. Навпаки, якщо електролізу піддається сіль кисневмісної кислоти чи сама кислота, то розряджаються гідроксильні іони, а не іони кислотних залишків. Нейтральні групи, що утворяться при розряді гідроксильних іонів ОН– миттєво розкладаються по рівнянню:
4OH ® 2H2O + O2↑
У результаті на аноді виділяється кисень.
Електроліз розплаву хлориду магнію MgCl2. Розплав містить іони Mg2+ і Cl–. При протікання струму іони Mg2+ переміщуються до катода, а іони Cl– – до анода. Приймаючи від катода два електрони, іони Mg2+ перетворюються в нейтральні атоми, На катоді виділяється магній. Іони хлору, досягаючи анода, віддають йому електрони і перетворюються в атоми хлору, що, з'єднуючись попарно, утворять молекули хлору. На аноді виділяється хлор.
–К: Mg2+ + 2 е → Mg0
+А: 2Cl– – 2е → Cl2↑
Електроліз розчину хлориду нікелю NiCl2. Розчин містить іони Ni2+ і Cl–, а також у незначній концентрації іони Н+ і ОН–. При протіканні струму іони Ni2+ переміщуються до катоду, а іони Cl– – до аноду. Приймаючи від катода два електрони, іони Ni2+ перетворюються в нейтральні атоми, що виділяються з розчину. Катод поступово покривається нікелем.
–К: Ni2+ + 2 е → Ni0
Іони хлору, досягаючи аноду, віддають йому електрони і перетворюються в атоми хлору, що, з'єднуючись попарно, утворять молекули хлору. На аноді виділяється хлор.
+А: 2Cl– – 2е → Cl2↑
Отже, на катоді відбувається процес відновлення, а на аноді – процес окиснення.
Електроліз розчину йодиду калію KI. Йодид калію знаходиться в розчині у виді іонів К+ і I–. При пропусканні струму іони К+ переміщуються до катоду, іони I– – до аноду. Але оскільки калій стоїть в ряді напруг набагато лівіше водню, то на катоді розряджаються не іони калію, а молекули води. Атоми водню, що утворяться при цьому, з'єднуються в молекули Н2, і в такий спосіб на катоді виділяється водень.
–К: 2Н2О + 2 е → Н20↑+ 2ОН–
+А: 2I– – 2е → I2
В міру розряду іонів водню відбувається дисоціація нових молекул води, внаслідок чого біля катода накопичуються гідроксильні іони (що звільняються з молекули води), а також іони К+, що безупинно переміщуються до катода. Утвориться розчин КОН.
Електроліз розчину сульфату калію K2SO4. Розчин містить іони K+, SO42- та іони Н+ і ОН- з води. Йони K+ розряджаються важче, ніж іони Н+, а іони SO42-, ніж іони ОН-, тому на катоді будуть розряджатися іони Н+, а на аноді – іони ОН-, тобто фактично буде відбуватися електроліз води. У той же час внаслідок розряду водневих і гідроксильних іонів води і безупинного переміщення іонів K+ до катода, а іонів SO42- до анода, біля катода утвориться розчин лугу (КОН), а біля анода – розчин сірчаної кислоти.
Електроліз розчину сульфату купруму при мідному аноді. Коли анод зроблений з того ж металу, сіль якого знаходиться в розчині, ніякі іони не розряджаються на аноді, але сам анод поступово розчиняється, посилаючи в розчин іони і віддаючи електрони джерелу струму.
–К: Сu2+ + 2 е → Cu0
+А: Cu0 → Cu2+ + 2е
Весь процес зводиться до виділення міді на катоді і поступовому розчиненні анода. Кількість CuSO4 у розчині залишається незмінною.
