
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Закони електролізу (м.Фарадей)
- •2. Рівні кількості електрики виділяють при електролізі з різних хімічних сполук еквівалентні кількості речовин.
- •Масу речовини, що виділилася при електролізі, розраховують за формулою
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Закон кратних відношень
Закон
кратних відношень відкритий Дж.Дальтоном
у 1803 році: якщо
два елементи утворюють між собою кілька
хімічних сполук, то масові кількості
одного з елементів, що припадають у цих
сполуках на ту саму масову кількість
другого елемента відносяться між собою
як прості цілі числа.
Оксиди Нітрогену
-
Сполука
Вміст елементу в сполуці, мас.%
(О), що припадає на (N)=1
Співвідношення між кількостями О
(N)
(О)
N : О
в сполуках
N2O
63,7
36,3
1 : 0,57
1
NO
46,7
53,3
1 : 1,14
2
N2O3
36,9
63,1
1 : 1,71
3
NO2
30,5
69,5
1 : 2,28
4
N2O5
25,9
74,1
1 : 2,85
5
Газові закони
Стан даної маси газу визначається температурою t, тиском р і об’ємом V. Якщо р = 1,01325·105 Па і t = 0оС, то умови, при яких знаходиться газ, називають нормальними (н.у.). Об’єм при н.у. прийнять позначати V0, а тиск – р0. Стан газу, що знаходиться при умовах, відмінних від нормальних, описується такими законами:
При постійній температурі об’єм даної маси газу обернено пропорційний тиску (закон Бойля-Маріотта) (1660-1677 рр.):
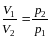 або: при Т
= const р·V
= const
або: при Т
= const р·V
= constПри постійному тиску об’єм даної маси газу при підвищенні його температури на 1оС збільшується на 1/273,15 частину об’єму V0, який газ займав при 0оС: V = V0(1+
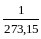 t)
або V
= V0
t)
або V
= V0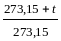 .
Якщо ввести позначення абсолютної
температури Т
= t+273,15
К, то одержимо:
.
Якщо ввести позначення абсолютної
температури Т
= t+273,15
К, то одержимо:
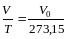 ,
так як
,
так як
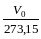 є величина постійна, то маємо:
є величина постійна, то маємо:
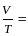 const
при
р
= const (закон
Гей-Люссака, 1802 р.).
const
при
р
= const (закон
Гей-Люссака, 1802 р.).
При постійному об’ємі залежність тиску даної маси газу від температури виразиться рівнянням р = р0(1+ t) або
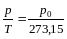 =
const
при
V
= const (закон
Шарля, 1787 р.)
=
const
при
V
= const (закон
Шарля, 1787 р.)
Закон Авогадро
У рівних
об’ємах різних газів за однакових умов
(тиск, температура) міститься однакове
число молекул.
Наслідки:
1)так як число молекул в 1 молі будь-якої
речовини постійне, то різні речовини
кількістю 1 моль в газоподібному стані
при однакових умовах займають рівні
об’єми. Молярний об’єм ідеального газу
(при н.у.) Vm0
= 22,414·10–3
м3/моль
= 22,414 л/моль. Звідси випливає, що густину
газу, тобто масу 1 л (при н.у.) можна
визначити, якщо відома його молярна
маса М:
0=![]() ;
2) співвідношення густин двох газів за
однакових умов дорівнює співвідношенню
їх відносних молекулярних або молярних
мас: 1/2=М1/М2.
;
2) співвідношення густин двох газів за
однакових умов дорівнює співвідношенню
їх відносних молекулярних або молярних
мас: 1/2=М1/М2.
Об’єднуючи
закони Бойля-Маріота, Гей-Люсака і Шарля
одержимо рівняння
стану ідеального газу
![]() =
=
![]() =
=![]() =... =
=... =
![]() =const
=const
