
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Закони електролізу (м.Фарадей)
- •2. Рівні кількості електрики виділяють при електролізі з різних хімічних сполук еквівалентні кількості речовин.
- •Масу речовини, що виділилася при електролізі, розраховують за формулою
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Стандартний електродний потенціал
Величина електродного потенціалу,
що виникає на межі метал – розчин солі,
визначається рівнянням Нернста:
![]()
де z– валентність метала в даній сполуці (кількість електронів, яку втрачає атом, перетворюючись на іон); C – концентрація іонів металу в даному розчині; R – газова стала; F – число Фарадея; T – абсолютна температура; E0 – стала, що входить до складу потенціалу для даного металу та розчину при даній температурі. Це рівняння виражає залежність потенціалу метала від концентрації його іонів у розчині і називається рівнянням електродного потенціалу.
Підставивши в рівняння Нернста числові значення постійних та перейшовши від натурального логарифма до десяткового, для 25 ОС одержуємо наступне рівняння:
![]()
При
С
= 1 г-іон/л
![]() .
Отже, постійна величина Е0
дорівнює потенціалу метала відносно
розчину солі цього металу з концентрацією
іонів 1 г-іон/л. Цей потенціал Е0
називається нормальним,
або стандартним
потенціалом
за даної температури; він не залежить
від інших складових розчину, є величиною
постійною і характерною для даного
метала.
.
Отже, постійна величина Е0
дорівнює потенціалу метала відносно
розчину солі цього металу з концентрацією
іонів 1 г-іон/л. Цей потенціал Е0
називається нормальним,
або стандартним
потенціалом
за даної температури; він не залежить
від інших складових розчину, є величиною
постійною і характерною для даного
метала.
Водневий електрод
Виміряти
стрибок потенціалу на одному окремо
взятому електроді неможливо, але можна
виміряти значення стрибка потенціалу
на межі метал–розчин відносно якого-небудь
іншого електроду, абсолютне значення
стрибка потенціалу якого прийнято за
нуль. За міжнародною угодою за нуль
прийнято потенціал так званого нормального
водневого електроду:
це платиновий електрод, занурений в
розчин з концентрацією іонів водню, яка
дорівнює 1 г-іон/л, і насичений воднем
при тиску 101,3 кПа
Рис.11. Водневий
електрод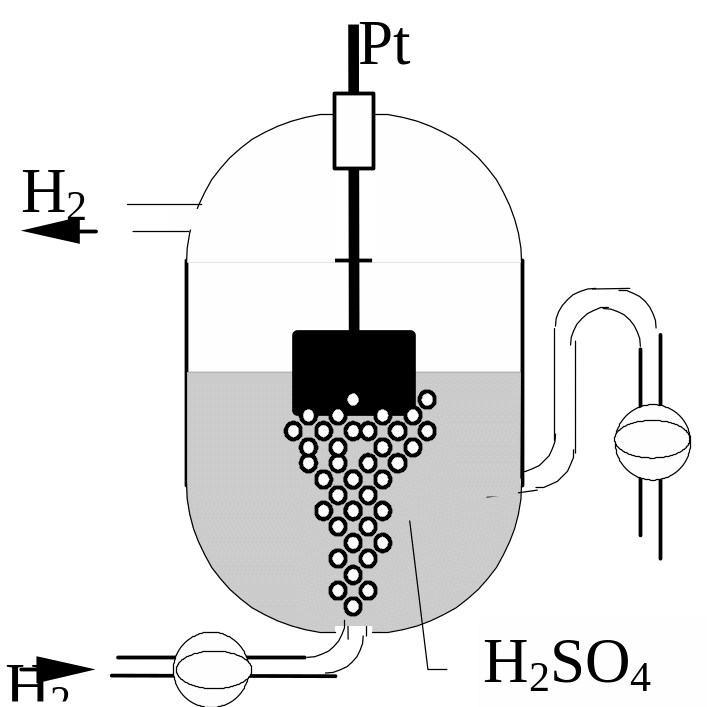
Розчинений у платині молекулярний водень частково дисоціює на атоми: Н2 = 2Н, які переходять в іонний стан: 2Н = 2Н+ + 2е–, і на межі Н2 | 2Н+ виникає стрибок потенціалу, який має певну величину.
Величина потенціалу водневого електроду за даної температури визначається, з одного боку, концентрацією іонів в розчині, а з другого – кількістю адсорбованого платиною газоподібного водню. Величина адсорбції водню пропорційна його тиску. При тиску 101,3 кПа ЕН2/2Н+ = Е0Н2/2Н+ + 0,059 lg[H+].
Ряд стандартних електродних потенціалів металів
Електрод |
Е0, B |
Li/Li+ |
–3,045 |
K/K+ |
–2,92 |
Ba/Ba2+ |
–2,92 |
Ca/Ca2+ |
–2,87 |
Na/Na+ |
–2,71 |
Mg/Mg2+ |
–2,36 |
Mn/Mn2+ |
–1,05 |
Zn/Zn2+ |
–0,76 |
Fe/Fe2+ |
–0,44 |
Co/Co2+ |
–0,28 |
Ni/Ni2+ |
–0,23 |
Sn/Sn2+ |
–0,136 |
Pb/Pb2+ |
–0,126 |
H2/2H+ |
0,00 |
Bi/Bi3+ |
+0,215 |
Cu/Cu2+ |
+0,34 |
2Hg/Hg22+ |
+0,788 |
Ag/Ag+ |
+0,80 |
Hg/Hg2+ |
+0,85 |
Pt/Pt2+ |
+1,188 |
Au/Au3+ |
+1,498 |
Au/Au+ |
+1,69 |
Розміщуючи метали в ряд за величиною їх нормальних електродних потенціалів, ми одержимо так званий ряд стандартних електродних потенціалів металів, який ще називають рядом напруги металів.
Ряд стандартних електродних потенціалів має не тільки велике теоретичне значення, але з його допомогою може бути розв’язано ряд практичних задач, а саме:
1. Метали, розташовані в ряді напруги до Гідрогену, відрізняються хімічною активністю, здатні легко окиснюватися, витісняють водень з кислот, в той час як метали, розташовані за Гідрогеном, стійкі до окиснення, водень з кислот не виділяють і хімічно менш активні.
2. Кожний попередній метал здатний витіснити з розчинів солей всі наступні метали з ряду стандартних електродних потенціалів.
3. При виготовленні гальванічного елементу з будь-яких двох металів можна розрахувати величину е.р.с. утвореного елементу. Для обчислення е.р.с. гальванічного елементу достатньо знати різницю стандартних потенціалів Е0 різних електродів.
