
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Закони електролізу (м.Фарадей)
- •2. Рівні кількості електрики виділяють при електролізі з різних хімічних сполук еквівалентні кількості речовин.
- •Масу речовини, що виділилася при електролізі, розраховують за формулою
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Ланцюгові реакції
Молекула
А:В
з ковалентним типом зв’язку між атомами
в активованому стані може розпадатися:
а) на іони: А:В
А+
+ :В–
; б) на атоми (чи вільні радикали): А:В
А
+ В
. В реакції (а) розрив зв’язку називається
гетеролітичним
або іонним, в реакції (б) – гомолітичним
або радикальним.
При гомолітичному розриві ковалентного зв’язку утворюються атоми або групи атомів (вільні радикали) з підвищеною реакційною здатністю, обумовленою наявністю неспарених електронів •. Ланцюгова реакція завжди починається гомолітичним розривом зв’язку в одній із реагуючих молекул. Для ланцюгових реакцій характерні три стадії:
стадія зародження ланцюга:
Cl2 + h Cl• + Cl•
cтадія розвитку ланцюга:
Рис.6. Схема
реакції
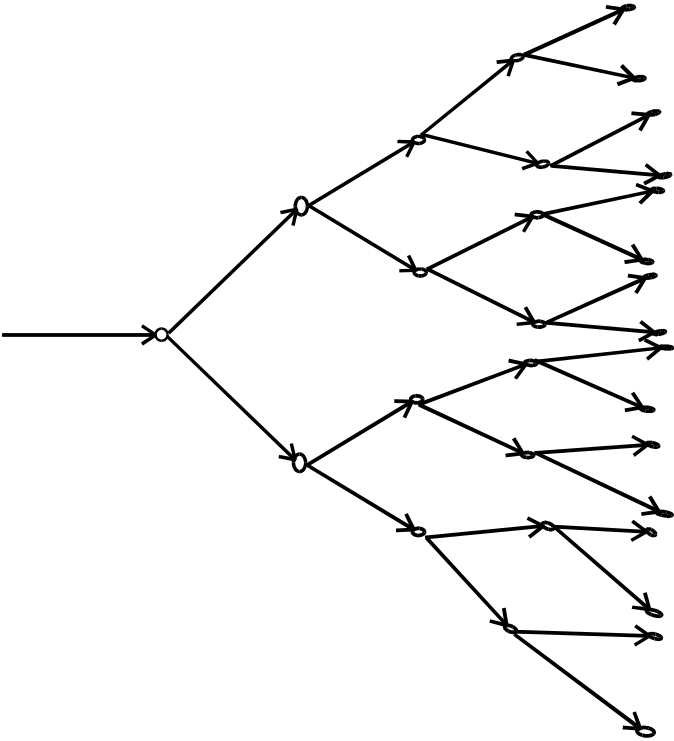
З розгалуженими ланцюгами
Cl• + Н2
Н Cl + Н•
Н• + Cl2 НCl + Cl• і т.д.
стадія обриву ланцюга (зіткнення двох атомів):
Н• + Н• Н2
Cl• + Cl• Cl2
Н• + Cl• НCl
Існують два типи ланцюгових реакцій: з нерозгалуженим і розгалуженим ланцюгами. При розгалуженні ланцюгові реакції проходять так, що кожна активна частка (атом або вільний радикал) породжує не одну, як в нерозгалуженому ланцюгу, а мінімум дві нові активні частки.. Схема розгалуженої ланцюгової реакції приведена на рис.6.
Оборотні та необоротні реакції
Хімічні
реакції можна розділити на необоротні
і оборотні. Необоротними
називають реакції, що проходять в одному
напрямку: з вихідних речовин утворюються
продукти реакції. Ознаками необоротності
є: виділення газу, випадання осаду,
утворення малодисоційованої речовини
і виділення великої кількості тепла.
Оборотними
називаються хімічні реакції, що проходять
в двох взаємно протилежних напрямках.
Їх особливість полягає в тому, що вони
не йдуть до кінця, в системі завжди
знаходяться як вихідні речовини, так і
продукти реакції:
![]()
Хімічна рівновага
Якщо в
системі швидкість прямої реакції (![]() пр.)
дорівнює швидкості оборотної реакції
(
пр.)
дорівнює швидкості оборотної реакції
(![]() об.),
то такий стан системи називають хімічною
рівновагою:
пр. =
об.
– конечна умова хімічної рівноваги;
Gp,T = 0
– термодинамічна умова хімічної
рівноваги.
об.),
то такий стан системи називають хімічною
рівновагою:
пр. =
об.
– конечна умова хімічної рівноваги;
Gp,T = 0
– термодинамічна умова хімічної
рівноваги.
Величина,
що дорівнює відношенню добутку рівноважних
концентрацій продуктів реакції до
добутку рівноважних концентрацій
вихідних речовин у степенях їх
стехіометричних коефіцієнтів, називається
константою
хімічної рівноваги
(КС).
КС = 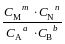 для реакції, рівняння якої має вигляд
аА+bB mM+nN.
Константа рівноваги залежить від природи
реагуючих речовин; час, необхідний для
досягнення рівноваги, залежить від
температури і концентрації вихідних
речовин.
для реакції, рівняння якої має вигляд
аА+bB mM+nN.
Константа рівноваги залежить від природи
реагуючих речовин; час, необхідний для
досягнення рівноваги, залежить від
температури і концентрації вихідних
речовин.
Концентрації
речовин у випадку реакції між газоподібними
речовинами можуть бути замінені
рівноважними тисками газів: Кр = 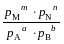 ;
;
Якщо оборотна реакція проходить в гетерогенній системі (FeO(кр.)+CO(газ) Fe(кр.)+CO2(газ)), то Кр рівна відношенню рівноважних парціальних тисків газоподібних речовин (CO2 і CO) і не залежить від кількості речовин, що знаходяться в кристалічній (твердій) фазі і Кр = рСО /рСО.
