
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Закони електролізу (м.Фарадей)
- •2. Рівні кількості електрики виділяють при електролізі з різних хімічних сполук еквівалентні кількості речовин.
- •Масу речовини, що виділилася при електролізі, розраховують за формулою
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Закони термохімії
Незалежність
теплоти хімічної реакції від шляху
процесу при р = const
і Т = const
була висловлена в першій половині ХІХ
століття Г.І.Гессом: Тепловий
ефект хімічної реакції не залежить від
шляху її протікання, а залежить тільки
від природи і фізичного стану вихідних
речовин і продуктів реакції.
Закон Гесса справедливий для процесів,
які протікають в ізобарно-ізотермічних
або ізохорно-ізотермічних умовах при
умові, що єдиним видом роботи є робота
проти сил зовнішнього тиску.
Розділ хімічної термодинаміки, що вивчає теплові ефекти реакцій, називається термохімією. Якщо теплота підводиться до системи (QТ 0), реакцію називають ендотермічною, якщо ж теплота виділяється в навколишнє середовище (QТ 0), реакцію називають екзотермічною.
Термохімічні рівняння реакцій
Рівняння
хімічних реакцій, в яких наведені їх
теплові ефекти і агрегатний стан речовин,
що приймають участь в реакціях, називаються
термохімічними
рівняннями.
В термохімії використовують дві форми
запису термохімічних рівнянь:
коли теплота реакції вказується в правій частині термохімічного рівняння, наприклад, С6Н6(р)+7
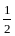 О2 = 6СО2+3Н2О(р)+3267,7 кДж;
тоді при Q 0
– екзотермічна реакція; при Q 0
– ендотермічна реакція;
О2 = 6СО2+3Н2О(р)+3267,7 кДж;
тоді при Q 0
– екзотермічна реакція; при Q 0
– ендотермічна реакція;коли тепловий ефект реакції записують у вигляді зміни ентальпії Н, наприклад, 2С6Н6(р)+15О2 = 12СО2+6Н2О(р) Н = –6535,4 кДж; тоді при Н 0 – реакція екзотермічна; при Н 0 – реакція ендотермічна.
Щоб тепловий ефект реакції був віднесений до кількості 1 моль однієї з вихідних речовин або продуктів реакції, в термохімічних рівняннях допускається використання дробових коефіцієнтів. Ентальпією (теплотою) утворення хімічної сполуки НТ називається зміна ентальпії в процесі одержання одного моля цієї сполуки з простих речовин, стійких при даній температурі.
Стандартний стан речовини
Стандартним
станом газоподібної речовини
при даній температурі є стан газу, тиск
якого рівний 101 кПа, при умові, що газ
має властивості, характерні для нього
при тій же температурі і нескінчено
малому тиску.
Стандартним станом розчиненої речовини при даній температурі буде його стан, що відповідає концентрації 1 моль/л, при умові, що розчин має властивості, якими він володів би при тій же температурі і нескінчено великому розведенні.
Стандартною ентальпією (теплотою) утворення хімічної сполуки називають зміну ентальпії в процесі утворення одного моля цієї сполуки з простих речовин, що знаходяться в стандартних станах і термодинамічно стійкі при даній температурі. Стандартні ентальпії утворення простих речовин приймають рівними нулю.
Термохімічні розрахунки
В основі
більшості термохімічних розрахунків
лежить наслідок із закону Гесса –
тепловий
ефект хімічної реакції дорівнює сумі
теплот (ентальпій) утворення продуктів
реакції мінус сума теплот (ентальпій)
утворення вихідних речовин.
При проведенні розрахунків необхідно
враховувати стехіометричні коефіцієнти
в рівняннях реакцій. Так, для реакції
aА+bB = cC+dD Н = (cНутв.(С)
+dНутв.(D))–(аНутв.(А)+bНутв.(В))
