
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Закони електролізу (м.Фарадей)
- •2. Рівні кількості електрики виділяють при електролізі з різних хімічних сполук еквівалентні кількості речовин.
- •Масу речовини, що виділилася при електролізі, розраховують за формулою
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Еквівалент окисника і відновника
Одна і та сама речовина у різних
реакціях може приєднувати або віддавати
різну кількість електронів. Так, в
залежності від середовища KMnO4
приймає 5 (кисле), 3 (нейтральне) або 1
(лужне) електрон. Отже, еквівалент KMnO4
у різних реакціях буде різним.
Еквівалентом окисника (відновника) називається така його кількість, яка при відновленні (окисненні) приєднує (віддає) 1 моль електронів. Так, у кислому середовищі Е(KMnO4) = 1/5 моль, у нейтральному Е(KMnO4) = 1/3 моль, у лужному Е(KMnO4) = 1 моль
Еквівалентна маса окисника (відновника) Еm дорівнює його молярній масі M, поділеній на число електронів z, приєднаних (відданих) у процесі реакції: Еm = M/z (г/моль). Так, у кислому середовищі для реакції MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O еквівалентна маса KMnO4 складає Еm = 158,0/5 = 31,6 г/моль.
Електродний потенціал
Металевий стан умовно можна позначити
як М+е–, де М+ – іон
металу, е–– вільний електрон.
При зануренні металевої пластини у воду
іони, що знаходяться в поверхневому
шарі металу, під дією полярних молекул
води гідратуються. Як наслідок, їх
зв’язок з іншими іонами послаблюється
і певна кількість іонів металу переходить
в розчин. Відповідно, пластинка металу
набуває негативного заряду.
Рис.9. Утворення
подвійного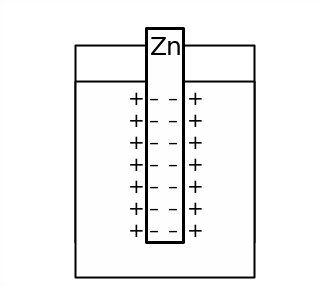
Електричного шару
Між
позитивно зарядженими іонами металу,
що перейшли у розчин, та негативно
зарядженою пластинкою виникає
електростатичне притягання, що заважає
подальшому протіканню процесу, і в
системі встановлюється рівновага. На
межі дотику металу з розчином утворюється
подвійний
електричний шар
і виникає стрибок потенціалу. Цей
потенціал, який виник на межі дотику
металу з рідиною, називають електродним
потенціалом.
Різні метали проявляють не однакову
здатність до переміщення іонів металу
в розчин. Тому кожному металу відповідає
своя рівноважна різниця потенціалів.
Явище переміщення іонів металу у розчин
спостерігається і при зануренні металевої
пластинки у розчин солі цього металу.
Товщина подвійного електричного шару залежить від природи металу, заряду іонів та температури. Подвійний електричний шар характеризується складною будовою. Біля поверхні металу спостерігається висока концентрація іонів із знаком заряду, протилежним заряду його поверхні. Вона зменшується по мірі віддалення від поверхні метала.
Гальванічний елемент
Пристрій,
в якому у хімічна енергія перетворюється
в електричну, називається гальванічним
елементом.
Гальванічний елемент складається з
одного, двох або декількох розчинів
електролітів, в які занурені металеві
пластинки (електроди), сполучені між
собою зовнішнім провідником. Прикладом
такого гальванічного елементу є
мідно-цинковий елемент Якобі-Данієля,
який складається з мідного та цинкового
електродів, занурених відповідно в
розчини CuSO4
та ZnSO4.
Схематично елемент Якобі зображають
таким чином: (+) Cu | CuSO4
|| ZnSO4
| Zn (–),
Рис. 10. Елемент
Якобі-Данієля
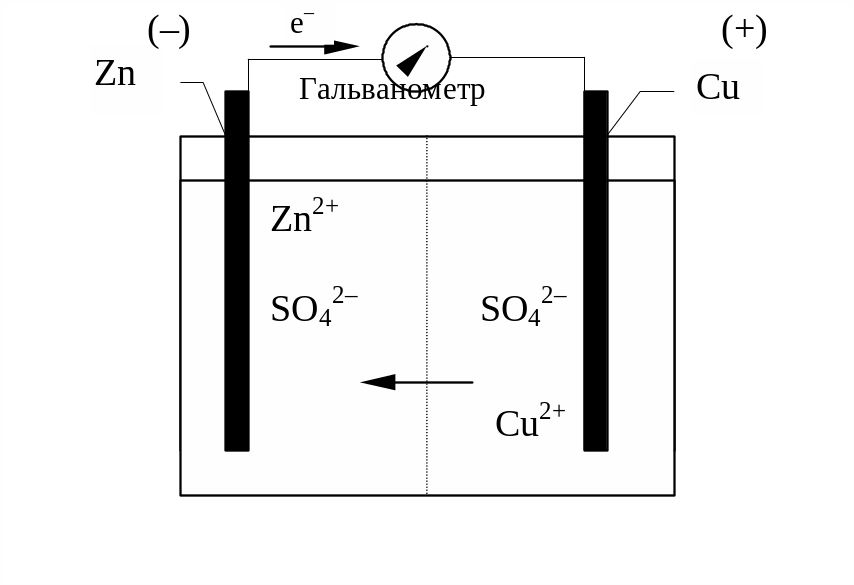
Пояснення виникнення е.р.с. в ланцюгу метал | розчин || розчин | метал дає теорія гальванічного елементу. Залежно від природи металів, занурених у електроліт, від концентрації та температури електроліту в гальванічному елементі виникає електрорушійна сила (е.р.с.).. Так, для елемента Якобі-Данієля
(+) Cu | CuSO4 || ZnSO4 | Zn (–)
Е1 Е3 Е2
буде спостерігатись три стрибки потенціалу: два з них (Е1 та Е2) будуть стрибками потенціалу на межі розділу фаз метал-розчин, і один (Е3) – на межі розділу двох рідких фаз.
Найбільша різниця потенціалів спостерігається на межі метал-розчин. Практично е.р.с. (Е) елементу Якобі-Данієля буде дорівнювати різниці стрибків потенціалу Е1 та Е2, оскільки стрибок потенціалу на межі двох рідин в даному випадку незначний:
Е = Е1 – Е2 = ЕCu/Cu2+ – ЕZn/Zn2+
В елементі Якобі-Данієля пластинки (цинкова і мідна) занурені в розчини своїх солей; розчини розділені діафрагмою. Кожен метал виділяє в розчин певну кількість іонів, яка відповідає рівноважному стану метал–розчин. Потенціали цих металів у рівноважному стані не однакові. Якщо сполучити пластинки провідником, то надлишок електронів по зовнішньому провіднику з цинкової пластинки переміститься на мідну. Це призводить до порушення рівноваги подвійного електричного шару. Для її відновлення в розчин буде переходити певна кількість іонів цинку, тобто цинк почне активно розчинятись; частина іонів міді з розчину буде осаджуватись на мідній пластинці.. Цей односторонній рух електронів по провіднику і є електричним струмом, який можна виявити за допомогою відповідних приладів. Різниця потенціалів між електродами за умов протікання нескінченно малого струму по зовнішньому колу називається електрорушійною силою (е.р.с.) елемента.
Таким чином, в основі роботи гальванічного елементу лежить окисно-відновна реакція, яка характеризується тим, що на одному з електродів (з нижчим електродним потенціалом) проходить окиснення, а на другому (з вищим електродним потенціалом) – відновлення.
Гальванічні елементи застосовують як автономні джерела електроенергії. Найпоширенішими серед них є “сухі” манган-цинкові елементи, що складаються з цинкового анода і (графіт-MnO2) катода; електролітом є паста з NH4Cl. На катоді (К) і аноді (А) протікають реакції
К: 4MnO2 +4H+ + 4е- → 4MnO(OH)
А: 2Zn - 2е- → 2Zn2+ , а електроліт взаємодіє з іонами Zn2+
Процес розрядки манган-цинкового елементу відображає рівняння:
4MnO2 + 2Zn + 4 NH4Cl → [Zn(NH3)4]Cl2 + 4MnO(OH)
Акумулятори
K: PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O
A: Pb + H2SO4 – 2e- → PbSO4 + 2H+
Процеси розрядки та зарядки свинцевого акумулятора відображає рівняння:
![]()
