
- •2. Освобождение его от нерастворимых примесей и стандартизация,
- •3. Фасовка в аэрозольные баллоны,
- •4. Герметизация,
- •5. Заполнение баллонов пропеллентом,
- •Вопрос 2. Препараты являются производными амида сульфаниловой кислоты.
- •Вопрос 4. Рецепт должен быть выписан на бланке ф.№107/у. Заверенным личной печатью и подписью врача. Проверка доз:
- •Вопрос 1. Приемку лек. Сырья производят партиями.
- •Вопрос 2. На рисунке представлена формула рутина.
- •Вопрос 3. Настойки сложные
- •Вопрос 4. Рецепт выписан правильно.
- •Вопрос 1. На рисунке представлена формула атропина сульфата. —Atropine Sulfate —атропина сульфат
- •Вопрос 2. Folia Hyoscyami (Folia Hyoscyami nigri) — листья белены (Hyoscyami folia —
- •Вопрос 4. Рецепт выписан не правильно. На рецепте должна быть печать лечебно-профилактического учреждения "Для рецептов"
- •Вопрос 2. Технология таблеток.
- •Вопрос 4. Рецепт выписан правильно. Нео для гамк не регламентированы.
- •Вопрос 1. Свойства лекарственных веществ группы пурина
- •Вопрос 2. Измельчение порошков приводит к увеличению биодоступности.
- •Вопрос 3. Radices Taraxaci — корни одуванчика
- •Вопрос 2.
- •Вопрос 2.
- •Вопрос 3.
- •Вопрос 2. Rp.: Sodium Chloride 0?9
- •Вопрос 4. Требование выписано не верно. Не указано назначение лек. Форы (для инфузий). На требовании нет круглой печати лпу. Требование выписывается в 3 экз.
- •Вопрос 4. Порядок назначения лекарственных средств
- •1.2. Лекарственные средства могут быть назначены специалистом со средним медицинским образованием (зубным врачом, фельдшером, акушеркой) в соответствии со статьей 54 Основ законодательства
- •Вопрос 3. Herba Convallariae — трава ландыша (Convallariae herba — ландыша трава)
- •Вопрос 4. Рецепт выписан не правильно. Должен быть выписан на бланке №148-1у-88, заверенным личной печатью и подписью врача, печатью лпу»Для рецептов»
- •Вопрос 3.
- •Вопрос 4. Рецепт выписан не правильно. Должен быть выписан на бланке №148-1у-88, заверенным личной печатью и подписью врача, печатью лпу»Для рецептов»
- •Вопрос 3.
- •Вопрос 2. Качество глазных капель, изготовляемых в аптеке регламентированы приказом №214, изготовляемых в промыш. Уел - правила gmp.
- •Вопрос 3. Folia Salviae (Folia Salviae qfflcinalis) — листья шалфея {Salviae folium (Salviae qfficinalis folium) — шалфея лист)
- •Вопрос 4. Рецепт выписан верно. Срок действия рецепта - 2 мес. Рецепт отдается
- •Вопрос 2. Bismuthi subnitras — висмута нитрат основной
- •Вопрос 3. Rhizomata Calami (Rhizomata Acori calami) — корневища аира, ирный
- •Вопрос 4. Рецепт выписан верно, веществ списков а. Б, пккн нет, дозы не проверяем. Нео не регламентированы.
- •Вопрос 2. Rp.: Resorcini 1,5
- •Вопрос 3. Folia Uvae ursi (Folia Arctoslaphyli uvae ursi) — листья толокнянки
- •Вопрос 4. Рецепт выписан верно. Нео не регламентированы. Лек. Форму хранят в прох. Защищ. От света месте при т не выше 25с. Оплата наличными через ккм.
- •Вопрос 2. Таблетки гмта получают прямым прессованием.
- •Вопрос 3. Radices Althaeae корни алтея (Althaeae radix — алтея корень)
- •Вопрос 4. Рецепт выписан не верно. Рецепт должен быть выписан на бланке ф.№107/у, заверенный личной печатью и подписью врача. Нео не регламентированы. Нео установлены пр.№328.
- •Вопрос 2. Получение воды для инъекций в промышленных условиях.
- •Вопрос 3. Cortex Frangulae (Cortex Frangulae aini) — кора крушины {Frangulae cortex — рутины кора)
- •Вопрос 4. Рецепт выписан не верно. Рецепт д.Б. Выписан на бланке ф. №148-1у-88, заверенный личной печатью и подписью врача, печатью лпу»Для рецептов»
- •Вопрос 2. ) —-3. Вспомогательные вещества.
- •Вопрос 3. Fructus Rosae — плоды шиповника (Rosae fructus — шиповника плод)
- •Вопрос 2. Пролонгаторы.
- •Вопрос 3.
- •Вопрос 3. Fructus Sorbi (Fructus Sorbi aucupariae) - плоды рябины (Sorbi fructus — рябины плод)
- •Вопрос 2. При изготовлении лекарственных форм из порошкового материала, помимо смешения и прессования, проводятся операции измельчения, грануляции и таблетирования.
- •2. Подготовительные мероприятия.
- •Вопрос 3. (Flores Stoechados citrinae) — цветки бессмертника песчаного {Helichrysi
- •Вопрос 2.
- •Вопрос 2. Acidum sulfocam-phoratum — кислота сульфокамфорная
- •Вопрос 2. Настойка перца стручкового (Tinetura Capsici). Настойка (1:10) на 90% спирте.
- •Вопрос 3. Fructus Capsici - плоды стручкового перца (Capsici fructus — стручкового перца плод)
- •1.2. Гидрогенизированные жиры
- •1.3. Растительные жиры (масла)
- •Вопрос 2. Требования, предъявляемые к инъекционным лекарственным формам.
- •Вопрос 4. Рецепт выписан не верно. Рецепт должен быть выписан на бланке ф. №107/у, заверенный личной печатью и подписью врача.
- •Вопрос 3.
- •Вопрос 4. Рецепт выписан верно. Дигитоксин - Список а. В условиях аптеки хранят в металлическом, запирающемся на ключ шкафу в прохладном месте.
- •Вопрос 2. Fructus Ammi majoris — плоды амми большой (Ammi majoris fructus — аммибольшой плод)
- •Глава XI. Информация о лекарственных средствах. Реклама лекарственных средств
- •Вопрос 2. Carbutamide — карбутамид (Букарбан)
- •Вопрос 3. Rhizomata et radices Inulae (Rhizomata et radices Inulae
- •Вопрос 2. Radices Glycyrrhizae (Radices Liquiritiae) — корни солодки (лакричный корень) (Glycyrrhizae radix (Liquiritiae radix) — солодки корень)
- •Вопрос 4. Рецепт выписан не верно. Рецепт должен быть выписан на бланке ф.№107/у, заверенным личной печатью и подписью врача.
- •Вопрос 4. Рецепт выписан не верно. Рецепт должен быть выписан на бланке ф.№г07/у, заверенным личной печатью и подписью врача.
- •Вопрос 3. Механизм извлечения действующих веществ.
- •Вопрос 2.
- •Вопрос 3.
- •Вопрос 4. Рецепт выписан верно.
- •Вопрос 2. Соки растений (Succi plantarum)
- •Вопрос 3.
- •Вопрос 4. Рецепт выписан верно. Нео не регламентированы, нео регламентируются Приказом мз рф №785 от 14.12.05 «о порядке отпуска лс».
- •Вопрос 2. Экстракты (от лат. Extractum — вытяжка, извлекать, вытягивать) — это :онцентрированные вытяжки из лекарственного растительного сырья, известны за несколько ъюячелетий до нашей эры.
- •Вопрос 4. Рецепт выписан верно.
- •Вопрос 3. Metamizole Sodium — метамизол-натрий (Анальгин)
- •Вопрос 2. Folia Sennae (Folia Cassiae) — листья сенны (кассии) (Sennae folium -сениы лист) Fructus Sennae — плоды сены (кассии) (Sennae fructus — сены плод)
- •Вопрос 3.
- •Вопрос 2.
- •Вопрос 3. Машины для измельчения твердых тел
- •1. Конвективные (воздушные)
- •Вопрос 2. Fructus Hippophaes rhamnoidis recentes — плоды облепихи крушиновидной свежие
- •Вопрос 3. Масляные экстракты. Масляные экстракты (медицинские масла) — это извлечения из лекарственного растительного сырья, приготовленные с использованием растительных или минеральных масел.
- •Вопрос 2.
Вопрос 2. Bismuthi subnitras — висмута нитрат основной
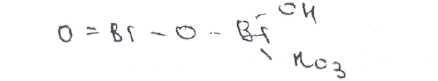
Белый аморфный порошок
Висмута нитрат основной растворим в кислотах (азотной, хлороводородной). При этом происходит процесс, обратный получению его из средней соли: о~-&-с и H^nu^ 2Bi(NO3),+ 3H2O
Подлинность висмута нитрата основного устанавливают прокаливанием, которое чриводит к разложению с образованием желто-бурых паров (диоксид азота) и желтого остатка (оксид висмута):
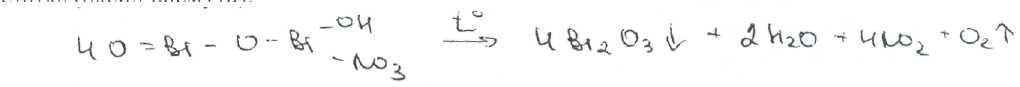
При добавлении сульфида натрия к раствору висмута нитрата основного в минеральной кислоте выпадает коричнево-черный осадок (сульфид висмута):
2Bi(NO3)3 + 3Na2S -> Bi2S3i + 6NaNO3
Если взболтать около 0,1 г висмута нитрата основного с разведенной серной кислотой, а затем профильтровать, то после добавления к фильтрату 2 капель раствора иодида калия образуется черный осадок иодида висмута, растворимый в избытке реактива с образованием желто-оранжевого раствора комплексной соли:
Bi2(SO4)3 + 6KI -> 2Bil3^ 3K2SO4
Bil3 + Kl -> KBil4
Висмута нитрат основной в соответствии с требованиями ФС проверяют на кислотность водного извлечения (после 30 мин взбалтывания и 6-ти часового настаивания 5 г лекарственного вещества с 75 мл воды) Проверяют потерю в массе при высушивании (не более 3%). микробиологическую чистоту (ГФ XL вып. 2, с. 193). Устанавливают также предельное содержание солей щелочных и щелочноземельных металлов (не более 0.5%), карбонатов, сульфатов, хлоридов, солей аммония, меди, серебра, свинца, мышьяка и теллура.
Количественное определение выполняют комплексонометрическим методом. Навеску, растворенную в нагретой азотной кислоте, титруют 0,05 М раствором трилона Б (ЭДТА Na2) в присутствии индикатора ксиленолового оранжевого или пирокатехинового фиолетового. В процессе титрования титрант связывает ионы висмута, образовавшиеся, при растворении лекарственного вещества в азотной кислоте, в комплексное соединение:
Выделяющаяся азотная кислота не мешает титрованию, так как соли висмута количественно взаимодействуют с ЭДТА Na2 при рН 2-4. Вот почему в данном случае не требуется добавления буферного раствора.
Окрашенное комплексное соединение пирокатехинового фиолетового с ионом висмута имеет меньшую константу устойчивости. чем Bi3+ с динатриевой солью этилендиаминтетрауксусной кислоты. Поэтому при титровании ЭДТАЫа2 отбирает ион висмута у индикатора и связывает его в более прочный комплекс, не имеющий окраски. В эквивалентной точке выделяется свободный индикатор, который придает раствору желтую окраску:
Учитывая непостоянство состава висмута нитрата основного, расчет содержания проводят по оксиду висмз'та, которого должно быть 79-82%.
Хранят висмута нитрат основной в хорошо укупоренной таре, предохраняющей от действия света. При доступе влаги и света он постепенно гидролизуется с образованием азотной кислоты и оксидов азота.
Висмута нитрат основной применяют как вяжущее и отчасти антисептическое средство при желудочно-кишечных заболеваниях (по 0,25-4),5 г).
Magnesium Oxyde (Magnesii oxydum) —
магния окись, магния оксид
MgO
Белый мелкий легкий порошок без запаха
Испытания на подлинность магния оксида проводят после предварительного растворения в разведенных кислотах:
MgO + 2HCI -> MgCl2 + Н2О
Для обнаружения иона магния используют общую реакцию образования нерастворимого в воде, но растворимого в уксусной кислоте белого кристаллического осадка фосфата магния-аммония. Осадок выпадает при добавлении к раствору соли мггния гидрофосфата динатрия и раствора аммиака:
NH4CI
МдС12 + Na2HPO4 + NH3* Н2О===- NH4MgP04i+ 2NaCI + Н2О
NH4MgPO4 + 2СН3СООН -> Mg(CH3COO)2 + NH4H2PO4
К реакционной смеси необходимо прибавлять раствор хлорида аммония (до рН 9) во избежание образования в щелочной среде аморфного осадка гидроксида магния Mg(OH)2 (при рН > 10). Однако большой избыток хлорида аммония может препятствовать осаждению фосфата магния-аммония.
Ион магния в магния оксиде обнаруживают, осаждая его из растворов в хлороводородной кислоте избытком гидроксида натрия. Образующийся гидроксид магния представляет собой белый студенистый осадок, нерастворимый в избытке раствора гидроксида натрия. Если затем добавить несколько капель иода, то осадок приобретает темно-коричневую окраску.
В магния сульфате устанавливают наличие сульфат-иона:
MgSO4 + ВаСЬ -> BaSO4l + MgCI2Соединения магния количественно определяют прямым комплексонометрически л методом с использованием индикатора кислотного хром черного специального (эриохром черный Т). После добавления индикатора к титруемому раствору ионы магния образуют с ним непрочное комплексное соединение:
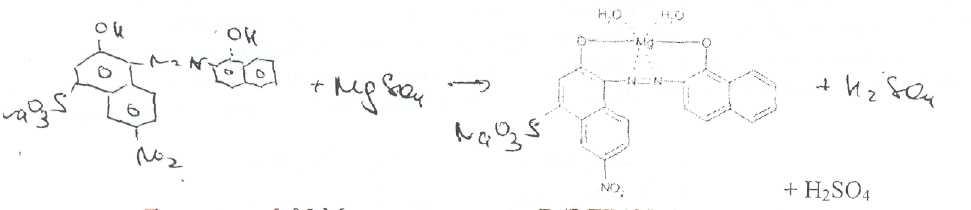

Поскольку при этом происходит выделение серной кислоты, для поддержания оптимального значения рН среды необходимо прибавлять аммиачный буферный раствор.
В эквивалентной точке, когда все ионы магния будут связаны в комплексное соединение металл — ЭДТА Na?. титрант вступает во взаимодействие с ионами магния, содержащимися в составе комплекса металл — индикатор. Последний имеет меньшую константу устойчивости, чем комплексное соединение ЭДТА Na2 — металл, поэтому происходит разрушение комплекса индикатора с ионами магния. При этом красно-фиолетовая очраска раствора переходит J3 синюю окраску свободного индикатора:
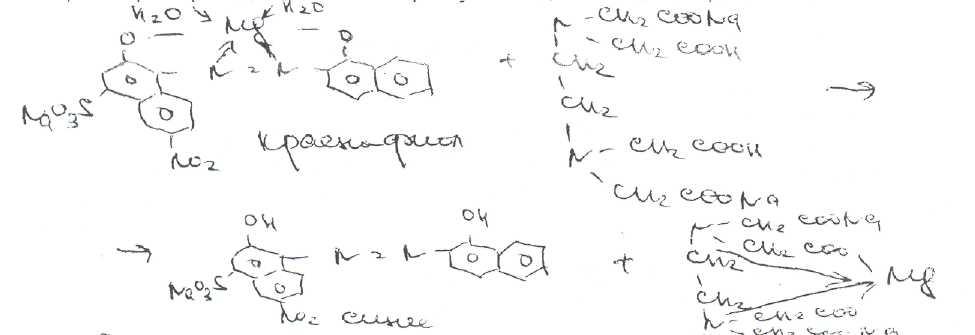
Соединения магния хранят в хорошо укупоренной таре, так"' как магния оксад взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примес! карбоната и гидроксида магния:
MgO + СО2 -> MgCO3
MgO + H2O -> Mg(OH)2
В
качестве общего реактива на ион висмута
и магния могут быть использованы дитизон
v.
8-оксихинолин,
образующие внутрикомплексные соединения
оранжево-красного цвет^ Указанные
реактивы используют для фотометрического
определения висмута и магния.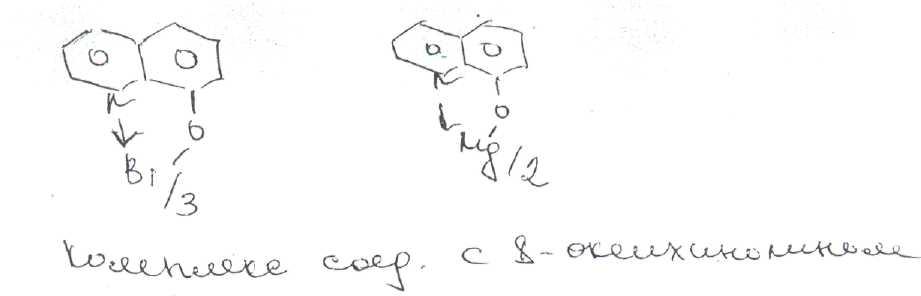
В данной лек. форме сумму висмута и магния определяют комплексонометрически (прямое титрование).
Объем ЭДТА, пошедший на титрование оксида меди определяют по разности:(УЭДТА, пошедший на титрование суммы - V бромата калия/2. _)
Броматометрическое определение висмута, основанное на реакции окисления металлической меди в солянокислом растворе (заместительное титрование):
BiCl4" + 3Cu + 2СГ = ЗСиСЬ" + Bi
Полученный раствор меди (Т) титруют броматом калия в присутствии метилового оранжевого. В точке эквивалентности индикатор разрушается и раствор приобретает голубую окраску, вызванную ионами Си +.
Э=М висмута нитрата основного/2
