
Шевченко Ю.Л. - Актуальные вопросы грудной хирургии
.pdf
72 *
ком летальности (3–7%) и развития интраоперационного ИМ (3– 12%), а также риском повреждения функционирующих шунтов. Поэтому пациенты с рецидивом стенокардии в первую очередь рассматриваются как кандидаты на коронарную ангиопластику.
Эндоваскулярная коррекция кровоснабжения миокарда была выполнена 78 больным с РС после АКШ (табл. 2).
Все пациенты – мужчины, средний возраст составлял 57,3 года, средний временной промежуток после АКШ – 5,3 года, ИМ в анамнезе имели все больные. Эндоваскулярные операции на нешунтированных ВА выполнены в 64% случаев, на шунтах – в 36% случаев, 12 (15%) пациентам выполнена реканализация, баллонная ангиопластика и стентирование полностью окклюзированных аутовенозных шунтов. У 2 (3%) больных, вследствие окклюзии боковой ветви, в раннем послеоперационном периоде развился не-Q ИМ, без существенных нарушений гемодинамики. Полное купирование синдрома стенокардии достигнуто у 31% пациентов, снижение ФК стенокардии достигнуто у 62% больных, у 7% больных клинический эффект не был достигнут (рис. 3).
Таким образом, возможности современных эндоваскулярных технологий в лечении тяжелых форм ИБС неоспоримы. Внедрение в клиническую практику новых стентов (особенно с лекарственным
Таблица 2. Клинико-ангиографическая характеристика больных с РС, подвергнутых эндоваскулярным вмешательствам
|
|
|
|
|
|
|
Всего пациентов |
|
|
78 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Средний возраст, годы |
|
|
57,3 |
|
|
|
|
|
|
|
|
Мужчин/женщин |
|
75 (96%)/3 (4%) |
|
|
|
|
|
|
|
|
|
Стенокардия II ф.к. |
|
24 |
(31%) |
|
|
|
|
|
|
|
|
Стенокардия III–IV ф.к. |
|
39 |
(50%) |
|
|
|
|
|
|
|
|
Нестабильная стенокардия |
|
14 |
(18%) |
|
|
|
|
|
||
|
ИМ в анамнезе |
|
78 (100%) |
|
|
|
|
|
|
|
|
|
ИМ после АКШ |
|
31 |
(40%) |
|
|
|
|
|
|
|
|
ФВ<40% |
|
18 |
(23%) |
|
|
|
|
|
|
|
|
Сахарный диабет |
|
7 |
(9%) |
|
|
|
|
|
|
|
|
Гиперхолестеринемия |
|
62 |
(80%) |
|
|
|
|
|
|
|
|
Число пораженных участков |
|
|
134 |
|
|
|
|
|
|
|
|
|
|
|
||
|
Операционный успех |
|
70 (90%) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* 73
а |
|
б |
|
|
|
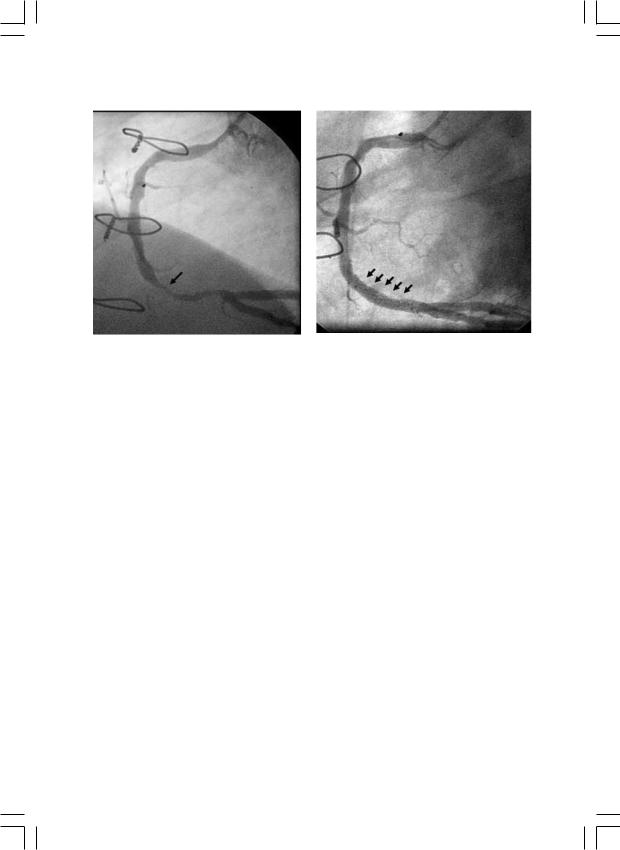
Рис. 3. Баллонная дилатация стенозированного аутовенозного шунта (а – до и б – после ангиопластики).
покрытием) и других инструментов существенно улучшило непосредственные и отдаленные результаты лечения больных ИБС, а также позволило значительно расширить спектр показаний к выполнению эндоваскулярных операций на сердце.
Литература
1.Акчурин Р.С., Аганов А.А., Власова Э.Е. и др. Аутовенозное шунтирование: риск ранних и годичных окклюзий шунтов при дислипидемии. // Грудная и серд.-сосуд. хир., 1996, № 1, с. 31-33.
2.Алекян Б.Г., Бузиашвили Ю.И., Власов Г.П. и др. Транслюминальная баллонная ангиопластика у больных с возвратом стенокардии после операции аортокоронарного шунтирования.// Грудная и серд.-сосуд. хир., 1996, № 6, с. 233.
3.Puma J.A., et al. The natural history of single-vessel chronic coronary occlusion: a 25-year experience.// Am Heart J. 1997, #133(4), pp. 393-399.
4.Rubartelli P., Niccoli L., et al. Stent implantation versus balloon angioplasty in chronic coronary occlusions: results from the GISSOC trail.// J Am Coll Cardiol., 1998, #32, pp. 90-96.
5.Sirnes P.A., et al. Improvement in left ventricular ejection fraction and wall motion after successful recanalization of chronic coronary occlusions.// Eur Heart J., 1998,#19(2), pp. 273-281.

74 *
ИНТРАОПЕРАЦИОННАЯ ЧРЕСПИЩЕВОДНАЯ ЭХОКАРДИОГРАФИЯ ПРИ СИНДРОМЕ НИЗКОГО ВЫБРОСА ПОСЛЕ КОРРЕКЦИИ КЛАПАННЫХ ПОРОКОВ СЕРДЦА
Л.В. Волкова, Н.О. Травин
Особенностью кардиохирургических операций является наличие в большинстве случаев в начальном периоде выхода из искусственного кровообращения (ИК) признаков сердечной слабости. Низкий сердечный выброс (НСВ), требующий значительных доз кардиотоников или продолжения ИК, развивается у 10–15% пациентов с исходно удовлетворительной сократимостью миокарда и у 50% больных со сниженной сократимостью. В таких ситуациях необходимо в короткий срок оценить причины и выраженность НСВ и определить дальнейший план операции. Это может быть усиление инотропной терапии, повторное подключение или продолжение ИК, налаживание обхода левого или правого желудочка, повторная коррекция порока или вмешательство по поводу некорригированной патологии. НСВ на этапе выхода из ИК является независимым фактором риска послеоперационной летальности.
Среди возможных причин НСВ можно выделить:
•нарушение локальной и глобальной сократимости миокарда, связанное с длительностью операции, исходной тяжестью порока;
•ишемию вследствие:
-неэффективной или неадекватно проведенной защиты миокарда, неадекватной перфузии;
-повреждения коронарных артерий (пересечение или захват в шов коронарной артерии, прошивание устья коронарной артерии),
-хирургического повреждения миокарда (разрывы, гематомы);
-материальной или воздушной эмболии;
•некорригированную патологию, проявляющую себя или усиливающую свою выраженность после ИК (стенозы коронарных артерий, клапанные пороки, невыявленные сопутствующие пороки);
•неадекватно выполненные клапаносберегающие вмешательства;
•острую дисфункцию клапанных протезов (неправильная имплантация, фистула, блокировка запирательного элемента, дефекты изготовления);

* 75
•гиповолемию, обусловленную продолжающимся кровотечением или невосполненной объемной нагрузкой при выходе из ИК.
Дифференциальная диагностика этих состояний и, соответственно, их целенаправленная коррекция – сложны.
Цель исследования: оценить возможности интраоперационной чреспищеводной (ИО ЧП) ЭхоКГ в определении тактики лечения больных с НСВ непосредственно после коррекции клапанных пороков сердца.
Материалы и методы: ИО ЧП ЭхоКГ рутинно применяется нами с сентября 2002 г., в основном при операциях, связанных с коррекцией клапанных пороков сердца. Выполнено 166 ИО ЧП ЭхоКГ: 89 – при протезировании или пластике клапанов в условиях ИК, 57 – при закрытой митральной комиссуротомии, 15 – при резекции постинфарктной аневризмы левого желудочка, 4 – при пластике дефекта межпредсердной перегородки, 1 – при эхинококкэктомии (в последнем случае – в сочетании с эпикардиальной ЭхоКГ). Использовали аппарат Toshiba Power Vision 6000 с ЧП датчиком 5 МГц. Исследование проводили в одномерном, двухмерном, импульсном и цветовом допплеровском режимах.
Результаты. В 5 случаях НСВ был обусловлен острой митральной регургитацией после закрытой митральной комиссуротомии, в 2 – после шовной аннулопластики митрального клапана. В 1 случае была выявлена парапротезная фистула, что позволило своевременно ее ликвидировать. В 4 случаях имело место нарушение глобальной сократимости миокарда, обусловленное дефектами проведения кардиоплегии, еще в 2 случаях – воздушной эмболией в систему правой коронарной артерии. В 2 случаях причиной острой регургитации через митральный протез служило блокирование запирательного элемента дренажем левого желудочка. В 1 случае причиной НСВ было попадание в шов аорты устья правой коронарной артерии.
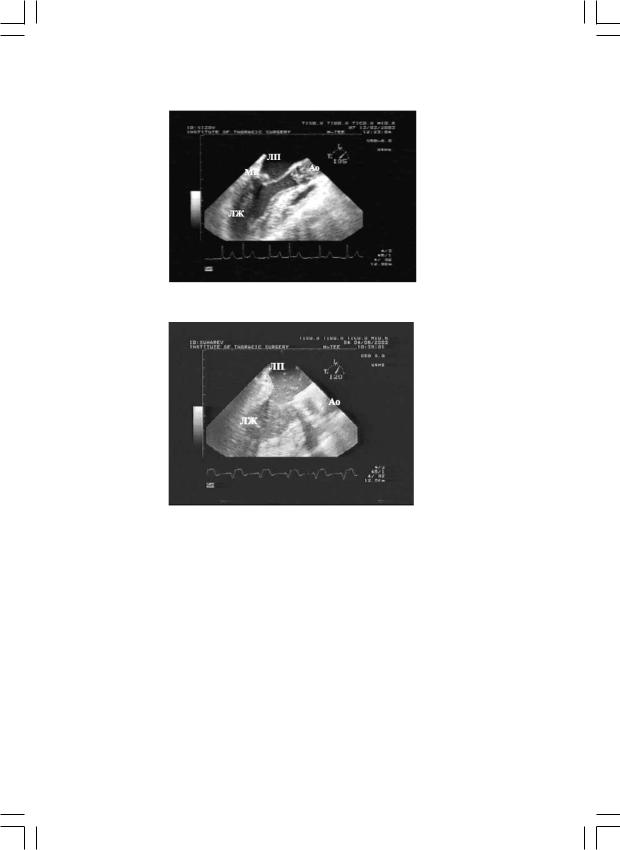
Помимо оценки функции протезов и эффективности пластических вмешательств на клапанах, ИО ЧП ЭхоКГ использовали для контроля эффективности проведения кардиоплегии (рис. 1) и для контроля за удалением воздуха из полостей сердца (рис. 2).
В случаях повторного включения аппарата ИК, ИО ЧП ЭхоКГ позволяла контролировать процесс стабилизации гемодинамики и корректировать нагрузку объемом с учетом сократимости миокарда и размеров камер сердца.
Обсуждение. По сути ИО ЧП ЭхоКГ – единственный неинвазивный метод, позволяющий исключить дисфункцию протеза. Также
76 *
Рис. 1. Контроль эффективности проведения кардиоплегии.
Рис. 2. Контроль за удалением воздуха из полостей сердца.
важным моментом является то, что данные о состоянии внутрисердечной гемодинамики, полученные непосредственно после коррекции порока, являются точкой отсчета для дальнейшего динамического наблюдения. При проведении исследования необходимо учитывать то, что невозможно (или крайне сложно) определить причину НСВ без: учета исходного состояния пациента (морфологические изменения клапанов, показатели центральной гемодинамики, состояние миокарда); учета характера выполненного вмешательства; сопоставления с другими объективными данными.
По своей значимости и очередности задачи ИО ЧП ЭхоКГ можно сформулировать следующим образом:
•исключение в первую очередь причин, связанных с хирургической коррекцией (эффективность и состоятельность клапа-

* 77
носохраняющей операции, функция искусственных клапанных протезов и т.д.);
•адекватность объема вмешательства;
•адекватность мероприятий, направленных на профилактику воздушной эмболии;
•выраженность и гемодинамическая значимость некорригированных пороков, поражения миокарда и коронарных артерий;
•нарушения ритма и их влияние на гемодинамику;
•характер и выраженность миокардиальной слабости в сравнении с аналогичными показателями на этапе до начала ИК;
•объемная нагрузка на миокард на этапе до и после отключения АИК;
•гемодинамические показатели.
Вслучаях, когда причины НСВ связаны с хирургическими аспектами, вопрос о повторном вмешательстве и показания к реоперации ставятся уже на этом этапе.
К особенностям диагностики относится то, что в случаях миокардиальной слабости можно регистрировать появление регургитации на интактных клапанах сердца (см. рис. 3, цв. вклейка), как и усиление регургитации на клапанах с минимальными или умеренными изменениями до ИК, вмешательство на которых не производилось. Также может иметь место усиление транспртотезной регургитации на клапанных протезах. Очень важно в таких ситуациях адекватно оценить локализацию и выраженность регургитации.
Вслучаях применения протезов, ЭхоКГ выявляет отсутствие нарушений движения запирательного элемента протеза в В-режиме и М-режиме. В то же время, транспротезная регургитация, выявляемая при цветовом допплеровском исследовании, выглядит более выраженной, чем обычно, в связи с чем ее необходимо дифференцировать с парапротезной фистулой. В таких ситуациях по данным манометрии отмечается повышение давления как в левом желудочке, так и в левом предсердии. Соответственно, показатели скорости кровотока и градиент давления на протезе по данным ультразвукового исследования будут снижены. Также может отмечаться расширение размеров камер сердца. Усиление регургитации может быть связано с замедлением закрытия запирательного элемента и усилением потока за счет объема, находящегося под створкой. При выявлении регургитации после клапаносберегающих операций, а также при ее усилении на клапанах, на которых вмешательство не выполнялось, важно адекватно оценить выраженность регургитации и не делать поспешных заключений. Оценку регургитации желательно

78 *
проводить в динамике, сопоставляя данные ЭхоКГ и инвазивного мониторинга. Следует также оценить эффективность проводимой терапии.
Оценка в В-режиме регионарной и сегментарной сократимости миокарда позволяла выявить ее нарушения, которые оценивали в динамике на фоне проводимой перфузии и медикаментозной терапии.
Выводы. ИО ЧП ЭХОКГ является ценным самостоятельным диагностическим методом, позволяющим быстро проводить дифференциальную диагностику острых состояний, своевременно выявлять причину острой сердечной недостаточности и корректировать ее на основе показателей внутрисердечной гемодинамики.
Литература
1.Алехин М.Н., Седов В.П. Допплер-эхокардиография // М., 1997.
2.Иваницкий А.В., Константинова В.М., Косенко А.И., Горбачевский С.В. Оценка показателей гемодинамики у больных с ВПС и легочной гипертензией с помощью допплерэхокардиографии // М., 2001.
3.Соловьев Г.М., Попов Л.В., Игнатов Ю.В. Кардиохирургия в эхокардиографическом исследовании. – М., 1990.
4.Фейгенбаум Х. Эхокардиография // М., 1999.
5.Nanda N. et.al. Echocardiographic assessment of prosthetic valves.
//Circulation, 84 (3): 228, 1991.
6.Rafferty T.D. Basics of Transesophageal Echocardiography // New York, 1995.
КОРРЕКЦИЯ ГЕМОДИНАМИКИ ВО ВРЕМЯ ОБЩЕЙ АНЕСТЕЗИИ ПРИ ОПЕРАЦИЯХ С ИСКУССТВЕННЫМ КРОВООБРАЩЕНИЕМ
Ю.И. Гороховатский
Высокий уровень современной кардиоанестезиологии в значительной мере обусловлен более глубоким пониманием основных патофизиологических механизмов, приводящих к повреждению жизненно важных органов, и внедрением в практику новых методов мониторинга. Однако, как свидетельствуют данные литературы, у больных со сниженной функцией левого желудочка (ЛЖ) госпитальная летальность остается высокой. Опыт показывает, что у рас-

* 79
сматриваемой категории больных опасные нарушения кровообращения и газообмена во время хирургического вмешательства и в ближайший период после операции возникают чаще, чем у других пациентов, оперируемых по поводу приобретенных пороков сердца.
Природа и характер этих расстройств, а следовательно, и их профилактика и коррекция, судя по данным литературы, до сих пор не привлекли должного внимания исследователей. Показано, что частота развития послеоперационных осложнений при хирургическом лечении больных с застойной сердечной недостаточностью во многом определяется состоянием транспорта кислорода (ТО2) и общего потребления кислорода (ПО2) во время различных этапов операции. В отношении больных с приобретенными пороками сердца, в частности, в тактике поддержания у них адекватной производительности сердца в доперфузионный период операции, анестезиологи продолжают руководствоваться общими принципами, предусмотренными для пациентов без сердечной патологии. Между тем, есть основания считать, что такой подход не является оптимальным.
Так, существует общепринятое представление о влиянии общих анестетиков и мышечных релаксантов на состояние кислородного баланса организма. Считается, что в условиях общей анестезии снижается системное потребление кислорода. Наступающее при этом снижение ТО2 объясняют уменьшением производительности сердца вследствие снижения потребности клеток в кислороде.
С этой точки зрения наибольшее внимание привлекают данные, согласно которым снижение уровня лактата при низких значениях ПО2 и минутного объема кровообращения (МОК) свидетельствует о нормализации кислородного баланса в организме. Отсюда было сделано заключение, что во время операций на открытом сердце наиболее рациональным является гиподинамический тип кровообращения.
В отличие от этого, в других исследованиях снижение ТО2 связывают не с изменением потребности в кислороде, а с прямым кардиодепрессивным действием анестетиков. Наряду с этим имеется немало сообщений о возрастании выброса в кровь стресс-гормонов в период операции до искусственного кровообращения (ИК). Предполагается, что у больных со сниженной функцией ЛЖ высокое общее периферическое сопротивление (ОПС), обусловленное повышением выброса в кровь катехоламинов, вызывает понижение сердечного выброса.
Указанные обстоятельства определяют значительные трудности при выборе методов коррекции нарушений кровообращения у боль-

80 *
ных с приобретенными пороками сердца в доперфузионный период. Принятые в кардиоанестезиологии способы управления гемодинамикой, такие как увеличение преднагрузки и снижение ОПС не всегда позволяют оптимизировать МОК и кислородный баланс в условиях хронической недостаточности кровообращения. В клинической практике для обеспечения адекватного уровня ТО2 и сведения к минимуму патологических сдвигов, сопровождающих реакцию на операционнную травму, используют инотропные препараты. Так, по данным И.Г. Амзаевой, у больных с выраженной недостаточностью кровообращения и легочной гипертензией, в условиях фентанил-про- пофоловой анестезии использование допмина обеспечивало стабилизацию гемодинамики и нормализацию кислород-транспортной эффективности сердечно-сосудистой ситемы (ССС). Более того, в работе А.И. Иващенко показано успешное применение добутрекса у больных с ИБС.
Таким образом, использование симпатомиметиков абсолютно оправдано при резком снижении сердечного выброса и артериального давления. Спорной является необходимость управления насосной функцией сердца в тех случаях, когда ПО2 не снижается ниже критического уровня. Нет единого мнения и в отношении информативности различных способов оценки кислородтранспортной эффективности
ССС. Так, методика оценки системного баланса между обеспечением кислородом и его утилизацией подвергается критике относительно методологических аспектов, таких как математическое сопряжение, способное возникнуть между ТО2 и ПО2 в случае, если последнее вычисляется, исходя из сердечного выброса при помощи уравнения Фика. При интерпретации данных, полученных в результате исследования центральной гемодинамики и крови, необходимо учитывать, что они в значительной мере отражают истинное состояние кислородного баланса только при условии выявления у больного динамики показателей насосной функции сердца.
Одним из общепринятых путей оценки тканевой оксигенации является определение содержания лактата в смешанной венозной крови. Увеличение концентрации лактата крови у пациентов, находящихся в критическом состоянии, в основном, объясняется тканевой гипоксией. При интерпретации полученных данных необходимо учитывать, что увеличение концентрации лактата в значительной степени отражает тканевую гипоксию только при отсутствии признаков печеночной недостаточности. Кроме того, шунтирование потока крови на уровне микроциркуляции может приводить к временному снижению концентрации лактата в венозной крови, несмотря на регио-

* 81
нальную тканевую гипоксию. Если после ишемии следует восстановление адекватного кровообращения (реперфузия), то происходит вымывание молочной кислоты накопившейся в тканях за период гипоперфузии, и, как следствие, увеличение ее содержания в венозной крови. В этой связи некоторые исследователи склонны рассматривать увеличение концентрации лактата в крови после операций с ИК как следствие интраоперационной системной гипоперфузии. Еще одним, до конца не решенным, остается вопрос о влиянии системной артериальной гипотензии, возникающей в период операции до ИК, на частоту возникновения послеоперационных осложнений. Есть данные, свидетельствующие о благоприятном воздействии артериальной гипотензии на тканевой кровоток. Показано, что при использовании вазодилататоров и снижении АД до определенного уровня поток крови через ткани может увеличиваться. Однако нужно учитывать, что как только сердечный выброс начнет снижаться из-за уменьшения венозного возврата к сердцу, тканевая перфузия будет прогрессивно уменьшаться. При этом важнейшее значение приобретает тот факт, что во время анестезии происходят существенные изменения в механизмах регуляции сердечной деятельности и сосудистого тонуса. Показано, что под влиянием анестетиков и вазоактивных препаратов, используемых для коррекции АД, ауторегуляция мозгового кровотока существенно нарушается. То же самое верно и для других тканей. В результате кровоток по мозговым и коронарным сосудам становится всецело зависимым от системного АД. С другой стороны, в условиях вазоконстрикции, обусловленной высоким тонусом симпатикуса, тканевой кровоток будет снижен даже при нормальном уровне АД и высоком МОК. Следовательно, наряду с поддержанием достаточного ТО2, необходимо обеспечить адекватную периферическую перфузию (органную и капиллярную). Эти представления предусматривают особую роль стресс-реакции на операционную травму в генезе послеоперационной функциональной полиорганной недостаточности.
Действительно, накопленный к настоящему времени клинический опыт использования центральной аналгезии при операциях на сердце с ИК показал, что в больших дозах фентанил не предупреждает некоторые неблагоприятные проявления стресс-реакции на травму. В частности, во время стернотомии как одного из самых травматичных этапов операции и в период хирургических манипуляций на аорте могут сохраняться рефлекторные влияния, сопровождающиеся нарушениями общего и коронарного кровообращения. Это обусловлено тем, что наркотические аналгетики недостаточно
