
Шевченко Ю.Л. - Актуальные вопросы грудной хирургии
.pdf
92 *
ХИМИОПРОФИЛАКТИКА ЛЕВОФЛОКСАЦИНОМ ГНОЙНОВОСПАЛИТЕЛЬНЫХ ОСЛОЖНЕНИЙ ПОСЛЕ ОПЕРАЦИЙ АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ
Б.Г. Григорян
Хирургические гнойно-септические осложнения (ГСО) после операций реваскуляризации миокарда не только существенно задерживают выздоровление больных и сопровождаются значительным возрастанием стоимости стационарного лечения, но и несут непосредственную угрозу жизни пациента. Частота развития ГСО у кардиохирургических больных составляет от 2 до 50% [5]. Среди факторов, влияющих на развитие ГСО, указывают: преклонный возраст больного; сахарный диабет; табакокурение; длительный срок пребывания в стационаре до операции [10]. Кроме того, выявлена зависимость развития инфекции от сложности выполненной операции, длительности искусственного кровообращения (ИК), общей продолжительности оперативного вмешательства, продолжительности искусственной вентиляции легких (ИВЛ) и стационарного лечения [3]. Доказано существенное значение распространенных в стационаре множественноустойчивых возбудителей. В этой связи важная роль в предупреждении ГСО наряду с усовершенствованием мер асептики и антисептики принадлежит рациональной антибактериальной терапии [2]. Одним из общепринятых путей уменьшения вероятности инфицирования послеоперационной раны является метод антибиотикопрофилактики. Целый ряд данных свидетельствует о том, что развитие гнойно-воспалительных процессов можно поставить в определенную связь с дозой и режимом введения антибиотика (а/б).
Общепризнано, что введение а/б перед операцией в начальный период анестезии является наиболее эффективным способом предотвращения контаминации и размножения микроорганизмов в ране [6]. С этой целью в кардиохирургии в настоящее время чаще всего используют цефалоспорины II–III поколений. Несмотря на высокую эффективность, эти антибактериальные препараты не лишены серьезных недостатков. В то же время, накопленный клинический опыт показал, что широкое и бесконтрольное использование цефалоспоринов привело к появлению резистентных микроорганизмов в результате продукции ими β-лактамаз [7].
Указанные данные определяют необходимость поиска новых лекарственных препаратов для профилактики внебольничных и нозо-

* 93
комиальных инфекций. В последнее десятилетие возрос интерес к использованию левофлоксацина (Л) при лечении сепсиса, хронического остеомиелита, инфекций кожи и мягких тканей. Имеются данные об успешном применении Л с целью профилактики гнойных осложнений в абдоминальной хирургии. Л оказывает бактерицидное действие на «проблемные» грамположительные и грамотрицательные микроорганизмы, которыми наиболее часто обусловлены послеоперационные инфекционные осложнения [9]. Кроме того, получены хорошие результаты использования Л в терапии экспериментального инфекционного эндокардита. Однако убедительных материалов исследований о роли и месте Л в профилактике ГСО у кардиохирургических больных на сегодня нет.
В данной работе представлены результаты профилактического применения Л у больных ИБС при операциях реваскуляризации миокарда, выполненных в условиях ИК.
Материалы и методы исследования
Исследовано 60 больных, из них 58 мужчин, 2 женщины, оперированных по поводу ИБС. Возраст больных колебался от 44 до 66 лет (средний 54±6 лет). Длительность ИК составила 78±12 минут, пережатия аорты на 51±8 минут. Основной этап операции осуществлялся
вусловиях нормотермической перфузии и тепловой кардиоплегии. Больные были распределены на две группы. В I группе (30 паци-
ентов) антибиотикопрофилактику проводили цефазолином (Ц). Первоначальную дозу препарата (1,0 г) вводили внутривенно (в/в) при поступлении больного в операционную до начала анестезии. Кроме того, при первичном заполнении аппарата ИК в перфузат включали 1,0 г Ц. Повторную дозу (1,0 г) препарата применяли в/в после окончания ИК. В последующем больные получали препарат в/в в течение трех суток с интервалом введения 6 часов.
Больным II группы вводили 250 мг Л в/в во время вводной анестезии. При первичном заполнении аппарата ИК использовали Л в дозе 250 мг. Повторную дозу Л вводили через сутки. Общая длительность антибиотикопрофилактики у больных II группы составила 2 суток. В случае появления признаков неадекватности антибиотикотерапии пациентам из обеих групп дополнительно применяли ванкомицин по 1 г каждые 12 часов и амикацин по 10 мг/кг каждые 12 часов в/в. Критериями к назначению дополнительных а/б были сохраняющаяся лихорадка, воспалительные изменения в периферической крови.
По клиническим показателям, включая и факторы риска развития инфекционных осложнений (в т.ч. диабет), пациенты обеих групп

94 *
были идентичны. Они не имели существенных различий по тяжести состояния, сопутствующим заболеваниям, полу и возрасту, времени ИВЛ, длительности ИК и операции.
Всем больным проводили рентгенографию органов грудной клетки до операции, через 1 час, на 1-й, 3-й и 9-й дни после операции. В анализ включали клинические и лабораторные данные, полученные до операции, через 1 час после поступления в реанимационное отделение, на 1-е, 3-и и 9-е сутки операционного периода и перед выпиской из стационара.
Инфицированной послеоперационной раной считали наличие классических признаков воспаления (боль, гипертермия, отек, экссудация). Диагноз послеоперационной раневой инфекции устанавливали
ив случаях воспалительной картины без бактериологического подтверждения (отсутствие роста микрофлоры). В наших наблюдениях мы не имели гнойных медиастинитов. Серозный медиастинит диагностировали на основании клинической характерной картины, результатов микробиологического исследования отделяемого из раны
иданных компьютерной томографии. Диагностика послеоперационной пневмонии основывалась на клинических (лихорадка, лейкоцитоз) и рентгенологических признаках (инфильтрация и наличие плеврального выпота). При этом осуществляли также бактериологическое изучение материала из дыхательных путей. Сепсис и синдром системного воспалительного ответа выявляли на основании клинических критериев, разработанных конференцией общества критической медицины и торакальных врачей США. При этом диагноз лихорадки неизвестной этиологии констатировали в тех случаях, когда на 2-е сутки после операции на фоне повышения температуры до 39 °С отсутствовали клинические и лабораторные признаки инфекции.
Материалом для микробиологического исследования служили раневое отделяемое, плевральный выпот, мокрота, бронхиальные смывы, моча и кровь. В микробиологической лаборатории осуществляли микроскопию мазков и посевы на стандартные среды. У выделенных микроорганизмов проводили видовую идентификацию
иопределяли антибиотико-чувствительность.
При статистической обработке данных использовали критерии Стьюдента, Вилкоксона–Манна–Уитни и парный критерий Вилкоксона.
Результаты и обсуждение. В результате проведенного исследования установлено, что из 60 больных у 18 (30%) были выявлены различные инфекционные осложнения. В большинстве случаев у

* 95
этих больных в ближайший период после операции развились тяжелые циркуляторные и метаболические нарушения. Хирургическая инфекция у больных возникла, несмотря на введение а/б перед операцией, интраоперационно и после хирургического вмешательства.
В I группе на фоне использования Ц частота возникновения основных видов послеоперационной инфекции (пневмония, сепсис, нагноение послеоперационной раны, медиастинит) были выше, чем у больных II группы, которым интраоперационно вводили Л. Так, в I группе были выявлены инфекционные осложнения у 14 (46,7%) больных, а во II группе – у 4 (13,3%) больных (р<0,05). При этом из 12 пациентов I группы у 2 больных диагностировали пневмонию, ассоциированную с ИВЛ, у 2 наблюдали сепсис (обусловленный длительной катетеризацией центральных вен), у 2 имела место длительная лихорадка, у 2 отмечали бактериурию и у 6 развилась раневая инфекция. В группе пациентов с Л у 2 больных в ближайший период после операции наблюдали лихорадку невыясненной этиологии и у 2 отмечали ГСО послеоперационных ран.
Таким образом, частота послеоперационной (хирургической) инфекции в I группе была 46,7 %, а у больных II группы – 13,3%. Наиболее частым инфекционным осложнением было нагноение послеоперационной раны. Грозное и жизненно опасное осложнение – медиастинит – развился только у больных первой группы (2 случая).
Результаты бактериологического исследования подтверждают ведущую роль грамположительных микроорганизмов в послеоперационных ГСО у кардиохирургических больных. В крови пациентов с клиникой сепсиса (2 случая) выделены эпидермальный стафилококк и энтерококк. Выделенные микроорганизмы отличались достаточно высоким уровнем антибиотикорезистентности. Так, частота устойчивости к бензилпенициллину среди S. epidermidis и S. aureus достигла 80–95%. Кроме того, микрофлора, выделенная из ран, оказалась нечувствительной к Ц. Следует отметить также, что среди грамположительных бактерий при этом отмечена высокая чувствительность выделенной микрофлоры к Л (92% штаммов). Отмечена высокая устойчивость к оксациллину. В частности, частота штаммов S. aureus, устойчивых к оксациллину, составила 26%. В этих условиях Л оказался более эффективным, чем Ц. Выявленная в настоящем исследовании этиологическая структура ГСО хорошо согласуется с известными представлениями о причинах и характере ГСО в хирургии. Согласно данным литературы золотистый стафилококк и коагулозонегативные стафилококки выделяются как ос-

96 *
новные патогены в 39–70% случаев [3]. Считается, что до 30% всех инфекций, вызванных S. аureus, обусловлены эндогенной микрофлорой. Установлено, что в инфицированных послеоперационных ранах в большинстве случаев обнаруживаются пенициллиназобразующие стафилококки, колонизирующие носоглотку и кожу, устойчивые к бензилпенициллину и ампициллину (амоксициллину) [8]. Кроме того, около 20–30% больных, поступивших в стационар, становятся носителями преимущественно больничных штаммов золотистого стафилококка. Причем среди медицинского персонала доля назального носительства S. aureus может достигать 35% [4].
В подавляющем большинстве случаев (68%) нагноение послеоперационной раны было вызвано S. epidermidis и S. aureus. В настоящее время имеют широкое распространение мультирезистентные госпитальные штаммы золотистого стафилококка. При наличии метициллинрезистентности эффективность цефалоспоринов крайне низкая [8]. Более того, высказывается положение, в соответствии с которым при выделении метициллинрезистентных штаммов стафилококков их следует рассматривать как устойчивые ко всем цефалоспоринам, применение которых должно быть исключено [7].
Накопленные в настоящее время данные свидетельствуют о том, что трудность терапии и профилактики заболеваний, вызванных в первую очередь множественноустойчивыми грамположительными микроорганизмами, связана с ограниченным выбором эффективно действующих против них а/б. Единственно приемлемым а/б является ванкомицин [6]. Однако надо учитывать, что ванкомицин является дорогостоящим и токсическим препаратом. Клинические исследования показали, что частота нежелательных явлений при применении ванкомицина может быть в два раза выше, чем при использовании других препаратов [1]. В современных условиях ванкомицин является резервным препаратом.
Указанные обстоятельства позволяют предположить, что значение Л в профилактике ГСО определяется возрастанием роли грамположительных патогенов в этиологии госпитальной инфекции. При этом появление штаммов энтерококков и стафилококков, устойчивых к ванкомицину, и потенциальная угроза их распространения, обусловили потребность во внедрении в медицинскую практику новых препаратов. Л является хорошо переносимым средством при лечении и профилактике нозокомиальных послеоперационных ГСО у кардиохирургических больных. У наших больных мы не отмечали каких-либо осложнений, связанных с применением левофлоксацина.

* 97
Проведенное сравнительное исследование показало, что Л имеет высокую эффективность при профилактическом интраоперационном применении у больных, оперируемых по поводу ИБС в условиях ИК, и по предварительным результатам может рассматриваться как перспективный препарат.
Литература
1.Белобородова Н.В. Новые тенденции в антимикробной терапии тяжелых гнойно-воспалительных заболеваний у детей и значение антибиотиков группы карбапенемов. // Российский вестник перинатологии и педиатрии. – 2002. – Т. 47, № 2. – С. 56–60.
2.Винницкий Л.И., Витвицкая И.М., Попов О.Ю. Иммунная терапия сепсиса – миф или реальность. // Анестезиология и реаниматология. – 1997. – № 3. – С. 89–97.
3.Митрохин С.Д. Инфекционные осложнения в хирургии: антибактериальная профилактика и терапия. //Инфекции и антибактериальная терапия. – 2002. – Том 4. – № 2. – С. 50–58.
4.Петухова И.Н., Дмитриева Н.В., Солодовник Ф.И., Варлан Г.В.
Эрадикация назального носительства Staphylococcus aureus и ее роль
впрофилактике раневых инфекций // Хирургия / приложение. – 2002. – № 2. – С. 22–25.
5.Сидоренко С.В. Рациональная антибиотикотерапия и доказательная медицина // Антибиотики и химиотерапия. – 2001. – Т. 46, № 9. – С. 12–18.
6.Фомина И.П., Смирнова Л.Б., Гельфанд Е.Б. Антибиотики в профилактике хирургической инфекции (микробиологические и клинические аспекты) // Антибиотики и химиотерапия. – 1998. – № 9. – С. 35–43
7.Яковлев С. В. Современное значение цефалоспориновых антибиотиков при лечении инфекций в стационаре // Антибиотики и химиотерапия. – 2001. – Т. 46, № 9. – С. 4–11.
8.Carrier M., Marchand R., Aunger P. et al. Methicillin-resistant Staphylococcus aureus infection in a cardiac surgical unit // J Thorac Cardiovasc Surg. – 2002. – Vol. 123, № 1. – P. 40–44.
9.Harbarth S., Samore M. H., Lichtenberg D., Carmeli Y. Prolonged antibiotic prophylaxis after cardiovascular surgery and its effect on surgical site infections and anti-microbial resistance // Circulation. – 2000. – Vol. 101, № 25. – P. 2916–2928.
10.Kriaras I., Michalopoulos A., Michalis A. et al. Antibiotic prophylaxis in cardiac surgery // J Cardiovasc Surg. – 1997. – Vol. 38, № 6. – P. 605–610.

98 *
СОВРЕМЕННЫЕ АСПЕКТЫ ПРОГНОЗИРОВАНИЯ
ВКАРДИОХИРУРГИИ
В.В.Далинин, Д.А. Акинфиев, Д.М. Книгин
Несмотря на непрерывное улучшение хирургической техники и медицинских технологий, способствующих этому, кардиохирургия остается областью высокого риска для пациентов. Общий показатель смертности часто используется как индикатор качества хирургического лечения, но реальное его значение будет неполным без знания факторов риска пациентов. Среди причин смертности разные системы оценки рассматривают разные факторы (предоперационные, интраоперационные, послеоперационные), но редко кто уделяет достаточно внимания предоперационным факторам риска. В экстренных ситуациях у врача часто не хватает времени на создание должного впечатления о больном в целом, ибо на первом месте стоит остро возникшее состояние и необходимость в сжатые сроки разрешить эту проблему. Нередко врачу не хватает объективности в оценке тех, не зависящих от него факторов, которые уже имеются у пациента, и, бесспорно, уже влияют на исход предстоящего оперативного вмешательства. Требуется некая система, в которой сведены основные факторы, влияющие на исход того или иного вмешательства. В нашей стране существует большое количество систем с разным подходом к оценке и с разной достоверностью. Из имеющихся систем оценки риска в кардиохирургии следует отметить принципы, выделенные Ю.Л. Шевченко и соавт. [1], как наиболее полные и объективные. Из наиболее используемых в Европе и Америке систем – система «EuroSCORE», также доказала свое право на существование и использование. Для оценки эффективности и достоверности прогноза нами была взята «Европейская система оценки операционного риска в кардиохирургии». В качестве основных предикторов в данной системе используются сопутствующие заболевания, предоперационное состояние пациента и вид хирургического вмешательства, а отечественные пациенты имеют больший удельный вес сопутствующих заболеваний по сравнению с жителями Европейских стран. Следует отметить, что в случае экстренной ситуации подобная система может оказать неоценимую помощь в прогнозировании исхода оперативного вмешательства.
Во всем мире перед внедрением в практику той или иной системы диагностики, лечения или прогнозирования, она проходит своеобразное испытание в десятках центров мира на тысячах пациентов

* 99
[2-5]. В нашей стране такой опыт практически отсутствует. Системы прогнозирования используются без подтверждения их права на существование.
Таким образом, нами была сформулирована цель данного исследования – на опыте одного лечебного учреждения проверить эффективность данной системы.
Методы: В исследование включены 363 пациента, прошедших лечение в кардиохирургическом отделении НИИГХ, в период с 2001 по 2003 г. В исследуемую группу были включены пациенты после операций аортокоронарного шунтирования, протезирования митрального клапана, протезирования аортального клапана, сочетанных операций и операций на работающем сердце. Для оценки операционного риска была взята Европейская система оценки операционного риска «EuroSCORE». Для проверки достоверности прогноза были выбраны следующие критерии: количество койко-дней с момента операции до выписки; количество койко-дней, проведенных в отделении реанимации; сроки инотропной поддержки (в днях). Была исследована ранговая корреляция между баллом по «EuroSCORE» и выбранными параметрами. Также в исследуемую группу были включены пациенты после операций по поводу постинфарктной аневризмы левого желудочка (ПАЛЖ). Этот параметр не был отражен в европейской системе.
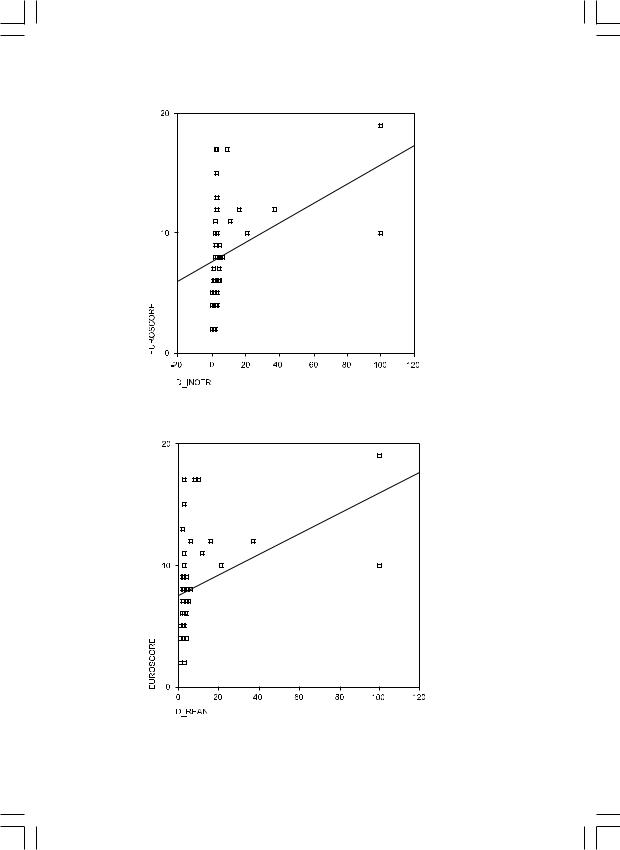
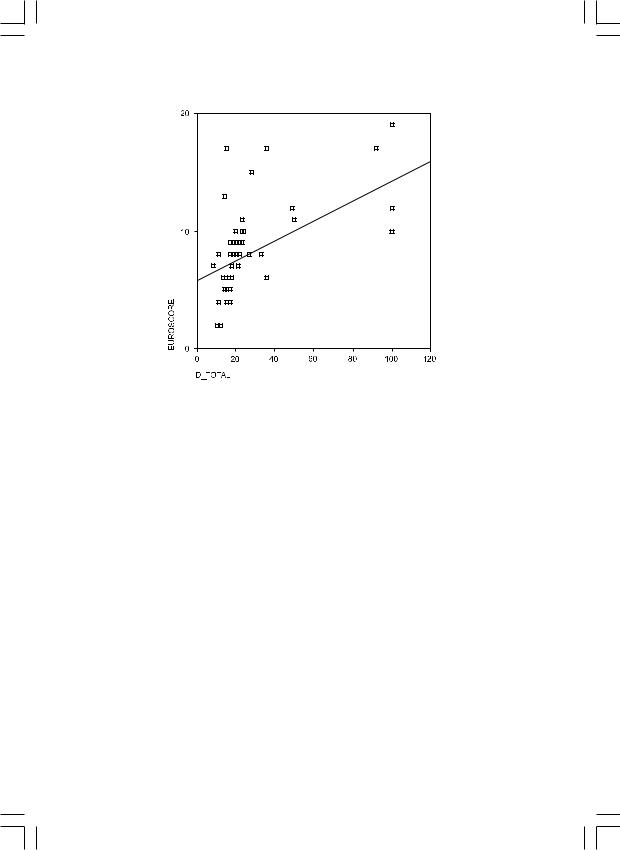
Результаты: Была выявлена стройная корреляционная зависимость оценки по «EuroSCORE» со всеми выбранными параметрами. Количество койко-дней с момента операции до выписки – коэффициент 0,7 (рис. 1); количество койко-дней, проведенных в отделении реанимации – коэффициент 0,6 (рис. 2); сроки инотропной поддержки – коэффициент 0,58 (рис. 3). Также при мультивариантном анализе как фактор, самостоятельно влияющий на исход лечения, проявил себя следующий – операция по поводу ПАЛЖ.
Выводы: Прогноз по системе «EuroSCORE» является достоверным в российских условиях. Учитывая большой удельный вес сопутствующих заболеваний у российских пациентов и достоверность прогноза для них по таблице «EuroSCORE», считаем возможным и целесообразным использовать Европейскую систему оценки операционного риска в условиях российского кардиохирургического отделения. Также неоценимую помощь эта система может оказать тогда, когда у врача нет времени на полное обследование пациента, а сложившаяся экстренная ситуация требует быстрого принятия решения по поводу объема и тяжести вмешательства.
100 *
Рис. 1. Корреляционная зависимость балла по «EuroSCORE» и сроков до выписки пациента.
Рис. 2. Корреляционная зависимость балла по «EuroSCORE» и сроков пребывания в ОРИТ.
* 101
Рис. 3. Корреляционная зависимость балла по «EuroSCORE» и сроков инотропной поддержки.
Для получения более достоверных результатов требуется проведение подобного исследования на большей выборке пациентов (несколько тысяч), и на базе нескольких крупных кардиохирургических центров.
Литература
1.Шевченко Ю.Л., Шихвердиев Н.Н., Оточкин А.В. Прогнозирование в кардиохирургии.// Практическая медицина, 1-е, 1998.
2.Nashef S.A.M., Roques F., Michel P. et al. European system for cardiac operative risk evaluation (EuroSCORE). // European Journal of Cardio-thoracic Surgery. – 1999. – 16 – pp. 3–9.
3.Geissler H.J., HoElzl P., Marohl S. et al. Risk stratification in heart surgery: comparison of six score systems.// European Journal of Cardio-thoracic Surgery. – 2000. – 17 – pp. 400–406.
4.PitkaEnena O., Niskanena M., Rehnbergb S. et al. Intra-institutional prediction of outcome after cardiac surgery: comparison between a locally derived model and the EuroSCORE // European Journal of Cardio-thoracic Surgery. – 2000. – 18 – pp. 703–710
