
Шевченко Ю.Л. - Актуальные вопросы грудной хирургии
.pdf
212 *
состояние больного. По данным ряда авторов синхронное сокращение мышечного лоскута и миокарда позволяет увеличить ударный объем сердца.
Субъективное улучшение самочувствия отмечают большинство прооперированных больных, даже если объективных данных за улучшение сократимости миокарда не получено. Кроме того, лоскут широчайшей мышцы спины образует своеобразный эластический каркас, препятствующий дальнейшей дилатации сердца. Создание наружного каркаса, препятствующего дальнейшему расширению сердца, легло в основу некоторых хирургических методов. Первый клинический опыт применения подобных операций сопровождался крайне высокой летальностью, поэтому в большинстве клиник было принято решение о дальнейших экспериментальных исследованиях
вэтом направлении.
Внастоящее время в мире ежегодно производится около 3500 пересадок сердца, однако, большая часть пациентов с ДКМП умирает, не дождавшись пересадки. Ведется постоянный поиск альтернативных методов лечения. Значительный прогресс в развитии хирургической техники, кардиоанестезиологии, ВК, более тщательный отбор больных для альтернативных операций позволил снизить летальность при подобных операциях. Оптимальный выбор хирургического метода и адекватная медикаментозная терапия позволит многим пациентам избежать пересадки сердца, и оставить необходимые для пересадки органы пациентам, которым никакой другой метод лечения не поможет.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ: ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Н.О. Травин
Прошло 40 лет с момента выполнения первой успешной операции по поводу клапанного инфекционного эндокардита (ИЭ), выполненной A. Wallas в 1963 г. [1]. Несмотря на то, что в целом в популяции ИЭ встречается редко – 25–93 случаев на 1 млн населения, проблема лечения этой патологии является одной из наиболее серьезных в кардиологии и кардиохирургии. Число пациентов, оперированных по поводу ИЭ, ежегодно увеличивается примерно на 10% не только за счет роста хирургической активности, но и за счет опережающего роста заболеваемости. Также ежегодно увеличива-

* 213
ется процент больных с «осложненными» формами ИЭ – эндокардитом правых камер сердца (катетерный, после имплантации кардиостимуляторов, у наркоманов), ИЭ клапанного протеза, абсцессами сердца [2]. По-прежнему представляет значительные трудности диагностика ИЭ, особенно в ранние сроки. Несмотря на широкое внедрение в клиническую практику ЭхоКГ, обладающей значительными возможностями в плане диагностики поражения сердечных структур, – до 71% случаев острого ИЭ не выявляются при жизни. Однако, даже при своевременно поставленном диагнозе, нет единства специалистов в стратегии лечения. Даже в вопросах номенклатуры ИЭ нет единого мнения. Также постоянно дискутируются вопросы о необходимости и сроках оперативного лечения. Одни склоняются к длительной антибактериальной терапии, а тенденцию расширительно трактовать показания к хирургическому лечению ИЭ расценивают как нежелательную [3]. Другие являются сторонниками активной хирургической тактики [6].
Цель исследования: ретроспективный анализ результатов хирургического лечения больных с активным ИЭ, оперированных в НИИ ГХ за период январь 2002 – май 2004 г.
Материалы и методы. Из 303 больных с клапанными пороками сердца, у 84 (8%) – 62 мужчины, 22 женщины, средний возраст 46±12 года – течение заболевания было осложнено ИЭ различной степени активности или в стадии ремиссии. Сроки от начала заболевания до поступления в стационар были различными – от 2 недель до 2 лет, медиана – 7 месяцев. У 11 больных имелся острый ИЭ, у 33 – подострый. Ремиссия септического процесса имела место у 40 пациентов, что может свидетельствовать о достаточно высокой эффективности антибактериальной терапии (или иммунологической реактивности организма, поскольку более чем половина больных с ИЭ в стадии ремиссии антибиотики до операции не получали). Первичный ИЭ был у 23 человек, вторичный – у 61. При вторичном ИЭ наиболее частой причиной развития заболевания был врожденный порок аортального клапана – у 32, из них у 27 имелся двустворчатый аортальный клапан (в сочетании с синдромом Марфана – 1, с коарктацией аорты – 1), в 5 случаях – врожденный аортальный стеноз. ИЭ развился на фоне ревматизма у 23 пациентов, первичной дегенерации – у 4, травмы – у 1. У 1 больной имелся ИЭ после имплантации ЭКС. Наиболее часто поражался аортальный клапан – в 52 случаях, реже митральный – 29 (комбинированный порок – 24, стеноз – 1, недостаточность – 4), изолированное поражение трикуспидального клапана имело место в 3 случаях. Мит-
214 *
рально-аортальный порок имелся у 7 больных, у 1 больного аортальный порок сочетался с относительной недостаточностью митрального клапана, потребовавшей коррекции. Митрально-аорталь- но-трикуспидальный порок был у 2 пациентов (у одного – на фоне ВПС-дефекта межжелудочковой перегородки). У 12 пациентов клинически заболевание манифестировало с легочного дебюта. Клиника сердечной недостаточности, обусловленная клапанной деструкцией и миокардитом, отмечалась у 51 пациента. У 31 пациента отмечалось поражение почек по типу диффузного острого гломерулонефрита, у 3 пациентов отмечалась клиника инфаркта почки. У 2 пациентов имелся абсцесс селезенки.
|
Интраоперационные |
|
|
проявления ИЭ были пред- |
|
|
ставлены следующим обра- |
|
|
зом: двустворчатый аор- |
|
|
тальный |
клапан – 27, |
|
вегетации |
– 49, абсцесс |
|
фиброзного кольца – 9, от- |
|
|
рыв хорд – 9, изъязвления |
|
|
эндокарда – 5, перфорация |
|
|
межжелудочковой перего- |
|
|
родки – 1 случай. Абсцес- |
|
|
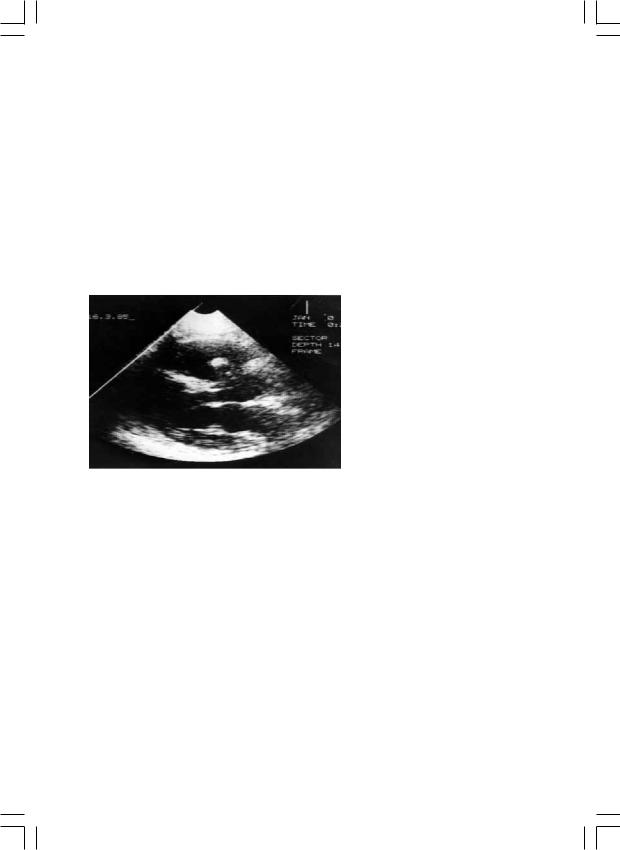
сы корня аорты (рис. 1) вы- |
|
Рис. 1. ЭхоКГ. Инфекционный эндокардит. Пер- |
явлены у 10 (13%) больных, |
|
форация абсцесса корня аорты в правый желу- |
что значительно превыша- |
|
дочек. |
ет частоту обнаружения |
|
|
||
этой патологии по данным, опубликованным ранее. Так, при анализе большого клинического материала [6] (более 1500 прооперированных больных), где абсцессы сердца выявлены приблизительно у 20% пациентов с инфекционным эндокардитом, абсцессы корня аорты имели место у 2,5% больных этой группы. Таким образом, отмечено значительное (почти двадцатикратное) увеличение встречаемости деструктивных форм эндокардита в последние годы.
Отдельную группу составляют 5 больных, оперированных по поводу ревматических или врожденных пороков, исходно неосложненных ИЭ, у которых в различные сроки после коррекции порока развился протезный ИЭ. Одна больная с протезным ИЭ ранее перенесла 2 закрытые митральные комиссуротомии и протезирование митрального клапана.
Результаты. 42 больным было выполнено протезирование аортального клапана, в 2 случаях – в сочетании с пластической опера-

* 215
цией на митральном клапане, в 1 случае – с пластикой корня аорты. Протезирование митрального клапана выполнено 25 больным, протезирование трикуспидального клапана – 3, протезирование митрального и аортального клапанов – 8, в сочетании с аннулопластикой трикуспидального клапана – 1 и протезированием клапана – 2 больным. В 3 случаях протезирование клапана сочеталось с аортокоронарным шунтированием. Одному больному перед протезированием аортального клапана первым этапом была выполнена спленэктомия по поводу абсцесса селезенки. Пластическая операция на митральном клапане выполнена у 3 пациентов, на аортальном – у 2.
Операция, помимо коррекции клапанного порока, заключалась в комплексе мероприятий, направленных на санацию эндокарда. Использовали прошивание манжетки протеза серебряной нитью, химическую санацию полостей сердца, ложа клапана, шовного материала антисептиками, проводили направленную антибактериальную терапию.
Протезный ИЭ развился у 5 больных (8% от всех оперированных по поводу ИЭ), все – после протезирования аортального клапана, в сроки от 2 недель до 2,5 лет после операции (4 больных погибли, 1 выполнено репротезирование с хорошим результатом). Обе пластики аортального клапана оказались несостоятельными – на 2-е и 14-е сутки, больным выполнено протезирование клапана. Непосредственные результаты аннулопластики митрального клапана – удовлетворительные, максимальный срок наблюдения к настоящему времени – 2 года. Госпитальная летальность составила 9,5% (8 больных). Основные причины смерти – прогрессирование сепсиса и острое нарушение мозгового кровообращения.
Обсуждение. В настоящее время для подтверждения ИЭ все чаще используют критерии диагностики ИЭ, предложенные D.T. Durack из Duke’s University Medical Center (1994) или модифицированные критерии J. Li (2000) из того же университета, которые основываются, в первую очередь, на микробиологических, а не клинических проявлениях заболевания. Так, согласно им, даже однократное выделение из крови Coxiella burnetti относится к «большим» критериям ИЭ, лихорадка – к «малым», а спленомегалия не фигурирует вовсе [5].
Некоторые исследователи считают, что только острый ИЭ – патогенетически сепсис, а подострый ИЭ – не сепсис, а лишь клапанная инфекция + септицемия (так как нет гектической лихорадки, септикопиемии и др.) [3].
Основа терапии ИЭ – длительное применение антибиотиков [4]. Формированию такой стратегии во многом способствовала класси-

216 *
фикация эндокардита, принятая ВОЗ (1975), согласно которой термин «септический эндокардит» был изменен на «инфекционный эндокардит», по аналогии с инфекционным мононуклеозом или инфекционным гепатитом. Тем самым, на первый план выходит этиологический фактор и, соответственно, лечение базируется на антибактериальной терапии. При этом сепсис, то есть генерализация процесса (в частности, эмболии в органы) и системный ответ организма как бы отодвигаются на второй план. Наконец, практически не учитывается второй компонент ИЭ – наличие клапанного порока. Между тем, любая острая клапанная недостаточность, даже в отсутствие сепсиса (например, при травматических, ятрогенных или ишемических пороках) сама по себе очень быстро – в сроки 3– 6 месяцев – приводит к декомпенсации кровообращения и тяжелой полиорганной недостаточности. Очевидно, что антибактериальная терапия не способна повлиять на состояние пациента при разрушенном клапане (рис. 2, цв. вклейка)
Если при первом появлении клинических симптомов, алгоритм диагностического поиска действительно должен базироваться на критериях Дьюкского университета, то кардиохирурги, в основном, имеют дело с пациентами с уже установленным диагнозом, однако с осложненным течением заболевания, длительно и безуспешно леченных. Поэтому Дьюкские критерии теряют свою актуальность.
На каждом из этапов – от самолечения до поступления в кардиохирургический стационар – пациент, как правило, получает массивную антибактериальную терапию. Так, средний срок от начала заболевания до операции у наших больных составил 7 месяцев. Причем, что важно, срок от установления диагноза «инфекционный эндокардит» до операции составил 4,5 месяца!
Подобная тактика, на наш взгляд, приводит к тому, что пациент с ИЭ в начале заболевания и он же в кардиохирургическом стационаре – два совершенно разных больных.
Насколько ограничен клиницист во времени при выборе тактики лечения показывает клинический пример. Больному Б., 38 лет, диагноз врожденного порока сердца – дефекта межжелудочковой перегородки – был установлен в трехлетнем возрасте. В связи с небольшими размерами дефекта (около 3 мм) и незначительным объемом лево-правого сброса, оперативное лечение пациенту не предлагалось и он находился под динамическим наблюдением кардиолога. В канун 2004 г. на фоне клинического благополучия впервые возникла лихорадка до 38,7 °С. В марте 2004 г. поступил в НИИ ГХ со сформированным трехклапанным пороком сердца (недостаточность во всех случаях), недостаточностью кровообращения IIБ стадии. На операции выявлена клапанная деструкция на фоне инфекционного эндокардита. Произведены пластика ДМЖП, протезирование мит-

* 217
рального, аортального и трикуспидального клапанов с хорошим результатом. Таким образом, весь путь от начала заболевания до формирования многоклапанного порока занял менее трех месяцев!
Однако, даже при отсутствии клапанной недостаточности, проведение антибиотикотерапии без санации первичного очага, весьма часто не приводит к эффекту. Так, например, мы наблюдали пациентку Т., 54 лет, через 3,5 года после протезирования аортального клапана дисковым протезом, с протезным эндокардитом, эмболическим синдромом, у которой по данным эхокардиографии, как трансторакальной, так и чреспищеводной, не имелось никаких данных, указывающих на дисфункцию протеза и протезный эндокардит. В течение более чем двух месяцев у больной периодически имелась гектическая лихорадка, на фоне внутривенной терапии антибиотиками резерва. При этом неоднократные посевы крови (в том числе и до начала антибактериальной терапии) роста микрофлоры не давали. На повторной операции была выявлена вегетация небольших (около 5 мм) размеров, располагавшаяся на стойке протеза, не мешающая движениям запирательного элемента (рис. 3, цв. вклейка). Только репротезирование клапана привело к стойкой ремиссии сепсиса. Данное наблюдение не только демонстрирует сложности диагностики ИЭ, но и доказывает, что без ликвидации locus minoris, в данном случае – инфицированного протеза, консервативная терапия неэффективна, в то время как замена клапанного протеза, даже при наличии вторичных септических очагов обеспечивает клиническое излечение.
Наконец, насколько ненадежны критерии постановки диагноза «инфекционный эндокардит», иллюстрирует наблюдение за больным П., 37 лет, у которого с детства имелся ревматический анамнез, в юношеском возрасте был выявлен аортальный стеноз. Дооперационный диагноз был сформулирован как «ревматический аортальный стеноз, кальциноз аортального клапана III степени». На операции выявлен двухстворчатый аортальный клапан, свежие вегетации, тромбэндокардит, абсцесс фиброзного кольца. В посевах с иссеченных створок аортального клапана – эпидермальный стафилококкк. При этом, даже при тщательном сборе анамнеза, не имелось указаний на длительные подъемы температуры, а данные лабораторных анализов при дооперационном обследовании патологических изменений не выявили.
Клиническая картина ИЭ зависит от того, какой компонент преобладает – сепсис или деструкция клапана и сердечная недостаточность. Конечно, эти две составляющих ИЭ тесно взаимосвязаны и

218 *
образуют «порочный круг», разорвать который может только операция. Даже эффективная антибактериальная терапия приводит не к излечению, а лишь к контролю над микробами, циркулирующими в крови, без контроля над возбудителем, отграниченным в абсцессах и вегетациях, и при этом совершенно не влияя на течение клапанного порока. Не исключено, что длительная антибактериальная терапия в дооперационном периоде способствует увеличению частоты осложненных форм ИЭ. Следует также учитывать, что не существует рандомизированных контролируемых исследований эффективности антибактериальной терапии при ИЭ (в первую очередь, по этическим причинам).
Поэтому в отношении острого течения процесса, рациональным нам представляется «активный» подход, независимо от тяжести состояния на момент поступления пациента в клинику. Показания к операции при активном ИЭ следующие: деструкция клапана, внутрисердечные абсцессы, подвижные вегетации, тромбоэмболии, протезный ИЭ, безуспешность антибактериальной терапии. Вмешательство преследует целью ликвидацию порока и санацию микробного очага. Оперативное лечение при таких ситуациях выполняется по жизненным показаниям, а сроки от момента поступления до момента операции могут исчисляться несколькими часами. Мы располагаем небольшим, однако, положительным опытом выполнения экстренных (в течение 1–2 суток после поступления в стационар) операций при ИЭ.
Выводы. При установленном диагнозе «инфекционный эндокардит», особенно при острых формах, время между началом заболевания и оперативным лечением должно быть сведено к минимуму. У половины больных ИЭ наступает ремиссия септического процесса (под влиянием антибактериальной терапии или самопроизвольно), что не является основанием для отказа от операции. У ряда пациентов с ИЭ в стадии ремиссии могут быть выполнены пластические операции на митральном клапане. Тактика комплексной профилактики протезного эндокардита эффективна в большинстве случаев.
Литература
1.Сердечно-сосудистая хирургия под редакцией В.И. Бураковского, Л.А. Бокерия. М., 1989.
2.Бокерия Л.А., Гудкова Р.Г. Здоровье населения Российской федерации и хирургическое лечение болезней сердца и сосудов в 1999 году / М.; издательство НЦ ССХ им. А.Н. Бакулева, 2000.

* 219
3.Виноградова Т.Л. Инфекционный эндокардит: современное течение, вопросы и проблемы // Сердце. 2003. – Т. 2, №5 (11). –
С.222–225.
4.Кулешова Р.Г., Щукин В.С., Илюхина Л.Б. Особенности ведения больных с клапанными протезами сердца / Новосибирск, 1998.
5.Тюрин В.П. Острый инфекционный эндокардит: тактика ведения и лечения // Сердце. 2003. – Т. 2, №5 (11). – С. 226–230.
6.Шевченко Ю.Л. Инфекционный эндокардит / СПб.; Наука, 1996.
ОПЫТ ИСПОЛЬЗОВАНИЯ ФЛУВАСТАТИНА МЕДЛЕННОГО ВЫСВОБОЖДЕНИЯ У ПАЦИЕНТОВ, ПЕРЕНЕСШИХ ОПЕРАЦИЮ АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ В УСЛОВИЯХ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ
М.Ю. Уйманова
Первое сообщение о Флувастатине (Лескол™, Novartis Pharma Ink.) – полностью синтетическом представителе класса ингибиторов ГМГ-Ко-А-редуктазы (статинов) появилось в научной литературе в 1991 г. [1]. Широкое применение статинов в кардиологии основано на положительных результатах широкомасштабных клинических исследований с достоверным снижением сердечно-сосудистой и общей смертности и количества ишемических эпизодов. В 2002 г. были опубликованы результаты двух новых рандомизированных исследований с использованием лескола (Л), которые уже обсуждались в обзорных публикациях. Л быстрого высвобождения активно использовался в дозировках 20–80 мг с хорошей эффективностью и переносимостью у больных с первичной и комбинированной дислипидемией. Максимальное снижение холестерина (ХС) липопротеинов низкой плотности (ЛПНП) при использовании этих доз Л составило 22–36%. Снижение уровня ЛПНП сопровождалось замедлением развития коронарного атеросклероза и снижением количества коронарных событий у больных с атеросклерозом. Ретроспективный анализ широкомасштабных клинических исследований с применением статинов свидетельствует, что для достижения клинического эффекта необходимо снижение уровня ХС ЛПНП на 25–35%. Таким образом, необходимым стандартом для препарата стала стартовая доза, позволяющая снизить ХС ЛПНП не менее чем на 25%.

220 *
За 10 лет интенсивного изучения Л в контролируемых исследованиях и активного использования в повседневной практике накоплено большое количество данных по хорошей эффективности, переносимости и безопасности этого статина у разных категорий больных [2]. В этой публикации будут более подробно обсуждены вопросы влияния Л на выраженность проявлений атеросклероза и результаты лечения Л у больных, перенесших аортокоронарное шунтирование (АКШ) в условиях искусственного кровообращения (ИК).
Материалы и методы
Параметры фармакокинетики, эффективность, безопасность и переносимость новой формы Л изучали в фармакологическом исследовании у 79 больных с первичной гиперхолестеринемией в динамике после АКШ с ИК. Исследуемая группа была представлена пациентами мужского пола, средний возраст составил 51 год. Анамнез заболевания проявлялся в среднем, в течение 3 лет. Все пациенты имели III–IV ФК стенокардии. У 13 больных стенокардия носила нестабильный характер (безболевая ишемия миокарда – у 9, впервые возникшая – у 4, участившиеся приступы – у 16, острый инфаркт миокарда – у 3). 3 пациента имели сахарный диабет средней степени тяжести, в т.ч. инсулинзависимый 2-го типа, в стадии субкомпенсации. У 6 пациентов наблюдалось повышение трансаминаз, уровня общего билирубина без клиники печеночной недостаточности.
67 пациентов исследуемой группы получали новую форму Л (лескол XL 80 мг). 11 пациентов получали 40 мг Л. Снижение уровня ХС ЛНП было практически одинаковым в группах, получавших Л 40 мг и Л XL 80 мг (на 34%). Снижение уровня ТГ во всех группах было одинаковым и составило 21–23%. Переносимость Л XL 80 мг и обычного Л 40 мг была одинаково хорошей, но побочные реакции возникали чаще при применении Л ХL 80 мг. Самыми частыми проявлениями побочных реакций Л XL 80 мг были диспепсия (2%) и головная боль (0,3%). Диспепсия была также наиболее частым побочным эффектом в группе, принимавшей обычный лескол 40 мг/сут (1%), и в группе Л 80 мг (2%).
Повышение активности АЛТ было одинаковым в группах, принимавших различные формы Л 80 мг (1,7%), и несколько чаще регистрировалось в группе, получавшей 40 мг обычного Л на ночь. Что касается активности креатинкиназы, то только у 1 пациента на фоне

* 221
приема обычной формы Л 80 мг она превысила исходный уровень на 0,8%.
Все пациенты этой исследуемой группы имели гемодинамически значимое множественное поражение коронарных артерий. Среднее количество шунтов во время операции, составило – 2,7.
После двухнедельного вводного диетического периода больные были разделены на 3 группы (Л XL 80, 160, 320) в зависимости от тяжести дислипидемии. Препарат назначали в среднем за 14 дней до оперативного лечения, в динамике, соответственно, через 3 и 6 месяцев после оперативного лечения. Учитывая, что 13 пациентов имели клинику нестабильной стенокардии, курс предоперационной подготовки включал в себя использование непрямых антикоагулянтов. Антиангинальная терапия, включая предоперационную подготовку с использованием β-блокаторов, нитратов, кальциевых блокаторов, дезагрегантов проводилась всем больным. Больным с артериальной гипертензией проводилось лечение ингибиторами АПФ, блокаторами ангиотензин-2 рецепторов. Некоторые пациенты, имеющие признаки сердечной недостаточности, принимали диуретики и сердечные гликозиды.
За время наблюдения на фоне лечения Л не отмечено ни одного случая парадоксального или несоответствующего взаимодействия статина с другими антиангинальными препаратами. В целом новая форма Л хорошо переносилась больными по всему спектру доз 80– 160 мг/сутки. Дозировка Л XL 320 мг плохо переносилась больными (побочные эффекты у 6 пациентов включали диарею, головную боль и повышение активности трансаминаз печени). Результаты фармакокинетического исследования показали, что при назначении дозы 320 мг/сутки происходит перенасыщение печени флувастатином, и концентрация препарата в крови резко возрастает.
Через 3 месяца лечения в группе, получавшей Л MB, среднее снижение ХС ЛНП составило 36%, в то время как в группе, принимавшей обычный Л 40 мг, – 26%. Лечение обычной формой Л в дозе 80 мг привело к снижению ХС ЛНП на 36%. За 4 недели лечения Л XL 80 мг и обычным Л 80 мг больше половины пациентов (58 и 59% соответственно) достигли целевого уровня ХС ЛНП – менее 130 мг/дл (3,35 ммоль/л). В группе, получавшей обычный Л 40 мг/сут, количество таких больных было гораздо меньше – 20%. Больные после операции АКШ с ИК, получавшие Л XL 80 мг, гораздо чаще достигали уровня ЛНП менее 100 мг/дл (19%), чем на фоне лечения обычным Л 40 мг – 2%.
