
Шевченко Ю.Л. - Актуальные вопросы грудной хирургии
.pdf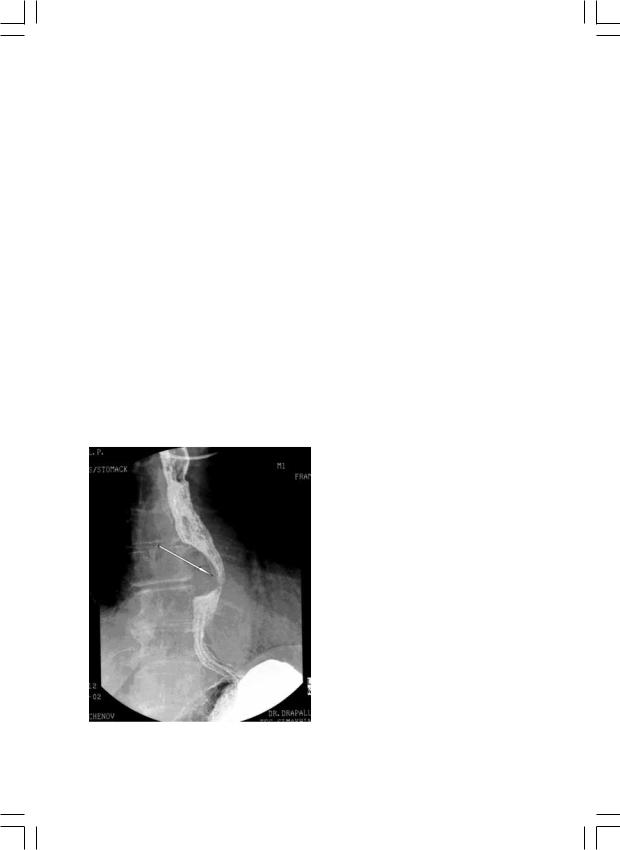
112 *
Необходимо отметить, что захватывание зажимами может привести к «раскалыванию» образования на несколько фрагментов. Без должной фиксации возникают трудности в определении границ опухоли по отношению к слизистой оболочке пищевода, что может привести к перфорации последней.
Вылущенную опухоль погружали в эндоскопический контейнер. Затем с помощью эндоскопического сшивающего инструментария («EndoStich», либо иглодержателя) непрерывным швом ушивали дефект в мышечной оболочке пищевода. Мы использовали рассасывающийся шовный материал. Контролировали гемостаз. (Операция практически бескровная, в среднем кровопотеря не превышала 100– 150 мл). Затем выполняли эндоскопическое исследование для контроля целостности стенки пищевода и установки зонда для энтерального питания. Контейнер с удаленной опухолью извлекали через разрез в месте введения одного из торакопортов. Производили дренирование правой плевральной полости.
В качестве примера приводим следующее клиническое наблюдение. Больная Д., 68 лет, поступила 11.02.2003 в торакальное отделение клиники НИИ Грудной хирургии. Специфические жалобы отсутствовали. Из анамнеза известно, что в 1995 г. проходила обследование по поводу гастрита. При эзофагогастродуоденоскопии выявлена подслизистая опухоль в нижней трети пищевода диаметром около 15 мм.
|
Находилась под динамическим наблю- |
|
|
дением. К концу 2002 г. подслизистая |
|
|
опухоль (лейомиома) увеличилась в |
|
|
размерах до 30 мм, что послужило по- |
|
|
казанием к оперативному лечению. |
|
|
При поступлении состояние боль- |
|
|
ной удовлетворительное. Данные рент- |
|
|
генографии: пищевод свободно прохо- |
|
|
дим. В нижней трети пищевода (на |
|
|
уровне 8–9 грудных позвонков) по пра- |
|
|
вому контуру определяется краевой |
|
|
дефект наполнения размерами 3х2 см |
|
|
с четким контуром (рис. 3). |
|
|
Складки слизистой оболочки в этом |
|
|
отделе оттеснены, прослеживаются на |
|
|
всем протяжении. Задержки контрас- |
|
|
та на уровне дефекта не отмечено. Ди- |
|
|
стальнее без патологических измене- |
|
|
ний. Компьютерная томография |
|
|
органов грудной клетки: органических |
|
|
изменений в легких не выявлено. |
|
|
Структуры средостения, корней лег- |
|
Рис. 3. Рентгенограмма больной Д. (объяс- |
ких дифференцированы. Признаков |
|
лимфаденопатии нет. Сердце обычной |
||
нения в тексте). |
||
конфигурации и размеров. Просвет пи- |
||
|

* 113
щевода в верхней трети грудного отдела расширен. В нижней трети стенка пищевода утолщена на протяжении 25 мм, просвет не прослеживается. Контуры пищевода ровные, четкие.
При эзофагоскопии в нижней трети пищевода по задне-правому контуру – подслизистая опухоль (лейомиома) 3х2 см, плотноэластической консистенции, слизистая оболочка над ней не изменена. Просвет пищевода сужен, для аппарата свободно проходим.
26.02.2003 г. выполнено торакоскопическое удаление лейомиомы нижней трети пищевода. Длительность операции составила 2 часа 10 минут. Эндотрахеальный наркоз двухпросветной трубкой с отключением правого легкого. Положение больной на животе. Торакоскоп введен справа в 8-м межреберье по лопаточной линии.
В9-м межреберье по лопаточной линии и в 7-м межреберье по задней подмышечной линии введены троакары диаметром 10 мм. Пересечена нижняя легочная связка. Вскрыта медиастинальная плевра. После введения в просвет пищевода зонда установлено, что в нижней трети пищевода по правой стенке имеется опухоль округлой формы с четкими контурами, размерами 3,5х3 см (см. рис. 4, цв. вклейка).
Интраоперационный диагноз: лейомиома нижней трети пищевода. Рассечена мышечная оболочка пищевода. С использованием ультразвукового диссектора опухоль удалена без повреждения слизистой оболочки пищевода. Ушивание мышечной оболочки непрерывным швом аппаратом «Endostich». Отдельными швами ушита медиастинальная плевра. Опухоль погружена в контейнер и удалена через разрез длиной 2,5 см. Контроль гемостаза. Оставлен дренаж в плевральной полости. Больная переведена в положение на спине, выполнено интраоперационное эндоскопическое исследование. В слизистой оболочке нижней трети пищевода видимых дефектов не обнаружено, сужения и деформации просвета пищевода нет.
Вдвенадцатиперстную кишку проведен зонд для энтерального питания.
Макропрепарат: опухоль размерами 3,5х3 см серо-белого цвета эластической консистенции. Данные гистологического исследования препарата: лейомиома с участками пролиферации.
Послеоперационный период протекал без осложнений. Дренирование правой плевральной полости продолжалось одни сутки. Антибиотики (лендацин 1,0 г в сутки) и анальгетики (кетонал 2,0 мл внутримышечно 3 раза в день) применяли в течение 2 дней. Энтеральное питание через зонд в течение 3 дней, затем питание через рот. На 7-е сутки после операции сняты швы с послеоперационных ран (заживление первичное), больная в удовлетворительном состоянии выписана из стационара.
Результаты
7 операций выполнены торакоскопическим способом. Интраоперационное осложнение отмечено в 1 наблюдении. Лейомиома нижнегрудного отдела пищевода размерами 8х6х5 см была удалена торакоскопическим доступом. После ушивания дефекта в мышечной оболочке пищевода отмечено кровотечение из ранее клипированной аортальной ветви, которое не удалось остановить эндохирургическим способом. Были выполнены торакотомия в 6-м межреберье и лигирование кровоточащего сосуда.

114 *
Ни у одного больного не было послеоперационных осложнений. Дренирование правой плевральной полости осуществляли через
1 дренаж в течение суток. В конце операции всем больным выполняли блокаду межреберных нервов справа 2% раствором лидокаина. В послеоперационном периоде для обезболивания применяли кетопрофен (суточная доза 300 мг внутримышечно) в течение 2 суток. Пероральное питание разрешали на 3-и сутки. Больных выписывали из стационара на 5-7-й день после операции.
Гистологическое исследование образований во всех 7 случаях выявило лейомиомы.
5 больных обследованы в сроки от 1 до 3 лет после операции. Пациентки не предъявляли жалоб на дисфагию, признаков рецидива опухоли не выявлено.
Заключение
Хирургия минимального доступа быстро расширяет свои области применения, что обеспечивает хирургам новые возможности. При этом выигрывают и пациенты. Болевой синдром после торакоскопических вмешательств менее выражен по сравнению со стандартной торакотомией из-за небольшой травмы тканей и отсутствия необходимости разведения ребер. Постоянные усовершенствования инструментария оптимизируют возможности хирургов в выполнении такого вмешательства. Показания и цели операции должны определяться в каждом конкретном случае. Переход к открытой торакотомии должен выполняться в случае необходимости и рассматривается как следующий логический шаг хирурга.
Литература
1.Галлингер Ю.Е., Годжелло Э.А. Оперативная эндоскопия пищевода. – М.: РНЦХ РАМН, 1999.
2.Кузин Н.М., Сафронов В.В., Кашеваров С.Б., Майорова Ю.Б., Лакреева М.Г. Торакоскопическая резекция пищевода по поводу рака его нижнегрудного отдела. // Хирургия. 1999. 6. С. 66–67.
3.Оперативная хирургия. Под общей редакцией И. Литтманна. Изд-во акад. Наук Венгрии. Будапешт, 1981. С. 203.
4.Черноусов А.Ф., Богопольский П.М., Курбанов Ф.С. Хирургия пищевода: Руководство для врачей. – М.: Медицина, 2000. С. 107.
5.Эндосонография при опухолях пищевода, желудка, средостения. Метод. рекомендации. Москва, МНИОИ им. П.А. Герцена. 1998.

* 115
6.Benign Tumors of the Esophagus. Ed. Sundarasan S., Seminars in Thoracic and Cardiovascular Surgery. 2003; 15 (1).
7.Bonavina L., Segalin A., Rosati R. et al: Surgical therapy of esophageal leiomyoma. // J Am Coll Surg, 1995, V.181, P. 257-262.
8.Cuschieri A. Thoracoscopic subtotal oesophagectomy. // Surg Endosc, 1994, 2(1): P. 21-25.
9.Kelemen J.J. III, Naunheim K.S. Minimally invasive approaches to mediastinal neoplasms. // Seminars in Thoracic and Cardiovascular Surgery, 2000, V. 12. № 4 (October), P. 301-306.
10.Lin J.C., Hazelrigg S.R., Landreneau R.J. Video-assisted thoracic surgery for diseases within the mediastinum. // Surgical Clinics of North America, 2000, V. 80, N 5 (October), P.1524.
11.Weder W. Minimaly invasive thoracic surgery in benign esophageal disease.// 2-nd EACTS/ESTS joint meeting. Vienna, Austria, 12-15 Oct. 2003, P.74-75.
ВЛИЯНИЕ СИНТЕТИЧЕСКИХ АНАЛОГОВ ПЕПТИДОВ ТИМУСА НА ПРОДУКЦИЮ ЦИТОКИНОВ И ФАГОЦИТАРНУЮ АКТИВНОСТЬ КЛЕТОК ПЕРИФЕРИЧЕСКОЙ КРОВИ
К.Ф. Ким
Наряду с грубыми расстройствами иммунитета, наблюдаемыми при первичных иммунодефицитах, серьезную медицинскую проблему представляют менее глубокие иммунологические нарушения. Пептидные иммуномодуляторы в наибольшей степени отвечают задаче устранения функциональных нарушений, не связанных с грубой структурной патологией иммунной системы. Большинство из препаратов этой группы представляют собой очищенные экстракты тимуса [2]. К ним относятся комплексные препараты тималин и тактивин, тимопентин и иммунофан. В 1988 г. из лекарственного препарата «Тималин» был выделен биологически активный дипептид, получивший название тимоген (ТГ). Позже получено несколько синтетических аналогов тимогена. К ним относятся препараты тимодепрессин (ТД) и неоген (НГ). Эти пептиды исследовались преимущественно на способность корригировать функции Т-клеточного звена иммунной системы. Между тем, имеются свидетельства, что спектр эффектов этих пептидов не ограничивается Т-лимфоцитами, и они способны влиять на фагоцитирующие клетки и другие факто-

116 *
ры врожденного иммунитета. Однако эти эффекты ТГ и его аналогов остаются мало изученными.
Цель исследования: изучение влияния ТГ и его модифицированных аналогов НГ и ТД на параметры функционирования лимфоцитов и фагоцитов человека.
Материалы и методы
Для исследований кровь брали у здоровых доноров в возрасте от 20 до 46 лет (средний возраст 33 года).
Для определения содержания цитокинов в супернатанте и мононуклеарных клетках периферической крови клетки выделяли по методу Boyum, основанному на седиментации клеток в градиенте фиколл-верографина. Для оценки процесса поглощения бактерий фагоцитами и продукции активных форм кислорода лейкоциты выделяли из гепаринизированной крови с помощью спонтанной седиментации в фосфатном солевом буфере, содержащем 1% желатины.
Продукцию цитокинов определяли с использованием твердофазного иммуноферментного анализа. Для оценки содержания внутриклеточных цитокинов в Т-лимфоцитах использовали метод двуцветной цитометрии.
Для оценки фагоцитарного процесса измеряли поглотительную активность гранулоцитов и моноцитов периферической крови с помощью проточной лазерной цитометрии с применением Staphylococcus aureus. Образование активных форм кислорода оценивали путем измерения спонтанной и индуцированной опсонизированным зимозаном люминол-зависимой хемилюминесценции. Продукцию внутриклеточной перекиси водорода исследовали методом проточной цитофлюориметрии с использованием дихлорфлуоресцеин диацетата (ДХФ).
Результаты исследования
Изучалось влияние трех синтетических олигопептидов – ТГ, НГ и ТД – на спонтанную и индуцированную стимуляторами секрецию фактора некроза опухоли-α (ФНО-α), интерферона-α (ИФН-α) и ин- терферона-γ (ИФН-γ) in vitro. Также проводилось исследование внутриклеточной экспрессии ИФН-γ и интерлейкина-4 (ИЛ-4) в активированных Т-лимфоцитах под действием препаратов. Изучалась способность пептидов влиять на поглотительную функцию и метаболическую активность полиморфноядерных и мононуклеарных фагоцитов.
* 117
Все пептиды подавляют секрецию ФНО-α и усиливают секрецию ИФН-α стимулированными мононуклеарами крови, причем наибольший эффект выявлен при концентрации препаратов 1 мкг/мл. На выработку ИФН-γ нестимулированными клетками ТГ НГ и ТД оказывают регуляторное действие: усиливают исходно низкую и ослабляют высокую спонтанную продукцию этого цитокина. При действии на стимулированные клетки наблюдалось стимулирующее действие всех трех пептидов на синтез ИФН-γ при концентрации
10мкг/мл.
Влияние исследованных пептидов на экспрессию внутриклеточ-
ных цитокинов ИФН-γ и ИЛ-4 можно расценивать как их влияние на дифференцировку хелперных Т-лимфоцитов в направлении Th1- и Th2-клетки.
Стимулирующее действие ТГ на внутриклеточное содержание ИФН-γ и ИЛ-4 проявляется при дозах 0,1 (максимально) и 1 мкМ, а ингибирующее действие НГ и ТД – при дозах 1 и 10 мкМ. Таким образом, исследованные пептиды разнонаправленно влияют на синтез Т-клетками ИФН-γ и ИЛ-4.
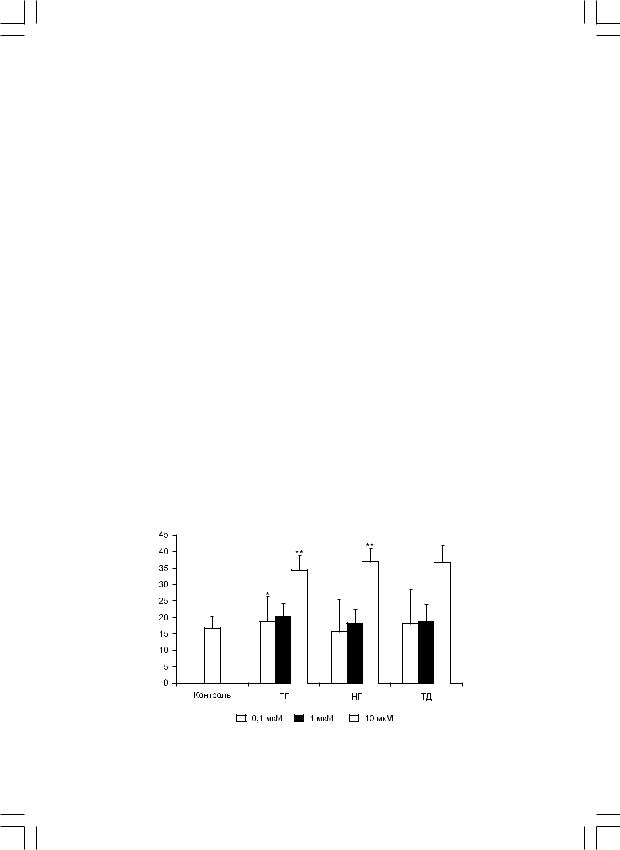
Исследование поглотительной активности клеток периферической крови с помощью проточной цитометрии позволяет четко дифференцировать величину этого показателя у полиморфноядерных и мононуклеарных фагоцитов. ТГ, НГ и ТД проявили стимулирующее воздействие на фагоцитоз бактерий (St. aureus) (рис. 1). Все три препарата в максимальной дозе (10 мкМ) в два раза увеличивали процент фагоцитоза: 16,7±3,5% в контроле и, соответственно, 34,4±7,5%, 37±9,7% и 36,7±10,5% с препаратами.
Рис. 1. Стимулирующее воздействие пептидных иммуномодуляторов на фагоцитоз бактерий (St. aureus).

118 *
Показатели спонтанной и стимулированной опсонизированным зимозаном люминолзависимой хемилюминесценции значительно повышаются в присутствии ТГ, НГ и ТД (табл. 1). В отсутствие препаратов регистрировали хемилюминесцентный ответ, равный 17,1±5,0 мВ/мин, ТГ усиливал образование кислородных радикалов, при этом пик хемилюминесценции равнялся 36,7±21,4 мВ/мин (p<0,01), НГ давал 36,8±26,7 мВ/мин (p<0,05), ТД – 27,3±14,1 мВ/мин (p<0,05). Эффект стимуляции проявлялся при дозе препаратов 10 мкМ.
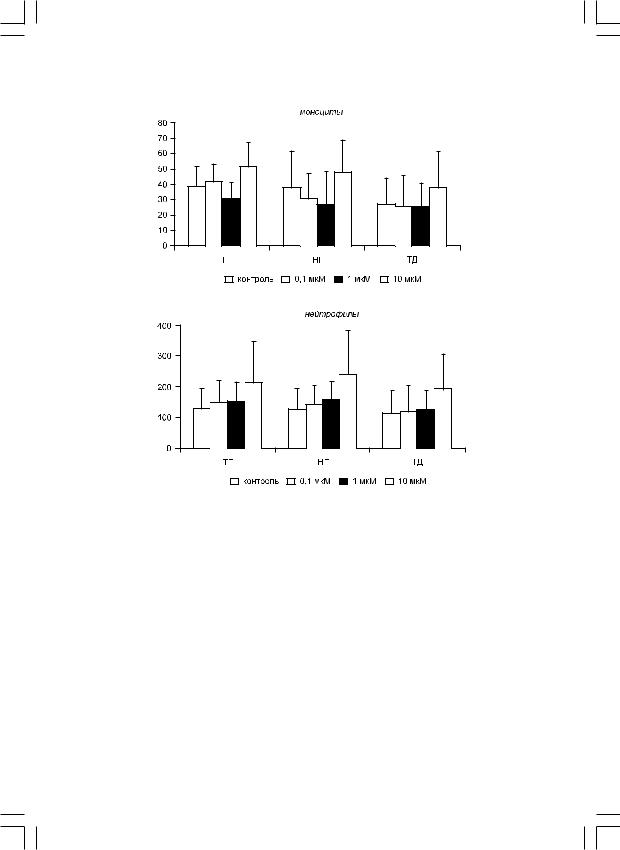
Оценка образования перекиси водорода в фагоцитах проводилась по интенсивности свечения ДХФ. Все три препарата в дозе 10 мкМ проявили стимулирующий эффект на образование перекиси водорода в моноцитах, так как величина флюоресценции ДХФ в этих клетках на 50% превышала контрольные (рис. 2). Нейтрофилы реагировали более активно. НГ (10 мкМ) изменял показатель интенсивности свечения ДХФ в этих клетках в два раза (125,9±56,5 усл. ед. в контроле и 251,1±141,7 в опыте, p<0,05), а ТГ и ТД в этой же дозе повышали среднюю интенсивность свечения на 80 и 60% соответственно, повышение интенсивности свечения ДХФ в нейтрофилах под влиянием ТГ было также статистически достоверным (126,6±60,4 в контроле и 207,8±132,8 в опыте, p<0,05).
Таблица 1. Влияние ТГ, НГ и ТД на люминолзависимую хемилюминесценцию фагоцитов периферической крови доноров (** p<0,01, * p<0,05)
|
|
|
|
|
|
|
|
|
|
Иммуномодулятор |
|
Доза, |
|
Люминолзависимая хемилюминесценция, |
|
||
|
|
|
мкМ |
|
|
|
мВ/мин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Спонтанная |
|
Стимулированная |
|
|
|
|
|
|
|
|
|
|
|
Контроль, n=11 |
|
|
|
17,1±5,0 |
|
105,0±37,2 |
|
|
|
|
|
|
|
|
|
|
|
ТГ, n=11 |
|
0,1 |
|
17,6±7,1 |
|
95,5±30,9 |
|
|
|
|
|
|
|
|
||
|
|
|
1,0 |
|
18,3±7,2 |
|
104,7±46,9 |
|
|
|
|
|
|
|
|||
|
|
|
10,0 |
|
36,7±21,4** |
|
163,3±35,1** |
|
|
|
|
|
|
|
|||
|
НГ, n=11 |
|
0,1 |
|
19,7±8,7 |
|
100,3±35,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1,0 |
|
19,1±9,1 |
|
112,3±57,8 |
|
|
|
|
|
|
|
|||
|
|
|
10,0 |
|
36,8±26,7* |
|
151,7±33,3** |
|
|
|
|
|
|
|
|||
|
ТД, n=11 |
|
0,1 |
|
17,4±5,6 |
|
92,5±41,3 |
|
|
|
|
|
|
|
|||
|
|
|
1,0 |
|
21,0±11,2 |
|
101,3±42,9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10,0 |
|
27,3±14,1* |
|
144,4±43,4* |
|
|
|
|
|
|
|
|
|
|
* 119
а
б
Рис. 2 а, б. Стимулирующий эффект пептидных иммуномодуляторов на образование перекиси водорода в моноцитах.
Обсуждение результатов
Эффект пептидных препаратов был изучен на нескольких типах клеток, которые можно объединить в 2 группы. В одну из них входят фагоцитирующие клетки (нейтрофилы, моноциты), вторую группу образуют покоящиеся и активированные лимфоциты. Главным объектом изучения действия пептидов служили Т-лимфоциты. При оценке секреции цитокинов в качестве стимулятора использовали Т-кле- точный митоген фитогемагглютинин (ФГА), внутриклеточные цитокины выявляли в CD3+ клетках.
Результаты исследования суммированы в табл. 2. Они с достаточной очевидностью позволяют констатировать, что при действии на

120 *
Таблица 2. Активность пептидов группы ТГ в тестах in vitro.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Клетки- |
|
Показатель |
|
ТГ |
|
НГ |
|
ТД |
|
Соотношение |
|
|
мишени |
|
|
|
|
|
|
|
|
|
активности |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нейтрофилы |
|
Фагоцитоз St.aureus |
|
↑↑ |
|
↑↑ |
|
↑↑ |
|
ТГ> ТД=НГ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Спонтанная |
|
↑↑ |
|
↑↑ |
|
↑↑ |
|
ТГ=НГ>ТД |
|
|
|
|
хемилюминесценция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Индуцированная |
|
↑↑ |
|
↑↑ |
|
↑↑ |
|
ТГ=НГ>ТД |
|
|
|
|
хемилюминесценция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Образование Н2О2 |
|
↑↑ |
|
↑↑ |
|
(↑) |
|
НГ>ТГ>ТД |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Моноциты |
|
Спонтанная |
|
↑↑ |
|
↑↑ |
|
↑↑ |
|
ТГ=НГ>ТД |
|
|
|
|
хемилюминесценция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Индуцированная |
|
↑↑ |
|
↑↑ |
|
↑↑ |
|
ТГ=НГ>ТД |
|
|
|
|
хемилюминесценция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Выработка ИФН-α |
|
↑↑ |
|
(↑) |
|
(↑) |
|
НГ>ТД=ТГ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лимфоциты |
|
Секреция ФНО-α |
|
↓ ↓ |
|
↓ ↓ |
|
↓ ↓ |
|
НГ>ТД>ТГ |
|
|
крови |
|
|
|
|
|
|
|
|
|
|
|
|
|
Секреция ИФН-γ |
|
↑ |
|
↑ |
|
↑ |
|
НГ>ТГ>ТД |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Накопление ИФН-γ в |
|
↑ |
|
↓ |
|
↓ |
|
НГ=ТД |
|
|
|
|
Т-клетках |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Накопление ИЛ-4 в |
|
↑ |
|
↓ |
|
↓ |
|
НГ=ТД |
|
|
|
|
Т-клетках |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сокращения: ТГ – ТГ, НГ – НГ, ТД – ТД.
Условные обозначения: ↑ – усиление эффекта, ↓ – ослабление эффекта, = – эффект отсутствует. (↑↑ или ↓↓) – статистически значимые различия; (↑ или ↓) – результаты получены в 3–4 повторах без статистической обработки (более, чем 1,5-кратные различия); значки в скобках – выраженная, но статистически незначимая тенденция. В последнем столбце значки >, = означают сравнительную выраженность эффекта пептидов (больше, равен)
нелимфоидные клетки пептиды оказывают преимущественно стимулирующий, а при действии на лимфоциты - ингибирующий эффект.
Исследование воздействия ТГ, НГ и ТД на важнейшие функции фагоцитарных клеток показало, что все три олигопептида в дозе 10 мкМ оказывают стимулирующее влияние на поглотительную активность нейтрофильной популяции, но не моноцитарной. Эти результаты подтверждают недавно опубликованные данные об увеличении поглотительной активности нейтрофилов в отношении St. aureus под действием тималина или ТГ, что было показано при введении этих препаратов мышам in vivo в дозе 0,01 мг/кг [5].

* 121
Образование кислородных метаболитов в «респираторном взрыве» вносит существенный вклад в процесс киллинга фагоцитированных микроорганизмов, а также дает возможность оценить степень возбужденности клетки и ее функциональный потенциал при воздействии стимулятора.
Тимоген, НГ и ТД усиливают образование кислородных метаболитов, регистрируемое в люминолзависимом хемилюминесцентном анализе. По интенсивности свечения ДХФ, оцениваемого с помощью проточной цитометрии, можно судить об уровне синтеза внутриклеточной перекиси водорода в отдельных клетках.
Все три препарата оказывали стимулирующее влияние на образование перекиси водорода в моноцитах и нейтрофилах. На основании недавно опубликованных данных известно, что микромолярные дозы перекиси водорода повышают активность фактора транскрипции NF-κВ, который, в свою очередь, регулирует ряд генов, необходимых для нормальных клеточных ответов, в том числе гены итер- лейкина-2 (ИЛ-2), интерлейкина-6 (ИЛ-6), итерлейкина-8 (ИЛ-8) и ФНО-α [4].
Одной из возможных причин повышения фагоцитарной активности под действием тимических пептидов является увеличение числа рецепторов на поверхности нейтрофилов, возможно, благодаря увеличению экспрессии интегрина CD11b/CD18 [3].
Все три пептида также стимулируют секрецию ИФН-γ мононуклеарными клетками периферической крови, стимулированными вирусом болезни Ньюкасла. Исследование способности ТГ, НГ и ТД влиять на функциональную активность фагоцитарных клеток указывает на важность взаимоотношения этих олигопептидов с такой значительной популяцией клеток периферической крови, как фагоцитарные.
Напротив, пептиды вполне закономерно подавляют различные проявления активности лимфоцитов (прежде всего Т-клеток), особенно в условиях активации. Так, исследование прямого воздействия синтетических пептидных препаратов, являющихся аналогами тимических гормонов, на синтез и секрецию ряда цитокинов показало, что все три исследуемых олигопептида оказывают сходное действие на выработку цитокинов нестимулированными и стимулированными Т-клетками крови человека. В их действии на нестимулированые мононуклеары преобладает регуляторный эффект, особенно четко проявляющийся при оценке секреции ИФН-γ. Все три пептида усиливают продукцию ИФН-γ стимулированными клетками (при этом НГ и ТД подавляют его синтез). Стимулированные клетки отвечают сни-
