
Шевченко Ю.Л. - Актуальные вопросы грудной хирургии
.pdf
172 *
Принято считать, что диагноз М правомочен при сочетании предшествующей инфекции (или другого заболевания, например, лекарственной аллергии) с двумя или более из уже указанных признаков поражения миокарда: патологическими изменениями ЭКГ, повышением уровня лактатдегидрогеназы и кардиальных фракций ее изоферментов, маркеров повреждения миокарда (тропонина Т или I, КФК-МВ), кардиомегалией, застойной СН, тахикардией, ослабленным I тоном, ритмом «галопа» и др.
Иногда клинико-лабораторных данных оказывается недостаточно для диагностики заболевания и тогда проводят субэндомиокардиальную биопсию правого желудочка. Для М наиболее характерна инфильтрация лимфоцитами интерстициальной ткани в сочетании с дегенеративными и (или) некротическими изменениями мышечных волокон [5]. Современные методы иммуногистохимии позволяют определить различные популяции лимфоцитов в биоптатах миокарда: идентифицировать Т-хелперы (CD4+) и Т-цитотоксимеские (CD8+) лимфоциты, активированные лимфоциты, NK-клетки, макрофаги, измерить уровень и активность различных цитокинов (ФНОα, ИФН-γ, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10). Кроме того, с помощью ПЦРдиагностики можно определить наличие вирусной ДНК или РНК в ткани миокарда, что свидетельствует о персистировании вируса в миокарде больного.
В последнее время стало возможным использование сцинтиграфии миокарда с различными изотопами и/или магниторезонансной томографии с контрастированием для подтверждения диагноза М.
Наиболее надежный метод – сканирование с моноклональными антителами к кардиомиозину, меченными In111 (чувствительность метода почти 100%, специфичность 60%). В качестве маркеров, тропных к воспалению, можно использовать Ga67, лейкоциты, меченные Тс99-ГМПАО.
Интересные результаты получены исследователями при использовании магнитной резонансной томографии с контрастом, избирательно накапливающимся в очаге воспаления.
Лечение и профилактика. В последние годы усилия клиницистов, иммунологов, патофизиологов, ученых многих других специальностей направлены на поиск эффективных этиотропных и патогенетически обоснованных методов лечения М.
Анализ результатов клинических исследований, посвященных разработке принципов лечения М, которые были проведены во многих странах мира с 1980 по июнь 1997 г., позволяет заключить Garg и соавт., что ни одна из использованных схем лечения (преднизолон,

* 173
преднизолон в сочетании с азатиоприном или циклоспорином, интерферон, гормоны тимуса) не приводила к улучшению сократимости миокарда и не повышала выживаемость пациентов с М. Одной из причин столь пессимистического вывода является отказ от этиотропной терапии. Другая причина состоит, очевидно, в чрезвычайной неоднородности групп наблюдавшихся пациентов и прежде всего в нозологическом отношении. Несмотря на это врачи и ученые не прекращают попыток разработать этиотропную и патогенетически обоснованную терапию и доказать ее эффективность [4].
Экспериментальные разработки последнего десятилетия внушают оптимизм в поиске новых методов воздействия на иммунную систему: показана возможность использования моноклональных антител к интерлейкину 2 и лимфоцитофереза; создан низкомолекулярный синтетический иммуноактивный препарат, названный FK-565, который уменьшает внутриклеточную репликацию вируса, активизирует механизмы макрофагальной защиты; весьма обнадеживающими выглядят предложения об использовании Th2-цитокинов; антител к поверхностным антигенам Т-лимфоцитов. Не прекращаются попытки поиска новых мощных иммунодепрессантов и возможность их использования у больных М. Так, совсем недавно появился препарат муромонаб, представляющий собой моноклональные антитела к рецептору лимфоцитов CD3 и оказывающий мощный иммуносупрессивный эффект.
Клиническая практика показывает, что применение нестероидных противовоспалительных средств (ортофен, вольтарен, диклофенак, аспирин и др.) и глюкокортикоидов (преднизолон) оказывает противовоспалительное и антиоксидантное действие: первые снижают содержание продуктов перекисного окисления липидов и повышают активность ферментов антиоксидантной защиты, вторые влияют преимущественно на активность каталазы - фермента, катализирующего разложение перекиси водорода с образованием кислорода и воды.
При тяжелом диффузном М, сопровождающемся кардиомегалией и застойной СН, а также осложнившимся перикардитом, при рецидивирующем течении М применяются кортикостероидные препараты. Дозы преднизолона не превышают 30–40 мг в сутки, препарат назначают обычно до 1,5–2 мес с постепенным снижением дозы вплоть до полной отмены и переходом на прием препаратов хинолинового ряда, противовоспалительных нестероидных средств.
В связи с важной патогенетической ролью при М биологически активных веществ – гистамина, адреналина, 5-окситриптамина, ки-

174 *
нинов – в комплекс лечения включают препараты с антибрадикининовыми свойствами: пармидин (ангинин, продектин), контрикал (трасилол).
Один из важнейших путей терапевтического воздействия на аутоиммунное воспаление – применение иммуномодуляторов. Поиски иммунокорригирующего влияния различных групп препаратов привели исследователей к обнаружению такого эффекта у амиодарона и пентоксифиллина.
Последнее десятилетие ознаменовалось широким использованием в лечении СН ингибиторов ангиотензинпревращающего фермента (капотена, эналаприла, лизиноприла и др.). Назначение препаратов особенно показано при выраженных признаках застойной СН, однако их использование требует тщательного титрования дозы изза опасности резкого снижения артериального давления. Начальные дозы обычно составляют для эналаприла 2,5 мг 1–2 раза в день.
Литература
1.Палеев Ф.Н. Миокардиты // Мед. помощь. – 2002. – № 6. – С.
3–9.
2.Палеев Н.Р., Гуревич М.А. Некоронарогенные заболевания миокарда. Состояние проблемы // Клин. мед. – 1998. – Т. 76, №9. – С. 4–8.
3.Huber S.A., Kupperman J., Newell M.K. Hormonal regulation of CD4(+) T-cell responses in coxsackievirus B3-induced myocarditis in mice // J. Virol. – 1999. – V. 73, №6. – P. 4689–4695.
4.Hufnagel G., Pankuweit S., Richter A. et al. The european study of epidemiology and treatment of cardiac inflammatory diseases (ESETCID) // Herz. – 2000. – V. 25, №3. – P. 279–285.
5.Maisch B., Portig I., Ristic A. et al. Definition of inflammatory cardiomyopathy (myocarditis): on the way to consensus // Herz. – 2000. – V. 25, №3. – P. 200–209.

* 175
ЗНАЧЕНИЕ ЭНДОСКОПИЧЕСКОГО МЕТОДА В РАННЕЙ ДИАГНОСТИКЕ И ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ У КАРДИОЛОГИЧЕСКИХ БОЛЬНЫХ
Е.Ю. Патока
Важнейшей ступенью в лечении больных с хирургической патологией сердца и сосудов является предоперационная подготовка, которая во многом определяет непосредственные результаты операции, а так же последующее качество жизни пациентов. Большинство открытых оперативных вмешательств на сердце выполняется с использованием искусственного кровообращения (ИК). По данным многих исследователей [4–6] ИК и гипотермия оказывают масштабное воздействие на все органы и системы и сопровождаются глубокой иммунодепрессией. A.J. Voets и соавт. [2] в 1997 г. провели анализ частоты метастазирования рака легкого у 121 пациента после открытых операций на коронарных артериях и последующей резекции легкого. Авторы подчеркивают высокий операционный риск у больных с сочетанной патологией коронарных артерий и опухолями легких и указывают на повышение метастазирования рака в отдаленном послеоперационном периоде. Необходимость своевременного диагностирования и хирургического лечения злокачественных опухолей у кардиологических больных подчеркивают в своих работах многие хирурги [2,3]. По мнению H. Hirose и соавт. (2000) операции на открытом сердце с применением ИК у пациентов с уже установленным ранее диагнозом рака оправданы только в случае жизненных показаний, таких как угроза инфаркта миокарда и др. В связи с этим повышается необходимость тщательного онкологического поиска у пациентов с хирургической патологией сердца, неотъемлемой частью которого является эндоскопический метод. Сегодняшняя электронная эра в истории развития гибкой эндоскопии явилась прорывом на пути к усовершенствованию диагностики предопухолевых и ранних опухолевых изменений слизистой оболочки различных органов – желудка, бронхиального дерева, ЛОР-орга- нов, органов урогенитального тракта и толстой кишки. Современные цифровые видеоэндоскопические системы позволяют производить тщательный осмотр слизистой оболочки с использованием функции структурной детализации, проявляющей контуры новообразования, вплоть до многократного увеличения изображения без потери его четкости. Для уточнения полученных макроскопических данных на помощь врачу приходят такие дополнительные эндоскопические

176 *
методики, как хромоэндоскопия, эндосонография, эндоскопия с увеличением, оптическая когерентная томография, флюоресцентная диагностика и другие методы.
Сегодня клиницисты располагают широкими возможностями не только в высококвалифицированной диагностике ранних опухолей полых органов, но и методами их щадящего эндоскопического удаления. Это особенно важно для пациентов с высоким операционным риском.
Первые сообщения о применении витальных красителей для диагностики злокачественных новообразований относятся к 1933 г., когда Schiller применил 5% раствор Люголя для определения ранней стадии рака шейки матки. Методику эндоскопического распыления метиленового синего в желудке впервые в 1967 г. описал Tsuda. В настоящее время хромоэндоскопический метод широко используется для выявления изменений слизистой оболочки желудочно-ки- шечного тракта, определения их границ и структурных особенностей. Наиболее часто для диагностики предраковых и ранних злокачественных изменений слизистых используются растворы индигокармина, Люголя, метиленового синего.
Раствор Люголя (1–4%) применяют для окрашивания слизистой оболочки пищевода (рис. 1, цв. вклейка). Нормальный эпителий пищевода содержит гликоген, который вступает в реакцию с йодом и окрашивается в темно-коричневый цвет. Патологически измененная
ине содержащая гликоген слизистая оболочка пищевода (эрозии, участки кишечной метаплазии, ранний рак) в реакцию не вступает
ипоэтому остается неокрашенной. Метод является неспецифическим, но особенно эффективен для диагностики пищевода Баррета, при котором на фоне длительного гастроэзофагеального рефлюкса происходит замещение нормального многослойного плоского эпителия дистальной части пищевода на цилиндрический эпителий желудка, тонкой или толстой кишки [1]. В дальнейшем возможно прогрессирование патологического процесса с развитием среднетяжелой, тяжелой дисплазии и аденокарциномы [1]. Риск развития злокачественной трансформации при пищеводе Баррета по данным разных авторов составляет от 5 до 50%. [1] Окрашивание раствором Люголя позволяет увеличить чувствительность, специфичность, и точность эндоскопического исследования пациентов с подозрением на ранний рак и пищевод Баррета на 89, 93 и 91%, соответственно.
Раствор метиленового синего (0,5%), напротив, избирательно окрашивает цилиндрический эпителий и, таким образом, с помощью окраски этим раствором можно диагностировать наличие очагов ки-

* 177
шечной метаплазии в желудке (рис. 2, цв. вклейка) и при пищеводе Баррета. Эффективность диагностики увеличивается при применении сочетанной хромоскопии – растворов Люголя и затем метиленового синего, особенно у пациентов с очень короткими сегментами поражения, которые не обнаруживаются при обычном осмотре. Для визуализации минимальных изменений в дистальном отделе пищевода М. Guelrud и другие использовали 1–1,5% уксусную кислоту. Способ основан на том, что уксусная кислота вызывает выраженную гиперемию интестинального эпителия, оставляя плоскоклеточный эпителий пищевода интактным. Авторы указывают на высокую эффективность метода в сочетании с магнификационной эндоскопией (эндоскопией с увеличением), которая выполняется с помощью специального оборудования. Видеоэндоскопы с встроенным дополнительным оптическим блоком увеличивают изображение в 120–150 раз без потери его качества (рис. 3, цв. вклейка), что делает возможным различать мельчайшие детали структуры слизистой и позволяет проводить по существу in vivo в уже окрашенных участках исследование, близкое к микроскопическому. Однако, в связи с высокой стоимостью магнификационных эндоскопов и, следовательно, недоступностью для большинства медицинских учреждений, этот метод пока не нашел широкого применения.
Для контрастной хромоскопии широко используется индигокармин. Метод основан на том, что раствор индигокармина не окрашивает ткани, а лишь подчеркивает их естественную или патологическую рельефность. Он используется для диагностики различных заболеваний пищевода, желудка (ранний рак – рис. 4, цв. вклейка, эрозивные поражения слизистой оболочки), тонкой и толстой кишок (атрофия при синдроме мальабсорбции, полипы, злокачественные новообразования и т.д).
Большое значение в разработке методов раннего выявления рака принадлежит флюоресцентной (фотодинамической) диагностике, с помощью которой можно обнаружить невидимые глазом изменения слизистой оболочки по характерному свечению (флюоресценции). Метод основан на возможности распознавания злокачественных новообразований по индуцированной световым излучением характерной флюоресценции эндогенных (аутофлюоресценция) или экзогенных порфиринов, концентрация которых в малигнизированной ткани в 2–4 раза выше, чем в здоровой.
Для усилеия эффекта флюоресценции используются различные фотосенсибилизаторы – Фотофрин I и II, Фотосан, Фотогем. К недостаткам в их использовании относятся: низкое поглощение в крас-
178 *
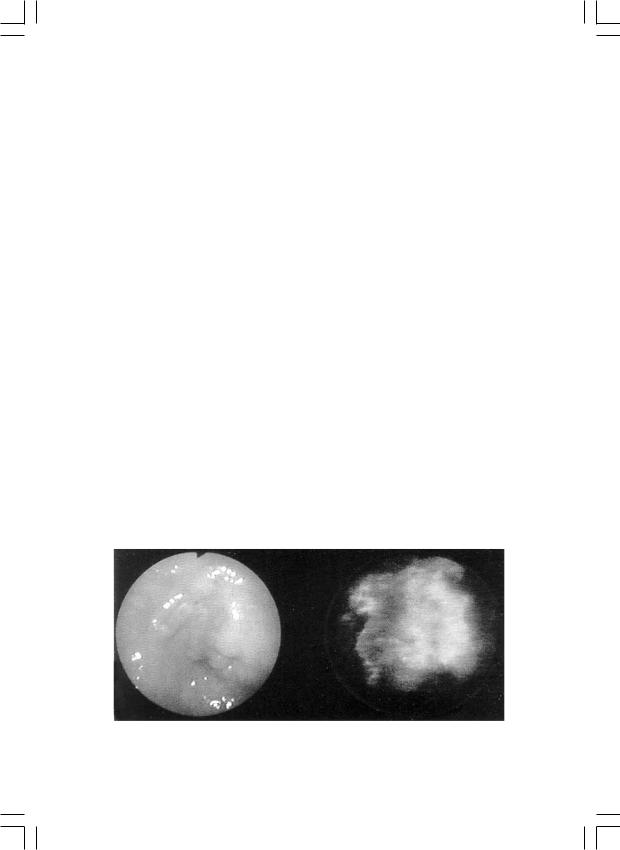
ной области спектра; низкая интенсивность и контрастность флюоресценции, что затрудняет диагностику; замедленное выведение из организма, обусловливающее высокую фототоксичность. 5-аминоле- вулиновая кислота и отечественный препарат на ее основе (Аласенс), не являясь сама фотосенсибилизатором, при введении в организм приводит к стимуляции образования эндогенного протопорфирина IX, накопление которого в опухоли происходит быстро с высокой контрастностью флюоресценции по отношению к нормальным тканям, что характеризует высокую диагностическую эффективность метода, при этом фототоксические реакции редки ввиду быстрого метаболизма 5-аминолевулиновой кислоты. Исследования проводят с помощью спектроанализаторов и результаты регистрируют в спектральном виде или в виде видеофлюоресцентного изображения (рис. 5, цв. вклейка, рис. 6).
Однако при всей своей чувствительности флюоресцентный и хромоскопический методы не всегда могут помочь врачу в правильной интерпретации макроскопической картины. Так, например, эндоскопически сложно оценить патологические изменения в подслизистых слоях органов желудочно-кишечного тракта, трудно иногда однозначно расценивать перибронхиальные изменения центральных бронхов и однозначно судить о косвенных признаках регионарного метастазирования. Неоценимую помощь эндоскописту в определении истинной природы опухолей и последующей тактики ведения пациента оказывает эндосонография. Исследование проводят специальным эндоскопом, имеющем на дистальном конце ультразвуковой (УЗ) датчик, или проводят специальный УЗ-зонд в инструментальный канал эндоскопа. Этот метод позволяет определять глубину инвазии опухолей
Рнс. 6. Эндоскопическая и видеофлюоресцентная картина рака выходного отдела желудка.
* 179
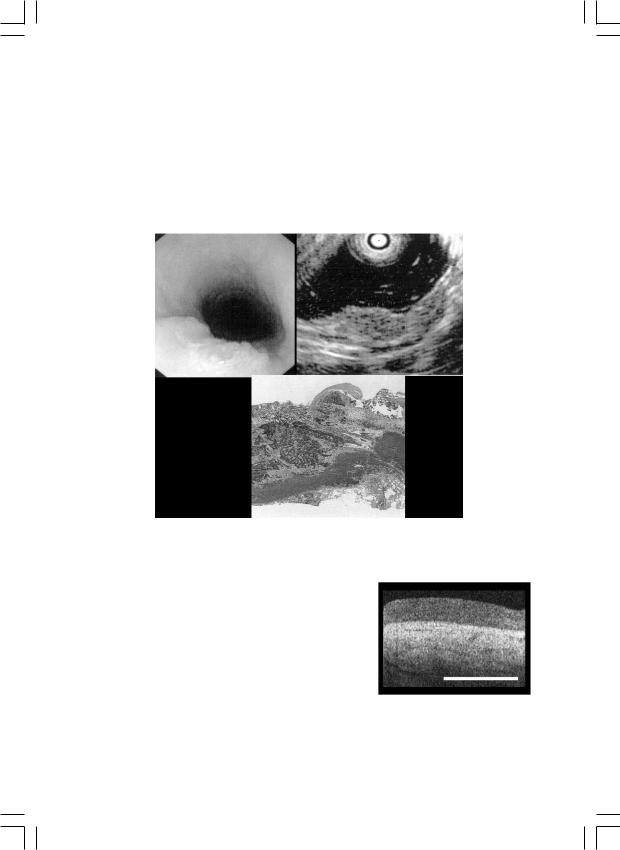
(рис. 7), выявлять регионарные метастазы, производить пункционную биопсию под УЗ-контролем и определять не только Т-стадию, но и N-cтадию распространения опухоли (по международной ТNM-клас- сификации). По данным разных авторов чувствительность метода в диагностике подслизистых и ранних опухолей желудочно-кишечного тракта и медиастинальной лимфоаденопатии (в сочетании с пункцией под УЗ-контролем) приближается к 100%.
Рис. 7. Эндоскопическая, эндосонографическая и морфологическая картина ранней карциномы пищевода.
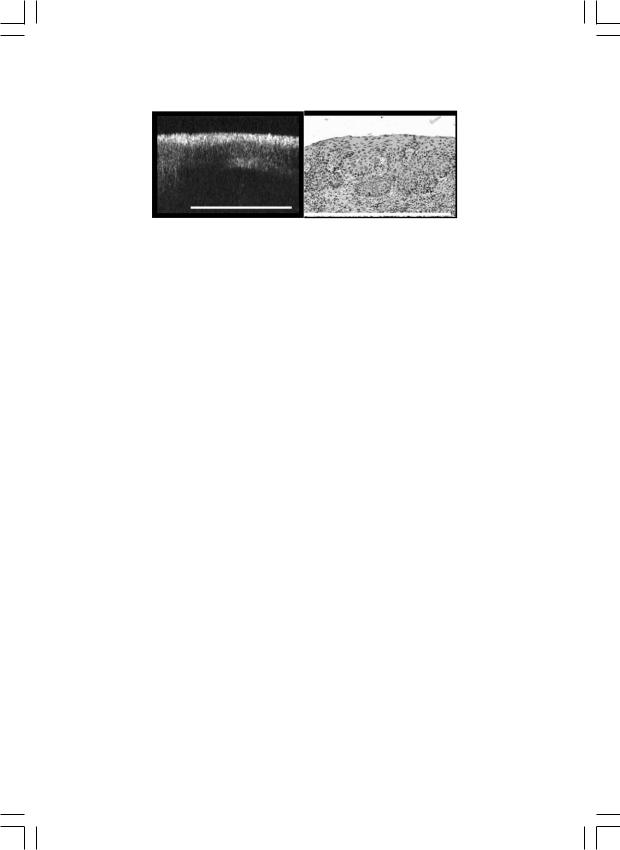
В середине 90-х годов появился новый метод исследования минимальных поверхностных изменений различных органов – оптическая когерентная томография (ОКТ). Исследование проводится с помощью оптического томографа, имеющего высокое пространственное разрешение и позволяющего получать информацию о внутренней структуре тканей на уровне тканевых слоев, нарушение расположения которых является критерием патологии (рис. 8, 9). Специальный сканирующий
Рис. 8. Оптическая когерентная томограмма гиперплазии слизистой оболочки шейки матки.
180 *
Рис. 9. Оптическая когерентная томограмма и морфограмма микроинвазивной карциномы слизистой оболочки шейки матки.
минизонд вводится в инструментальный канал эндоскопа. К недостаткам методики несомненно относятся трудности при выполнении сканирования in vivo (следует удерживать зонд в одной точке не менее 10 с) и небольшая глубина проникновения (до 1 мм). Однако, неоспоримы преимущества этого метода в витальной диагностике carcinoma in situ.
Большое значение для последующего лечения больного имеет диагностика Helicobacter pylori. Известно, что его длительная персистенция на слизистой желудочно-кишечного тракта вызывает не только ее деструктивные изменения (эрозивно-язвенные поражения) но и является важнейшим фактором патогенеза лимфомы желудка низкой степени злокачественности (MALTлимфомы) и рака желудка. К методам диагностики инфекции относятся бактериологический, морфологический, серологический, хромоэндоскопический
спомощью раствора фенола красного, уреазный тест. Последний очень удобен для быстрой эндоскопической диагностики: биоптат слизистой антрального отдела желудка помещают на специальный минидиск и по его окрашиванию через 1–2 мин судят о наличии инфекции Helicobacter pylori.
Современное состояние медицинской науки и техники помимо широких возможностей дифференциальной диагностики ранних опухолей позволяет эндоскописту проводить их лечение по соответствующим показаниям. К эндоскопическим методам удаления опухолей относятся такие физические методы, как деструкция опухоли
спомощью высокоинтенсивных лазеров (ND:YAG, СО2- и СО-лазе- ров,), аргонплазменной коагуляции, диатермокоагуляции.
Основным недостатком различных методов деструкции является полное разрушение опухоли в ходе лечения, и, следовательно, невозможность адекватной тотальной морфологической оценки макропрепарата, а также разрушение в ходе деструкции и здоровой ткани. К преимуществам относится возможность применения этого

* 181
метода к опухолям большого диаметра, для реканализации полых органов.
К фотофизическим методам относится фотодинамическая терапия (ФДТ). Это сравнительно новый перспективный метод лечения злокачественных новообразований, основанный на сочетании фототоксического эффекта препарата (токсического действия фотосенсибилизатора на клетку при его взаимодействии со светом) с его накоплением преимущественно в опухолевой ткани. Некротические изменения в опухоли в результате ФДТ обусловлены как ее воздействием на сосуды, так и непосредственно на клетки опухоли. Сосудистое действие ФДТ проявляется спазмом артерий, тромбозом артериол и венул, периваскулярным отеком тканей, что приводит к нарушению кровообращения в опухоли. При ФДТ происходит и стимуляция иммунной системы. Так Yamamoto (1991) выявил стимуляцию фагоцитарной активности макрофагов, а Canty G. и соавт. отметили формирование специфического гуморального противоопухолевого иммунитета после ФДТ с использованием дисульфированного фталоцианина алюминия в качестве фотосенсибилизатора. С помощью ФДТ успешно лечат ранние новообразования различных локализаций, таких как бронхиальное дерево, желудочно-кишеч- ный тракт, ЛОР-органы и др.
Из всех перечисленных эндоскопических методов лечения рака ранней стадии наиболее перспективным (при локализации опухоли
вжелудочно-кишечном тракте) несомненно является эндоскопическая резекция слизистой оболочки (ЭРС). Показаниями к выполнению ЭРС являются необходимость выполнения тотальной биопсии при подозрении на малигнизацию доброкачественных новообразований, а также ранний рак, размером от 1 до 2 см (в зависимости от макроскопического типа опухоли по классификации раннего рака желудка, предложенной Японским обществом эндоскопистов в 1962 г.), имеющий гистологически интестинальный тип без регионарного метастазирования (по данным эндосонографии). Операцию выполняют
вусловиях седации под местной анестезией у соматически тяжелых больных. По данным многих отечественных и зарубежных хирургов (Чиссов В.И. и соавт., 1992; Bralow S. Philip, 1998; Yoshida S., 1996, и др.) ЭРС раннего рака желудка дает надежные отдаленные результаты, сравнимые с результатами хирургического лечения. При тщательной эндоскопической диагностике ранних опухолей пищевода и желудка радикальное удаление удается произвести в 90% случаев, 5-летняя выживаемость после ЭРС равна 86% (при хирургическом лечении – 83%). Частота рецидивов опухолей после ЭРС в
