
Шевченко Ю.Л. - Актуальные вопросы грудной хирургии
.pdf
182 *
пищеводе и желудке 3–7%. Неоспоримым преимуществом ЭРС является удаление большого массива слизистой оболочки и возможность его последующего послойного морфологического изучения, что во многом определяет дальнейшую тактику лечения больного.
В Клинике НИИ грудной хирургии Московской медицинской академии им. И.М. Сеченова проводятся около 1800 эндоскопических исследований в год. У всех пациентов с патологией сердца перед выполнением оперативного вмешательства проводится тщательный онкопоиск с применением методов хромоэндоскопии, флюоресцентной диагностики, экспресс-тестирования на присутствие Helicobacter pylori, по показаниям выполняется эндосонография. За прошедший год в клинике выявлено: ранних опухолей желудка – 3, ранних опухолей бронхов – 2, ранних опухолей гортани – 3, предопухолевых состояний слизистой пищевода (в том числе пищевод Баррета)
– 18. Интересной иллюстрацией возможностей эндоскописта в дифференциальной диагностике и лечении раннего рака желудка может послужить следующее наблюдение.
Пациент Б., 69 лет, поступил в клинику 05.10.02 для решения вопроса об оперативном лечении с диагнозом: ИБС; стенокардия напряжения, IV ФК; атеросклероз аорты и коронарных артерий; атеросклеротический и постинфарктный (1985) кардиосклероз; гипертоническая болезнь IIа стадии; недостаточность кровообращения I стадии; облитерирующий атеросклероз артерий нижних конечностей; хронический бронхит.
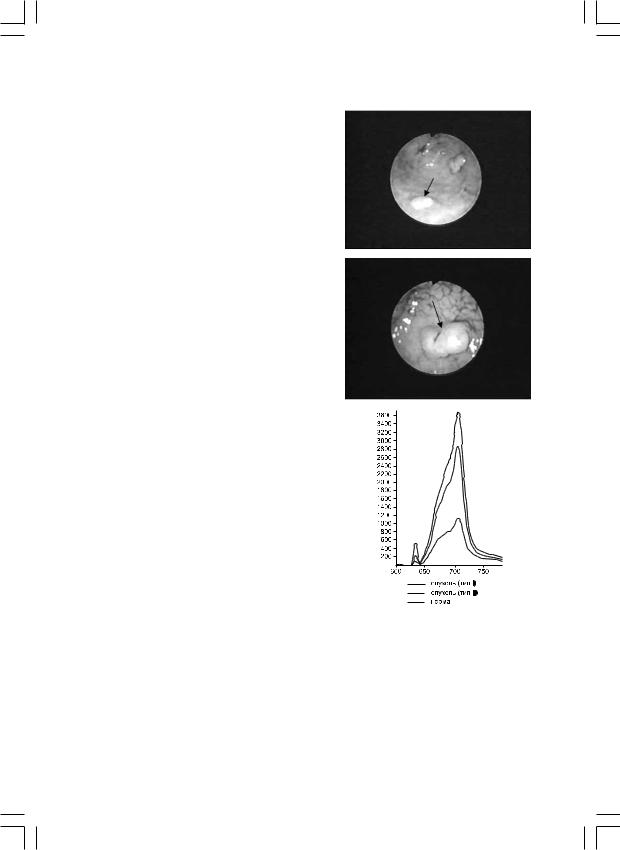
Из протокола диагностической фибробронхоскопии: в области устья верхушечного сегментарного бронха нижней доли правого легкого обнаруживается экзофитное образование округлой формы до 1 см в диаметре с гладкой слизистой на поверхности (рис. 10а, цв. вклейка). При взятии биопсии – слизистая эластична, новообразование подвижно. Заключение: эндоскопическая картина доброкачественного новообразования устья верхушечного сегментарного бронха нижней доли правого легкого (аденома? полип?). Проведена флюоресцентная бронхоскопия с препаратом Аласенс. Уровень флюоресценции над новообразованием сравним с таковым над здоровыми бронхами (рис. 10б, цв. вклейка) – новообразование доброкачественное.
При диагностической эзофагогастродуоденоскопии: на границе нижней трети тела и антрального отдела желудка обнаруживаются 2 новообразования овальной формы. Для уточнения границ, размеров и формы новообразований выполнено окрашивание слизистой оболочки желудка раствором 0,4% индигокармина. После окрашивания (рис. 11): новообразование антрального отдела желудка по большой кривизне имеет размеры до 1,5 см, четкие контуры, уплощенную форму (указан стрелкой). По задней стенке (рис. 12) – экзофитное новообразование размером 2 см, имеет овальную форму, четкие контуры, но неровную поверхность (указан стрелкой). При создании инъекционной подушки (под основанием опухолей введен физиологический раствор) оба новообразования отходят от стенки желудка (глубина инвазии может быть ограничена слизистым слоем стенки желудка), при выполнении ступенчатой биопсии слизистая оболочка не фрагментируется. Проведе-
* 183
но флюоресцентное исследование опухолей |
|
|
с предварительной фотосенсибилизацией пре- |
|
|
паратом Аласенс, над обоими новообразова- |
|
|
ниями зарегистрированы высокие цифры |
|
|
флюоресценции по сравнению с неизменен- |
|
|
ной слизистой желудка (рис. 13а) – оба но- |
|
|
вообразования подозрительны в отношении |
|
|
малигнизации. По данным морфологического |
|
|
исследования биоптатов: 2 очага аденома- |
|
|
тозной ткани с выраженной дисплазией эпи- |
|
|
телия (III–IV ст.) в поверхностных слоях на |
|
|
фоне кишечной метаплазии. С целью выпол- |
|
|
нения тотальной биопсии обеих опухолей ан- |
|
|
трального отдела желудка решено провести |
|
|
одномоментную эндоскопическую резекцию |
|
|
слизистой оболочки в области обоих ново- |
|
|
образований. Новообразование устья вер- |
|
|
хушечного сегментарного бронха нижней |
|
|
доли правого легкого также решено удалить |
|
|
эндоскопически. |
|
|
За 5 суток до проведения операций от- |
|
|
менена антиагрегантная терапия до стаби- |
|
|
лизации коагулологических показателей кро- |
|
|
ви. В условиях седации под местной |
|
|
анестезией проведено удаление обеих опу- |
|
|
холей желудка CAP-методом до мышечного |
|
|
слоя (рис. 13б, цв. вклейка). По результатам |
|
|
патоморфологического исследования макро- |
|
|
препарата (консультация в 2 специализиро- |
|
|
ванных онкологических учреждениях): 2 очага |
|
|
высокодифференцированной аденокарцино- |
|
|
мы в пределах слизистого слоя (малый рак), |
|
|
по краю резекции опухолевых клеток нет. |
|
|
Удаление новообразования устья верхушеч- |
|
|
ного сегментарного бронха нижней доли пра- |
|
|
вого легкого (морфологическое исследование |
|
|
– фиброзный воспалительный полип) также |
|
|
проведено под местной анестезией в услови- |
|
|
ях седации. Через 50 суток выполнена конт- |
Рис. 11, 12, 13а. Эндоскопическая и |
|
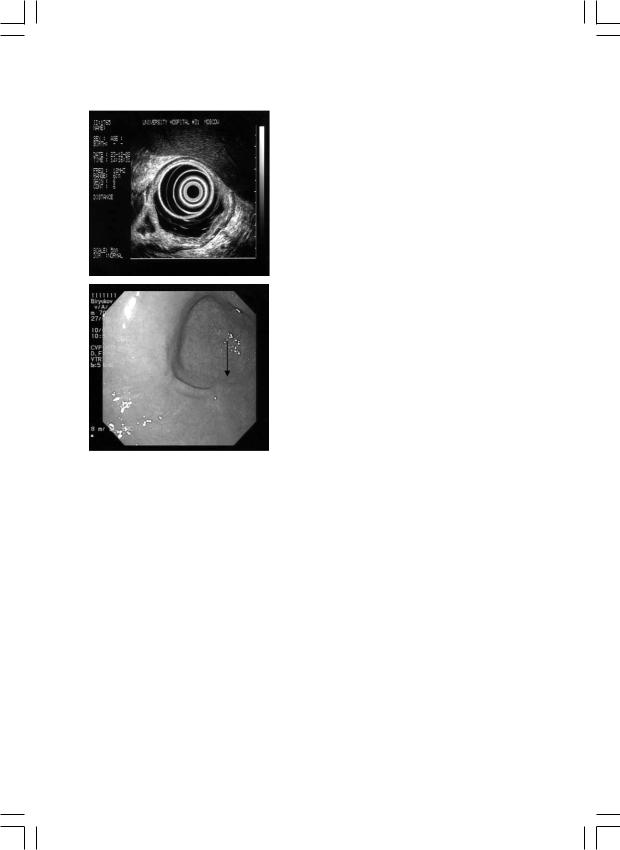
рольная ЭГДС, эндосонография (рис. 14) и фиб- |
||
робронхоскопия. ЭГДС: при контрольном |
флюоресценная картина первично- |
|
множественного синхронного рака |
||
осмотре в области удаленных новообразова- |
||
антрального отдела желудка (тип |
||
ний видны 2 звездчатых рубца (рис. 15). Зак- |
||
I и тип IIb). |
||
лючение: состояние после одномоментной |
||
|
мультифокусной эндоскопической резекции слизистой оболочки желудка по поводу первично-множественного синхронного
раннего рака (тип I и тип IIb). При контрольной биопсии из рубцов – элементов опухоли не обнаружено. Эндосонография: эхоэндоскоп GF-UM 20 свободно прове-
184 |
* |
|
|
|
ден в пищевод, затем в желудок. Выполнено |
|
|
сканирование стенок желудка и перигастраль- |
|
|
ного пространства. Стенка желудка на всем |
|
|
протяжении равномерно 5–7-слойная. В ант- |
|
|
ральном отделе по задней стенке, ближе к |
|
|
большой кривизне, отмечается утолщение |
|
|
слизистой до 2,5 мм, контуры ее ровные чет- |
|
|
кие, эхогенность однородно понижена (пери- |
|
|
фокальное воспаление). В данной области в |
|
|
двух местах отмечаются 2 углубления в сли- |
|
|
зистой с гиперэхогенным контуром, размерами |
|
|
до 3–4 мм (рубцовые структуры). Патологи- |
|
|
чески увеличенных и измененных перигаст- |
|
|
ральных лимфоузлов не отмечается. Заклю- |
|
|
чение: состояние после эндоскопической |
|
|
резекции слизистой антрального отдела же- |
|
|
лудка. Эхографические признаки локального |
|
|
воспалительного процесса в области зоны уда- |
|
|
ления образований. |
|
|
Фибробронхоскопия: устье верхушечного |
|
|
сегментарного бронха нижней доли правого |
|
|
легкого покрыто неизмененной слизистой обо- |
|
|
лочкой, визуализируются свободные устья |
|
|
субсегментарных бронхов (рис. 10в, цв. вклей- |
|
|
ка). |
|
|
При контрольной гастроскопии через 6 мес |
Рис. 14, 15. Эндосонографическая |
данных за рецидив опухолей нет, в биопта- |
|
и эндоскопическая картина антраль- |
тах из области рубцов элементов опухоли не |
|
ного отдела желудка через 8 меся- |
обнаружено. |
|
цев |
после эндоскопической резек- |
Таким образом, эндоскопист в от- |
ции слизистой оболочки желудка. |
делении кардиохирургии не только |
|
|
|
|
имеет уникальную возможность проведения скрининга по выявлению ранних злокачественных новообразований различных локализаций вплоть до определения глубины инвазии опухолей, выявления регионарного метастазирования и предположения гистопринадлежности, но и возможность радикального их удаления, освобождая дорогу для выполнения кардиохирургического вмешательства.
Литература
1.Аруин Л.И., Золоторевский В.Б., Франк Г.А. и др. Дисплазия и рак: метод. рекомендации, М., 1987.
2.Voets A.J., Joesoef K.S., van Teeffelen M.E. The influence of open-heart surgery on survival of patients with co-existent surgically

* 185
amenable lung cancer (stages I and II) // Eur. J. Cardiothorac. Surg. 1997. – №12. – P. 898–902.
3.Suehiro S., Kinoshita H., Higashino M. et al. Surgical treatment for cardiac diseases in patients with concomitant malignant tumor. Kyobu Geka 1994. – V. 47. – P. 175–178; discussion 179–181.
4.Sasaki T. The immune response following open-heart surgery. The immune response following open-heart surgery. Nippon Kyobu Geka Gakkai Zasshi 1989. – V. 37. – P. 1297–305.
5.Pasetto A., Gilli E., Rigotti L. et al. Effects of extracorporeal circulation and hypothermia on cellular immune activity in patients undergoing heart surgery. Minerva Anestesiol. 1989. – V. 55. – P. 289– 294.
6.Ben-Eliyahu S., Shakhar G., Rosenne E. et al. Hypothermia in barbiturate-anesthetized rats suppresses natural killer cell activity and compromises resistance to tumor metastasis: a role for adrenergic mechanisms // Anesthesiology. 1999. – V. 91. – P. 732–740.
ЗАКРЫТАЯ МИТРАЛЬНАЯ КОМИССУРОТОМИЯ В ЛЕЧЕНИИ МИТРАЛЬНОГО СТЕНОЗА. СОВРЕМЕННЫЙ ВЗГЛЯД
НА ПРОБЛЕМУ
Л.В. Попов
Закрытая митральная комиссуротомия (ЗМК) применяется уже более 50 лет. Операция получила признание и широкое распространение во многих странах мира. C. Bailey в 1948 г. успешно выполнил пальцевую ЗМК через ушко левого предсердия (ЛП). В СССР
приоритет внедрения метода пальцевой ЗМК через ушко ЛП принадлежит А.Н. Бакулеву (1952). C. Dubost и соавт. (1954) предложили метод инструментальной ЗМК с помощью двухлопастного жесткого дилататора через ушко ЛП. Введение дилататора, установка его в митральное отверстие (МО) и последующее разделение комиссур производились вслепую. Стремление к контролируемой ЗМК привело хирургов к чресжелудочковому проведению дилататора в МО под контролем пальца, находящегося в ЛП. Пионером чресжелудочковой ЗМК является A. Logan (1954). К.В. Лапкиным был разработан и успешно применен в клинической практике для чреспредсердной ЗМК дилататор на гибком троссе, результаты применения которого нашли свое отражение в его докторской диссертации [4]. В

186 *
целях повышения радикальности ЗМК, а также в порядке разработки оперативного доступа при рестенозах C. Bailey и W. Neptune (1954) предложили правосторонний оперативный доступ к сердцу и через расслоенную межпредсердную перегородку – к митральному клапану (МК).
Появление метода искусственного кровообращения (ИК) позволило перейти к открытым методикам коррекции митрального порока, что оказалось особенно важным при осложненных формах. Этому также способствовало внедрение различных видов искусственных клапанных протезов. Со временем многие кардиохирургические центры значительно уменьшили количество операций, а ряд центров полностью отказались от выполнения ЗМК, отдавая предпочтение открытой коррекции порока. В России за последние годы также отмечается дальнейшее снижение количества выполняемых ЗМК в хирургии приобретенных пороков сердца: 18,4% в 1998 г., 13,8% в 1999 г., 11,8% в 2000 г., 8,2% в 2001 г., 6,0% в 2002 г. [1]. Баллонную вальвулопластику по-прежнему в небольшом объеме выполняет ограниченный круг клиник (42 операции в 2000 г., 40 – в 2001 г., 21 – в 2002 г.).
Чем же объяснить снижение внимания к операции, которая долгие годы была в арсенале практически всех кардиохирургических клиник и помогла многим пациентам? Противники данной операции объясняли это тем, что ЗМК выполняется вслепую, при этом отсутствуют четкие критерии адекватности выполненного вмешательства. Авторы рекомендовали открытую коррекцию порока при любых формах осложненного стеноза. При этом к осложненным формам относили кальциноз или фиброз МК, выраженные подклапанные сращения, внутрипредсердный тромбоз или подозрение на него, рестеноз, впервые возникшую или преходящую мерцательную аритмию, сочетанные пороки сердца. Практически авторы оставляли возможность выполнения ЗМК в случаях «чистого» стеноза, синусовом ритме и неизмененном клапанном аппарате. Однако на практике процент этих больных минимален. Как правило, имеет место выраженный фиброз створок, кальциноз, мерцательная аритмия, сочетанные пороки сердца и т.п. Кроме того, оценка непосредственных результатов ЗМК затруднена в случаях c выраженными вторичными изменениями внутренних органов, особенно малого круга кровообращения. Обратимость клинических симптомов при этом может быть слабо выражена в раннем послеоперационном периоде и наблюдается в более поздний период.
Вопросы оценки результатов ЗМК давно разрабатываются хирургами. Являясь сторонниками данной операции, мы хотели еще

* 187
раз, с учетом опыта и анализа как ранних, так и отдаленных результатов, рассмотреть вопрос адекватности и правомочности выполнения ЗМК на современном этапе развития кардиохирургии. Также хотим коснуться критериев интраоперационной оценки эффективности операции.
В качестве методов исследования применялись данные дооперационной и послеоперационной трансторакальной эхокардиографии (ЭхоКГ), интраоперационной (ИО) пальцевой ревизии, ИО манометрии левых камер сердца до- и после ЗМК, ИО чреспищеводной (ЧП) ЭхоКГ. Стандартная схема обследования включала в себя ЭКГ, рентгенографию сердца в 3 проекциях.
Обсуждение. При анализе непосредственных результатов ЗМК во время операции мы (как и другие хирурги) оценивали показатели радикальности разделения комиссур по данным пальцевой ревизии, частоту монокомиссуротомий, появление или усиление митральной регургитации, разделение подклапанных сращений, осложнения. Такой показатель, как степень разделения комиссур и подвижность створок при пальцевой ревизии МО, давно используется кардиохирургами, как основной критерий оценки результатов ЗМК. При этом большинство из них оценивают ЗМК как полную в случае увеличения размеров МО до 3,5×1,5 см и больше. В то же время, как отмечают многие авторы, пальцевая ревизия является субъективным критерием оценки размеров МО, т.к. зависит от величины ногтевой фаланги хирурга и его индивидуальной чувствительности, что дает большой разброс значений. Проведенные измерения размеров указательного пальца в группе оперирующих хирургов показали, что площадь поперечного сечения пальца на уровне 1 фаланги, как правило, составляет не менее 1,5 см2. Хирург оценивает размеры МО по наименьшему размеру, которым в случае выраженного стеноза является межстворочный. Поэтому если палец хирурга не проходит через МО, то трудно оценить в данном случае межкомиссуральный диаметр. Оценка же показателя площади МО пальцем еще более затруднительна. По-видимому, эти причины и легли в основу разработанных на ранних этапах развития кардиохирургии многочисленных классификаций митрального стеноза, в которых приводятся заниженные значения площади МО. Так, например, по некоторым классификациям к группе больных с резким митральным стенозом относили больных с диаметром МО 0,3–0,6 см. Если использовать эти значения для расчета площади круга, то площадь МО составит менее 0,3 см2. Чтобы обеспечить необходимый для жизнедеятельности кровоток при такой степени
188 *
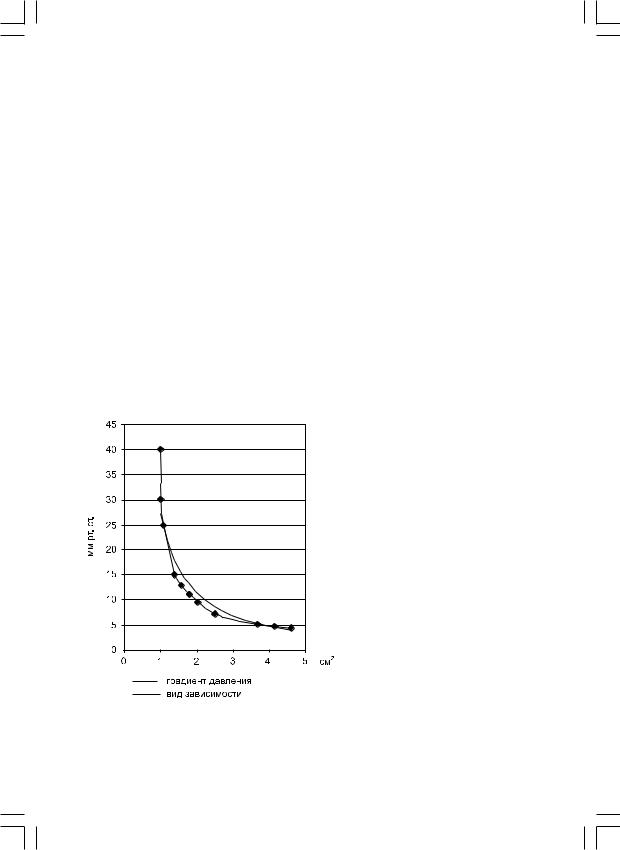
стеноза, необходимо чтобы давление в ЛП было не ниже 50 мм рт. ст. Осмотическое давление плазмы составляет около 40 мм рт. ст., поэтому повышение давления в ЛП выше этих значений приведет к отеку легких. Согласно теории «критического» сужения для МО данный показатель равен 1,5 см2, при достижении которого наступает декомпенсация кровообращения. На основании данных многочисленных ЭхоКГ исследований в сопоставлении с ИО данными (в случаях открытой коррекции порока) мы склонны считать, что предельным критическим сужением МО является площадь около 1,0 см2 [5]. По данным двухмерной ЭхоКГ мы не зафиксировали значений площади МО менее 1,0 см2. Именно в группе больных с «критическими» значениями митрального стеноза отмечались максимальные значения диастолического градиента давления (ГД) до 25–30 мм рт. ст. Зависимость между двумя указанными признаками носит не линейный характер, а представлена в виде гиперболической кривой (обратной гиперболической функции), на которой по мере уменьшения площади МО наблюдается постепенное повышение диастолического ГД до максимальных значений (рис. 1).
Рис. 1. Кривая зависимости показателей дав- |
ления в левом предсердии и площади митраль- |
ного отверстия. |
На уровне значений площади МО около 1,0 см2 кривая имеет практически вертикальный вид.
При оценке непосредственных результатов оперативного вмешательства, помимо указанных основных критериев (радикальность ЗМК; полнота разделения комиссур и подклапанных сращений, возникновение или усиление регургитации) многими авторами учитывались показатели давления в ЛП и легочной артерии (ЛА), динамика диастолического ГД на МК.
Проведенные исследования и сопоставление средних величин давления в ЛП до и после ЗМК показали, что наблюдается определен-

* 189
ная зависимость между величиной снижения давления в ЛП и увеличением размеров МО. Особенно показательным после устранения митрального стеноза, было уменьшение ГД между ЛП и левым желудочком (ЛЖ). В случае успешной ЗМК происходило значительное снижение давления в ЛП, наряду с которым отмечается уменьшение давления и в ЛА, однако последнее менее выражено.
Так как мы выполняем ЗМК из правостороннего доступа, то в своей практике мы, как правило, применяем контроль за эффективностью ЗМК путем манометрии ЛП и ЛА. В большинстве случаев мы также отмечали сопоставимые показатели между эффективным устранением митрального стеноза и снижением давления в ЛП. Однако в части случаев при адекватном со стороны хирурга устранении сращений, не отмечалось значительной динамики давления в ЛП. Надо также учитывать то, что получаемые на мониторе кривые давления в ЛП очень условно отражают наличие и динамику регургитации на клапане. Увеличение v-волны может быть не признаком повышения притока крови в ЛП за счет митральной недостаточности, а отражать индивидуальные особенности взаимодействия между объемом притекающей крови и упруго-эластическими свойствами стенок ЛП. Как правило, левопредсердная кривая отражает появление выраженной регургитации на клапане появлением однонаправленной волны совпадающей с волной выброса ЛЖ.
Анализируя отсутствие значительной динамики показателей давления в ЛП у части больных, мы склонны связывать, с его «детренированностью» при митральном стенозе, определенной неподготовленностью ЛЖ при устранении стеноза к резкому увеличению объема наполнения. И здесь необходимо определенное время, в течение которого происходит перестройка работы ЛЖ. Об этом свидетельствуют результаты оценки клинических симптомов в динамике и оценка послеоперационных ЭхоКГ данных в ранние и отдаленные сроки. Клиническое улучшение и уменьшение симптомов нарушения кровообращения по степени одышки, самочувствия больных, общему соматическому статусу, переносимости физической нагрузки, показателям функции внешнего дыхания и кровообращения, степени обратимости субъективных и объективных симптомов порока, происходит только через несколько месяцев.
Методика ИО ЧП ЭхоКГ является важным дополнением в ранней комплексной оценке эффективности ЗМК. В случаях неэффективной ЗМК можно интраоперационно изменить план операции и выполнить протезирование МК. Методика ИО ЧП ЭхоКГ включает в себя необходимость проведения исследования на всех трех этапах
190 *
операции: контроль до вмешательства на МК, контроль во время выполнения ЗМК, контроль после выполнения ЗМК и стабилизации гемодинамики.
На этапе до вмешательства на МК по данным ЧП ЭхоКГ мы повторно оцениваем выраженность митрального стеноза, морфологические изменения клапанного и подклапанного аппарата, подтверждаем данные трансторакального исследования, выявляем и трактуем находки (например, тромбоз ушка ЛП, вегетации и т.п.).
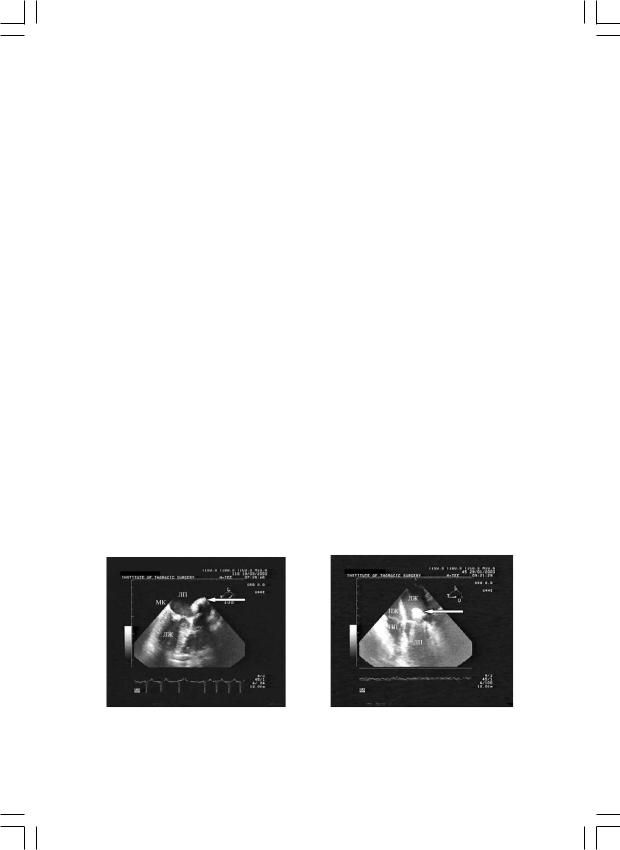
ЭхоКГ контроль непосредственно в момент выполнения ЗМК, дает ряд возможностей и преимуществ использования метода на этом этапе. При выполнении ЗМК, ЧП ЭхоКГ не только подтверждает данные хирурга о радикальности разделения спаяний, но и дает дополнительную информацию по гемодинамике на клапане и функциональной подвижности створок. Методика позволяет наглядно получать изображение на мониторе пальца хирурга (инструмента), его манипуляции в ЛП относительно структур МК (рис. 2а, б).
Как известно, последовательность хирургических манипуляций пальцем или инструментом может контролировать только хирург. Анестезиологический контроль на этом этапе сводится, главным образом, к оценке наличия сердечной деятельности, артериального и венозного давления, частоты и характера сердечного ритма. Всякое изменение параметров гемодинамики может потребовать оперативной коррекции со стороны анестезиолога. В то же время техника ЗМК связана с моментами, когда палец хирурга на короткое время практически полностью перекрывает МО, что может приводить к кратковременным изменениям внутрисердечной гемодинамики. Это достаточно наглядно видно на кривой артериального давления, ко-
а |
б |
Рис. 2. Интраоперационная чреспищеводная ЭхоКГ во время выполнения ЗМК. а – контроль расположения пальца хирурга (стрелка) в левом предсердии; б – контроль разделения переднелатеральной комиссуры (стрелкой указан палец хирурга).

* 191
торая на этом этапе может снижаться до цифр 30–40 мм рт. ст. Свои манипуляции хирург постоянно соотносит с показателями гемодинамики на экране монитора. В то же время оценить эффективность разделения сращений на этом этапе может только хирург, ориентируясь на пальцевую ревизию.
При отработанной методике ЭхоКГ контроля в позициях с изображением ЛП, ЛЖ и МК можно видеть последовательность и эффективность разделения сросшихся комиссур, подклапанных сращений. Здесь, на наш взгляд, имеют большое значение методические аспекты исследования, направленные на применение конкретных ультразвуковых доступов при выполнении поэтапных манипуляций пальцем хирурга или инструментом. Последовательность хирургических манипуляций соотносится с применением определенных ультразвуковых доступов.
В случае эффективного разделения спаяний в комиссуре, при ЭхоКГ будет видно, как палец хирурга «проваливается» между краев створок в подклапанные структуры. После удаления пальца выше краев створок, отмечается динамика их диастолического расхождения и гемодинамических показателей.
Диагностику регургитации на клапане, ее усиление и локализацию, одновременно оценивают и дополняют друг друга пальцевая ревизия и допплер-ЭхоКГ. После того как хирург выполнил все этапы внутрисердечной коррекции митрального стеноза и контроль состояния МК, он удаляет палец из ЛП. Кисетный шов завязывают, и далее проводят очередной контроль манометрии левых камер сердца и ЭхоКГ контроль. После проведения контрольного ультразвукового исследования и манометрии, в случаях неэффективного разделения клапанных сращений, а также при нестабильной гемодинамике, после некоторого перерыва и стабилизации гемодинамики можно делать повторные попытки ЗМК.
После выполнения ЗМК и стабилизации гемодинамики проводим манометрию и очередной этап ЭхоКГ контроля эффективности ЗМК, оценку показателей гемодинамики и сократимости миокарда.
Важным вопросом является определение эффективности результатов ЗМК. Известно, что в большинстве случаев после ЗМК не происходит полного восстановления площади МО до нормальных значений. Однако при увеличении площади МО до 3,0 см2 и более отмечается значительный положительный клинический эффект.
Критерии оценки эффективности результатов ЗМК при ЧП ЭхоКГ аналогичны таковым при трансторакальном исследовании.
