
Шевченко Ю.Л. - Актуальные вопросы грудной хирургии
.pdf
62 *
В группе пациентов с ПАЛЖ по данным селективной коронарографии поражение 1 КА выявлено в 33,3% случаев, 2 КА – в 51,9%, 3 КА – 14,8%. По данным ОЭКТ в 88% случаев отмечается 1 дефект перфузии. В группе пациентов с распространенным кардиосклерозом по данным селективной коронарографии поражение 1 КА не отмечено, 2 КА – в 8,3%, 3 КА – 58,3% и 4 КА в – 33,4%. По данным ОЭКТ 71% пациентов характеризутся наличием 3–4 дефектов наполнения (рис. 6–7, цв. вклейка).
При проведении томосцинтиграфии у больных с ПАЛЖ определяется дефект перфузии в 67,5% сегментов в покое и в 48,8% при нагрузочном тесте с добутамином, в то время как у пациентов с распространенным ПИКС эти значения составили 41,3 и 30,6%. Критический уровень накопления РФП зарегистрирован в 40,7% сегментов пациентов с ПАЛЖ при исследовании в покое, и в 31,2% – при НПД. В группе сравнения снижение накопления РФП до критического уровня отмечалось в 41,3% сегментов, а на фоне НПД – в 27,1%. Из всех дефектов наполнения в основной группе нежизнеспособными признаны 19,4% сегментов, против 3,54% в группе 2. Это говорит о большей степени инвалидизации миокарда у пациентов с постинфарктной ПАЛЖ.
Наибольшее поражение миокарда у пациентов с ПАЛЖ отмечается в области верхушки, передней стенки и передней части межжелудочковой перегородки (МЖП). На основе данных ОЭКТ передневерхушечная локализация с распространением на МЖП была выявлена у 16 больных, аневризма верхушечно-передне-боковой локализации без распространения на МЖП – у 11 больных, что коррелировало с данными, полученными во время эхокардиографии
иоперации.
Вранней стадии острого ИМ участок некротизированной ткани может растягиваться и выпячиваться, принимая значительную часть ударного объема. Результаты многих исследований показали, что наличие «живого» миокарда в инфарцированной зоне уменьшает риск значительного перерастяжения стенок ЛЖ и изменения внутриполостных соотношений [1]. Жизнеспособность миокарда в «переходной» области является значимым фактором, влияющим на дальнейшее изменение геометрии, архитектоники и сократимости ЛЖ. Определение выраженности асинергии стенок ЛЖ, количественная
икачественная оценка жизнеспособности миокарда как базальных отделов, так и в пограничной зоне, влияют не только на объем выполняемого оперативного вмешательства. Эти показатели, в первую очередь, важны для предварительного определения уровня ре-

* 63
зекции ПАЛЖ, вида пластики, прогнозирования возможных осложнений в раннем и отдаленном послеоперационных периодах. При сравнительном анализе динамики накопления 99Тс-МИБИ (до и после операции) в пораженных участках миокарда и уменьшения дефектов перфузии возможно предположить, что положительный эффект пластики ЛЖ с помощью лоскута из МЖП дополняется сохранением жизнеспособного миокарда в области переходной зоны (рис. 8–10).
а |
|
б |
|
|
|
Рис. 8. Накопление РФП у пациента с постинфарктной аневризмой левого желудочка передневерхушечная локализация с распространением на МЖП до операции: а – в покое; б – на фоне нагрузочной пробы с добутамином.
Рис. 10. Накопление РФП у пациентов с постинфарктной аневризмой левого желудочка передневерхушечной локализации, с распространением на МЖП после операции.

64 *
Литература
1.Bolognese L., Cerisano G., Buonamici P., Santini A., et al. “Influence of Infarct-Zone Viability on Left Ventricular Remodeling After Acute Myocardial Infarction”// Circulation – 1997. - № 96 – р. 3353-3359.
2.Claeys M.J., Vrints C.J., Krug B., Bosmans J.M. et al . ”Adenosine Technetium-99 m sestamibi (SPECT) for the early assessment of jeopardized myocardium after acute myocardial infarction”.// Eur.Heart J. - 1995. - № 16 – р. 1186-1194.
3.Bonow R.O. “Identification of viable myocardium” // Circulation - 1996. - № 94 – р. 2674-2680.
4.Soto J., Beller G. “Clinical Benefit of Noninvasive Viability Studies of Patients with Severe Ischemic Left Ventricular Dysfunction”// Clin. Cardiol. – 2001. - № 24 – р. 428-434.
5.Yoshinaga K., Morita K., Yamada S., Komuro K., et al. “Low-dose dobutamine electrocardiograph-gated myocardial SPECT for identifying viable myocardium: comparison with dobutamine stress echocardiography and PET.”// J. Nucl. Medicine – 2001. - № 42 (6) – р. 838-44.
6.Cuocolo A., Acampa W., Nicolai E. “Quantitative thallium-201 and technetium 99m sestamibi tomography at rest in detection of myocardial viability in patients with chronic ischemic left ventricular dysfunction”// J. Nucl. Cardiology – 2000. - № 7 (1) – р. 8-15.
7.Stollfuss J.C., Haas F., Matsunari I. “99m Tc-tetrofosmin SPECT for prediction of function recovery defined by MRI in patients with severe left ventricular dysfunction: additionat value of Gated –SPECT”// J. Nucl. Medicine – 1999. - № 40 (11) – р. 1824-1831.
8.Calnon D., Glover D., Beller G., Vanzetto G., et al. “Effects of Dobutamine Stress on Myocardial Blood Flow, 99mTc Sestamibi Uptake, and Systolic Wall Thickening in the Presence of Coronary Artery Stenoses”// Circulation – 1997. - № 96 – р. 2353-2360.
ПРИМЕНЕНИЕ НЕИНВАЗИВНОЙ ВСПОМОГАТЕЛЬНОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ У БОЛЬНЫХ ПОСЛЕ ОПЕРАЦИЙ КОРОНАРНОГО ШУНТИРОВАНИЯ
С.М. Вашкевич, И.А. Борисов, Ю.И. Гороховатский, Ш.М. Магоммедов
Нарушение оксигенирующей функции легких у больных после кардиохирургических операций остается одной из наиболее актуальных проблем в ближайшем послеоперационном периоде. До 23%

* 65
больных нуждаются в продленной ИВЛ, летальность в этой группе достигает 20%.
Причинами, ведущими к развитию гипоксемии, считают гиповентиляцию, связанную с изменениями паттерна дыхания, ателектазирование, увеличение фракции внутрилегочного шунта, непосредственное повреждение паренхимы легких вследствие контакта крови с экстракорпоральным контуром (постперфузионный легочный синдром).
Цель исследования: оценить влияние метода неинвазивной вспомогательной вентиляции легких – пропорциональной поддерживающей вентиляции – на течение ближайшего послеоперационного периода после операций коронарного шунтирования.
Материалы и методы. Обследовано 50 больных ИБС в возрасте от 40 до 60 лет (44 мужчины и 6 женщин). Всем пациентам выполнена прямая реваскуляризация миокарда в условиях нормотермического искусственного кровообращения (ИК) и тепловой кровяной калиевой кардиоплегии. Операции проводили под общей внутривенной анестезией (доза фентанила за операцию – 30–35 мкг/кг). Миорелаксацию достигали применением ардуана. Больные были распределены на две группы. В первую группу вошли 22 пациента, которым проводили «традиционную» вспомогательную вентиляцию легких. Во второй группе использовали неинвазивную вспомогательную вентиляцию легких (НВЛ), сюда включены 28 пациентов.
В первой группе респираторная терапия осуществлялась следующим образом: использовались аппараты ИВЛ «Puritan Benett» 760 или 840 серии. Инициальный режим респираторной поддержки «Volum assist», затем «SIMV+PS» с поступенчатым переводом в режимы «Pressure support» и «CPAP». Для экстубации использовали следующие критерии:
•Индекс оксигенации выше 250 мм рт.ст.
•Поддержка давлением менее 5 см вод. ст., CPAP<5 см вод. ст.
•Больной в сознании, без признаков нейромышечной блокады.
•Усилие на вдохе не менее 20 см вод. ст.
•Жизненная емкость легких не менее 10 мл/кг.
•Минутный объем вентиляции легких не менее 10 литров. После экстубации осуществляли ингаляцию кислорода. Больные
из второй группы были экстубированы в более ранние сроки по следующим критериям:
•Больной в сознании, контактен, адекватен, без явной неврологической симптоматики.
•Имеются адекватные попытки вдоха по указанию врача.
•Стабильная гемодинамика.

66*
•Нет жизнеугрожающих нарушений ритма.
•Отсутствуют признаки хирургического кровотечения.
•Нет пневмоторакса.
•Индекс оксигенации выше 200 мм рт.ст.
•PaCO2 <50 мм рт.ст.
•Есть возможность адаптировать маску к лицу пациента.
Для НВЛ использовался аппарат «BiPAP Vision» фирмы «Respironics» в режиме пропорциональной поддерживающей вентиляции со следующими начальными параметрами:
•Поддержка потоком (FA) 4 см вод.ст./л/сек.
•Поддержка объемом (VA) 8 см вод.ст./л.
•FiO2 70%.
•Коэффициент поддержки 45–85%.
В дальнейшем производили корректировку параметров поддержки на основании оценки следующих показателей:
•Напряжение O2 в артериальной и венозной крови.
•Напряжение СO2 в артериальной крови.
•Дыхательный объем и минутный объем дыхания.
•Частота дыхания.
•Оценка пациентом степени комфорта.
Для обеспечения вентиляции у большинства пациентов использовали носовую маску. В комплекте аппарата имеется 8 типоразмеров носовых масок, поэтому для большинства больных возможно подобрать оптимально подходящую. В случаях, когда не удавалось избежать утечек через открытый рот, использовали ротоносовые маски либо маску «Totalface». Все маски имеют комплекты разнообразных креплений, обеспечивающих минимальные утечки через контур пациента, минимальное давление в местах соприкосновения с лицом, максимальный комфорт. Использовали следующие критерии для прекращения НВЛ:
•Индекс оксигенации выше 300 мм рт.ст.
•Частота дыхания менее 25 в минуту.
•Дыхательный объем более 8 мл/кг при поддержке респира-
тором с коэффициентом не выше 30%.
В результате длительность вентиляции через «инвазивный» контур составила в первой группе в режиме «Volum assist» 3,5–4,5 ч, «SIMV+PS» 8–9 ч, экстубация через 12 ч; во второй группе «Volum assist» – 2–2,5 ч, «SIMV+PS» 1–2,5 ч, экстубация через 3–5 ч после операции.
Общая длительность аппаратной респираторной поддержки в первой группе составила 12 ч, во второй – 16 ч.

* 67
Длительность пребывания пациентов в отделении реанимации в первой группе – 48–72 ч, во второй – 16–36 ч. Основной причиной к более длительному пребывания в отделении реанимации пациентов первой группы была медленная динамика нарастания индекса оксигенации, требовавшая продолжение оксигенотерапии. Это было связано со следующими основными причинами: гиповентиляция, ателектазы, интерстициальный отек легких на фоне скорригированной левожелудочковой недостаточности или при ее отсутствии. Во второй группе эти явления наблюдались реже и имели более быструю регрессию. Связано это с тем, что НВЛ свойственны следующие клинические эффекты:
•Улучшение оксигенации.
•Профилактика гиповентиляции и ателектазирования.
•Уменьшение работы дыхания.
•Ранняя активизация.
•Снижение количества инфекционных осложнений со стороны дыхательной системы.
•Возможность откашливания мокроты.
•Способность есть, пить, разговаривать.
СОВРЕМЕННЫЕ ЭНДОВАСКУЛЯРНЫЕ ТЕХНОЛОГИИ В ЛЕЧЕНИИ ТЯЖЕЛЫХ ФОРМ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
А.Г. Виллер, Ф.Н. Палеев
ИБС является самой частой причиной смерти от сердечно-сосу- дистых заболеваний. При этом сохраняются неблагоприятные эпидемиологические тенденции, касающиеся прежде всего лиц молодого, активного возраста. Треть мужчин и женщин, умирающих от ИБС, моложе 55 лет. Среди лиц, утративших трудоспособность, неуклонно увеличивается число больных с факторами риска прогрессирования ИБС: ожирением, неблагоприятным семейным анамнезом, злоупотребляющих курением [1].
Успехи и расширение современных возможностей интервенционной кардиологии в первую очередь относятся к лечению больных с тяжелыми формами ИБС, к которым относятся хронические окклюзии (ХО) венечных артерий (ВА), рецидив стенокардии после коронарного шунтирования [2].

68 *
ХОВА еще совсем недавно являлась практически абсолютным показанием к выполнению коронарного шунтирования. Появление нового поколения сверхжестких коронарных проводников, а также применение стентов существенно увеличило частоту операционного успеха. В настоящее время реканализации ХОВА составляют 15–20% от общего числа эндоваскулярных операций. Частота успеха по данным зарубежных исследований, составляет от 60 до 90%, частота кардиальных осложнений не превышает 2% [8]. При тщательном отборе пациентов для эндоваскулярной реканализации ХОВА результат может быть приближен к стопроцентному. Успешная реваскуляризация жизнеспособного миокарда способствует увеличению фракции выброса (ФВ) левого желудочка (ЛЖ) и улучшению краткосрочного и долговременного прогноза и качества жизни больных ИБС [7]. Положительный результат пробы с нагрузкой с развитием ишемии в зоне ХО или признаки обратимой ишемии при стресс-пробе могут быть расценены как показания к проведению процедуры реваскуляризации в данной области. Кроме того, могут быть использованы относительно новые методики: ядерно-магнитно-резонансное исследование в сочетании с добутаминовой пробой и позитронно-эмиссионная томография.
Факторами, способствующими непосредственному успеху процедуры, являются:
•срок возникновения окклюзии менее 3 мес,
•функциональная окклюзия,
•наличие конической культи,
•отсутствие боковых ветвей,
•отсутствие мостовидных коллатералей,
•небольшая протяженность окклюзии,
•визуализация постокклюзионного сегмента,
•тщательный отбор пациентов,
•опыт хирурга.
Противопоказанием к операции является: протяженная окклюзия (более 30 мм), вовлеченность в зону окклюзии крупных боковых ветвей, диффузное пре- и постокклюзионное поражение ВА, выраженный кальциноз артерии в зоне окклюзии. Вышеуказанные состояния являются предикторами высокого риска рестеноза и интраоперационных осложнений.
Стентирование является единственной на сегодняшний день технологией, позволяющей улучшить результаты реканализации ХОВА. Основанием для улучшения непосредственных и отдаленных результатов стентирования служит улучшение геометрии просвета ВА. Данные зарубежных исследований свидетельствуют, что внедрение в кли-

* 69
ническую практику стентов с лекарственным покрытием минимизирует риск рестеноза, в том числе и в данной группе больных ИБС.
Любая эндоваскулярная операция, особенно когда есть альтернативная возможность выполнения хирургической реваскуляризации миокарда, всегда рассматривается в контексте непосредственного и долгосрочного прогноза, поэтому при определении показаний к ее выполнению учитываются не только ангиографические, но и клинические факторы. Клиническими показаниями являются: стенокардия напряжения, рефрактерная к медикаментозной терапии у пациентов, у которых симптомы достоверно связаны с зоной кровоснабжения окклюзированной ВА; альтернативная эндоваскулярная операция у пациентов с противопоказаниями к аортокоронарному шунтированию (АКШ).
Опыт специалистов НИИ Грудной хирургии ММА им. И.М. Сеченова в области эндоваскулярной реканализации ХО ВА составляет 173 операции, из которых 161 (93%) закончилась успешно (табл. 1).
Во всех случаях предоперационное обследование, помимо коронарографии, включало тот или иной нагрузочный диагностический тест, суточное мониторирование ЭКГ, эхокардиографию (ЭхоКГ). Стенокардия высокого функционального класса диагностировалась у 126 (78,3%) пациентов, острый инфаркт миокарда (ИМ) и АКШ в анамнезе – у 148 (91,9%) и 17 (10,6%) соответственно. У 12 (7%) больных ИБС попытка реканализиции не увенчалась успехом. Основными причинами являлись: невозможность провести коронар-
Таблица 1. Характеристика больных ИБС, которым выполнялась эндоваскулярная реканализация одной из ВА
|
|
|
|
|
|
Всего пациентов |
|
173 |
|
|
|
|
|
|
|
Средний возраст |
|
54,2 |
|
|
|
|
||
|
Мужчин/женщин |
|
164/5 |
|
|
|
|
|
|
|
Стенокардия III–IV ф.к. |
|
126 (78,3%) |
|
|
ИМ в анамнезе |
|
148 (91,9%) |
|
|
АКШ в анамнезе |
|
17 (10,6%) |
|
|
|
|
||
|
ÔÂ < 40% |
|
19 (10,9%) |
|
|
|
|
|
|
|
Гиперхолестеринемия |
|
112 (64,7%) |
|
|
|
|
|
|
|
|
|
|
|
|
Успешная реканализация |
|
161 (93%) |
|
|
|
|
|
|
|
|
|
||
|
Стентирование |
|
132 (82%) |
|
|
|
|
|
|
|
|
|
|
|
70 *
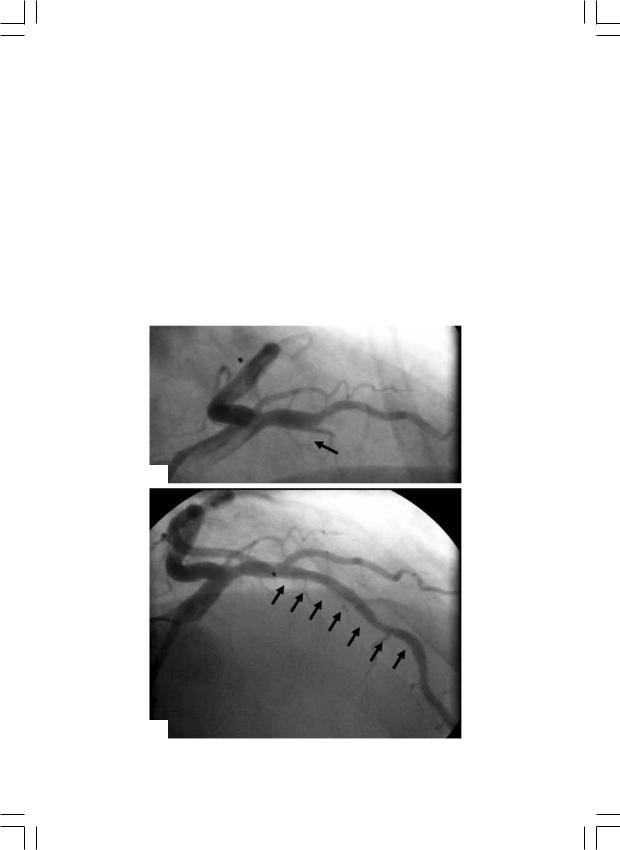
ный проводник через кальцинированную окклюзию, а также формирование проводником субинтимального ложного хода. При выполнении операции наиболее важным было: жесткая фиксация проводникового катетера в устье ВА, подбор коронарного проводника. Во время реканализации протяженных окклюзий применяли ультражесткие проводники Cross-It 100-400 (GUIDANT, CША). В зависимости от локализации окклюзии 74 (46%) операции успешно выполнены на передней межжелудочковой артерии, 25 (15,5%) – на огибающей ветви и 62 (38,5%) – на правой коронарной артерии (рис. 1).
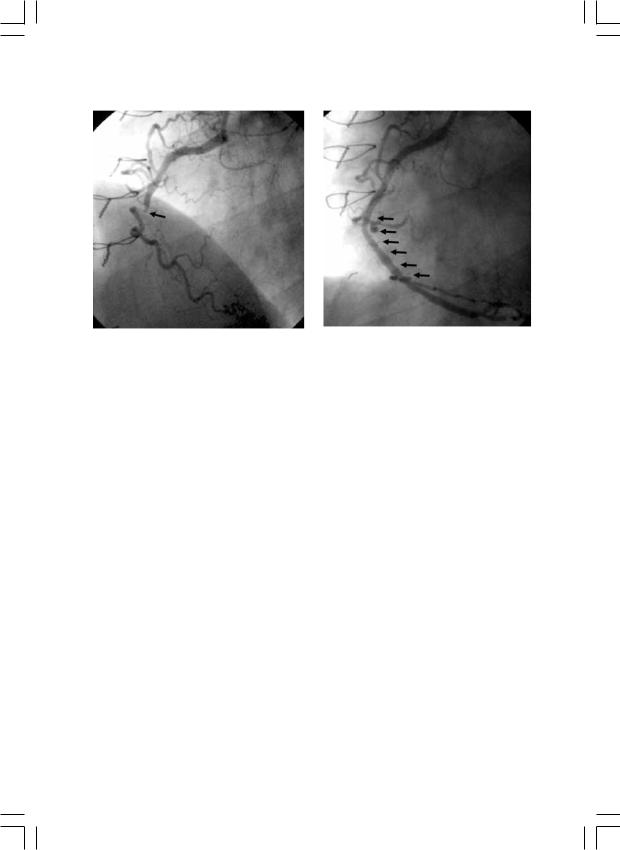
Стентирование после проводниковой реканализации и баллонной ангиопластики применили в 82% случаев, в 13,7% случаев удалось выполнить прямое стентирование окклюзированной ВА без предварительной дилатации (рис. 2).
а
б
Рис. 1. Результат стентирования ПКА (а – до и б – после).
* 71
а |
|
б |
|
|
|
Рис. 2. Прямое стентирование окклюзированной ВА без предварительной дилатации (а – до и б – после).
Во всех случаях успешной реканализации верифицировали улучшение сократительной функции сердца (в среднем на 12% по данным ЭхоКГ) и клинической картины заболевания в зависимости от характера и распространенности атеросклеротического поражения ВА, типа кровоснабжения миокарда, исходного объема рубцовых изменений ЛЖ у оперированных больных. Важным ангиографическим признаком восстановления естественного антеградного венечного кровотока являлось исчезновение коллатерального кровоснабжения постстенотических сегментов ВА. В группе из 7 (4,3%) успешно оперированных пациентов с помощью баллонного катетера over- the-wire выполнено прямое измерение постокклюзионного кровяного давления в ВА до и после полной реканализации. Во всех случаях указанный показатель увеличивался более чем в 2,5 раза, что обусловливало нивелирование коллатерального кровоснабжения в ишемизированном до операции миокарде.
Рецидив стенокардии (РС) после АКШ – все чаще встречающаяся форма ИБС. По различным данным, «естественное изнашивание» шунтов приводит к поражению 15–20% шунтов в течение года после АКШ. По многочисленным данным, 60% шунтов окклюзируются или сужаются в течение 10 лет после АКШ в результате естественного прогресса коронарного атеросклероза и до 30% ранее оперированных пациентов нуждаются в повторной реваскуляризации в этот же период времени. Повторная операция – технически более трудновыполнимое вмешательство, связанное с более высоким рис-
