
s5_atomfiz_exam_nah_book
.pdf
Глава 9. Експериментальні дані про будову та властивості складних атомів
відношенням 2S+1. Повна кількість станів з двома незалежними зна-
ченнями векторів L i Ls є добутком
(2 1)(2s 1) .
Знайдемо тепер повну можливу кількість станів вектора L j , коли
квантове число j набуває всі можливі значення, що визначаються нерівністю (9.27). Коли > s, кількість таких станів буде
j s |
|
|
2( s) 1 2( s) 1 |
|
|
|
(2 j 1) |
(2s 1) (2 1)(2s 1) , |
|||
|
|||||
j s |
|
|
2 |
|
|
а коли < s, |
|
|
|
||
j s |
j 1) |
2 ( s l ) 1 2 ( s l ) 1 |
(2 1) (2 s 1)(2 1) . |
||
(2 |
|||||
j s |
|
|
2 |
|
|
Отже для двох випадків ( < s і > s) ми отримали однакову кількість
станів сумарного вектора моменту кількості руху Lj , яка дорівнює
кількості станів незалежних векторів L та Ls. Тому нерівність (9.27) дійсно дозволяє знаходити можливі значення квантового числа j, котре набуває такі значення:
J = +s; |
+s-1; |
+s-2;........; |
+s-2s = -s 0 |
для > s |
J = +s; |
+s-1; |
+s-2;........; |
+s-2 = s-l |
для < s. |
9.7. Тонка структура спектрів складних атомів як наслідок спін-орбітальної взаємодії
Взаємодія спіну з орбітальним моментом електрона характеризується енергією взаємодії Е. Її можна оцінити, розглядаючи взаємодію магнітних моментів між собою або одного з магнітних моментів з магнітним полем, зв’язаним з другим магнітним моментом, наприклад, спінового магнітного моменту s з магнітним полем орбіта-
льного магнітного моменту H :
. (9.26)
Оскільки gs=2, a ms =1/2, -1/2, то зміна енергії Е збільшується або зменшується в залежності від орієнтації спіну, що визначає знак
квантового числа ms E gS mS 0H . Щоб оцінити величину
Находкін М.Г., Харченко Н.П., Атомна фізика |
233 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
цієї енергії, необхідно знати магнітне поле H . Для його визначення
розглянемо орбітальний рух електрона навколо атомного ядра в системі координат, зв’язаної з електроном (рис.9.6.б). У цій системі координат електрон знаходиться у спокої, а атомне ядро рухається навколо нерухомого електрона. Рух позитивно зарядженого ядра ство-
|
|
||
рює магнітне поле з напруженістю H |
eZ [vr ] |
або для випадку |
|
cr3 |
|||
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ev |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
атома водню Z = 1 і |
H |
|
. Позначимо швидкість електрона у |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cr 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m0 v 2 |
|
e2 |
|
||||||||||
|
|
|
|
|
|
|
|
через с = v і |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
стані |
|
1s |
підставимо |
|
|
її у вираз |
|
|
|
|
, то |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
2a0 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
s,z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s,z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
s,z |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s,z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
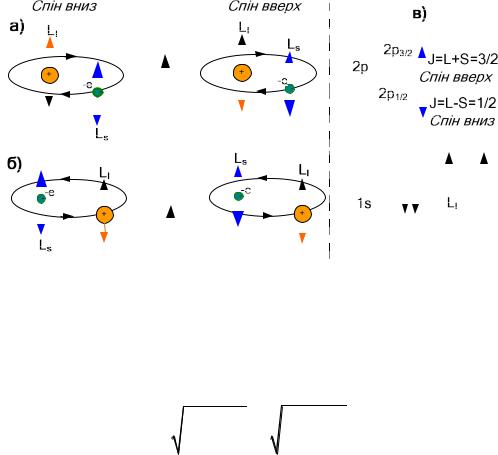
|
Рис.9.6. |
Схема спін-орбітального зв’язку: а) – початок координат на |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ядрі, б) – початок координат на електроні, в) – розщеплення рівнів. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
m 2c2 |
|
|
e2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
0 |
|
|
|
|
|
|
|
|
. Із цього співвідношення отримаємо вираз для сталої |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2 |
|
|
|
|
2a |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
тонкої структури |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e2 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e2 |
|
|
|
|
|
e2 e 2 m |
0 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
(9.27) |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
a |
0m0 c 2 |
|
2 m0 c 2 |
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
|
|
|
|
|||||||||||||||||||||||
Находкін М.Г., Харченко Н.П., Атомна фізика |
234 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
Стала тонкої структури - фундаментальна фізична стала, яка визначає величину розщеплення спектральний ліній. У рамках напівквантової теорії Бора для атома водню вона характеризує швидкість електрона на першій борівській орбіті v = c = (1/137)с.
Визначимо абсолютну величину напруженості магнітного поля H , що створюється рухом ядра навколо електрона, через сталу тон-
кої структури
|
H |
|
|
e c |
|
e |
(9.28) |
|
|
||||||
|
|
cr2 |
r2 |
||||
|
|
|
|
|
|
Підставивши (9.28) у вираз для енергії спін-орбітальної взаємодії для атома водню (9.26) остаточно отримаємо:
E g s ms 0 H |
e |
|
|
e |
|
2 |
E1s . |
(9.29) |
|
2m |
0 |
c |
|
r 2 |
|
||||
|
|
|
|
1s |
|
|
|
|
|
Енергія Е спін-орбітальної взаємодії залежить від квадрата сталої тонкої структури 2 5 10-5, яка згідно (9.27), – мала величина = e2/ c = 1/137 7 10-3, тому спін-орбітальна взаємодія значно менша за енергію стаціонарного стану Е/Е1s 5 10-5. Але вона збільшується у Z3 разів для воднеподібних систем із зарядом ядра Z, що вже відчутно для спектрів лужних металів.
Енергія спін-орбітальної взаємодії залежить від магнітного спінового квантового числа ms, яке може мати два значення 1/2. Це означає, що спін-орбітальна взаємодія розщеплює енергетичний рівень стаціонарного стану на два підрівні з енергіями Е + Е(ms = 1/2) і Е - Е(ms = -1/2). Ці два рівні енергії відповідають двом значенням квантового числа сумарного моменту кількості руху j,
s j s
або
1 j 1 2 2
Для кожного числа одноелектронного атома є два значення числа j :
|
|
|
1 |
|
|
|
|
|
|
|
2 |
|
||
j |
|
|
(9.30) |
|
|
|
1 |
||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
Находкін М.Г., Харченко Н.П., Атомна фізика |
235 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
В окремому випадку, коли = 0 (1S - стані) |
|
||
j s |
1 |
|
(9.31) |
2 |
|
||
|
|
|
|
Таким чином, стаціонарні стани водневоподібних атомів лужних металів з одним валентним електроном визначаються трьома квантовими числами n, і j. Їх терми прийнято поз-
начати:
n 2s+1 j ,
де 2s+1 - називається мультиплетністю термів, а n - головне квантове число.
9.8.Особливості тонкої структури атомних спектрів
лужних металів
Розглянемо терми валентного електрона атомів лужних металів на прикладі атома Na з атомним номером Z
= 11. Його валентний електрон знахо- |
|
Таблиця 9.3. Терми Na |
|||||||||
|
n |
|
|
|
j |
|
|
терм |
|
||
диться в не збудженому стані на енерге- |
|
|
|
|
|
|
|||||
3 |
|
0 |
1/2 |
|
|
32S1/2 |
|||||
тичному рівні з головним квантовим чи- |
|
|
|
||||||||
|
|
|
1 |
1/2 |
|
|
32P1/2 |
||||
слом n = 3. Декілька його термів |
|
|
|
|
|
||||||
|
|
|
|
3/2 |
|
|
32P3/2 |
||||
наведені в таблиці 9.3, де для їх характе- |
|
|
|
|
|
|
|||||
ристик |
використані стандартні позна- |
|
|
|
2 |
3/2 |
|
|
32D3/2 |
||
чення термів. Терми натрію мають бути |
|
|
|
|
5/2 |
|
|
32D5/2 |
|||
дублетними, тому що s = 1/2, а мульти- |
4 |
|
0 |
1/2 |
|
|
42S1/2 |
||||
плетність термів дорівнює а 2s+1= |
|
|
|
1 |
1/2 |
|
|
42P1/2 |
|||
2(1/2) +1 |
= 2. Між енергетичними рів- |
|
|
|
|
3/2 |
|
|
42P3/2 |
||
нями можуть мати місце спонтанні пере- |
|
|
|
2 |
3/2 |
|
|
42D3/2 |
|||
ходи, якщо виконуються правила відбо- |
|
|
|
|
5/2 |
|
|
42D5/2 |
|||
ру. Застосування правила відбору для |
|
|
|
3 |
5/2 |
|
|
42F5/2 |
|||
дипольних переходів |
|
|
|
|
|
|
|
|
|||
|
|
|
|
7/2 |
|
|
42F7/2 |
||||
= 1; j = 0; 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
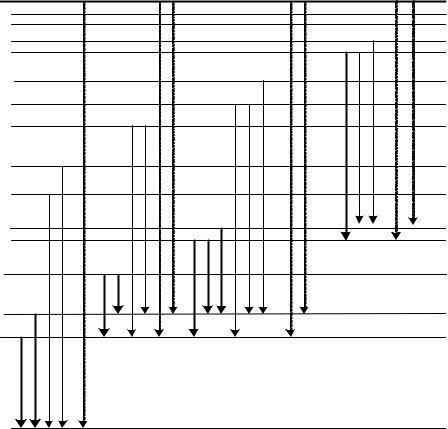
дозволило отримати такі спектральні серії (рис.9.7).
Находкін М.Г., Харченко Н.П., Атомна фізика |
236 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
5 |
2 F 7/2 |
|
|
4 |
|
|
|
4 |
2F 5 /2 |
|
|
4 |
2 D 5/2 |
|
|
4 |
2 D 3/2 |
|
|
5 |
2S 1/2 |
|
|
4 |
2P 3/2 |
|
|
4 |
2P 1/2 |
|
|
3 |
2D 5/2 |
|
|
3 |
2D 5 /2 |
|
fundam ental |
|
|
|
|
4 2S 1/2 |
|
|
|
3 |
2P 3/2 |
|
|
3 |
2P 1/2 |
sharp |
diffuion |
|
|
||
3 2S 1/2 |
pricipal |
|
|
|
|
|
|
|
Рис.9.7. Схема термів і переходів між ними для атомів Na. |
||
*1 |
Головна серія (principal) |
||
= 32 |
S1/2 - n 2P1/2 |
n = 3, 4, 5,... |
|
*2 |
= 32 |
S1/2 - n 2P3/2 |
n = 3, 4, 5,... |
лінії цієї серії дублети, в яких *1,2 n-3.
Друга побічна серія ( sharp )
*1 = 3 2P1/2 - n 2S1/2 ; |
n = 4, 5, 6,... |
*2 = 3 2P3/2 - n 2S1/2; |
n = 4, 5, 6,.. |
різниця хвильових чисел дублетів цієї серії не залежить від квантового числа n.
Дифузна серія (diffusion) або перша побічна
*1 = 32P1/2 - n 2D3/2 |
n = 3, 4, 5,.. |
Находкін М.Г., Харченко Н.П., Атомна фізика |
237 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
*2 |
= 32P3/2 |
- n 2D3/2 |
n = 3, 4, 5,.. |
*3 |
= 32P3/2 |
- n 2D5/2 |
n = 3, 4, 5,.. |
лінії цієї серії - триплети, у яких *1,2 не залежить від квантового числа n, а *2,3 n-3.
Таким чином, ми встановили мультиплетну структуру ліній основних серій спектрів атомів лужних металів і якісно вказали на залежність величини розщеплення лінії від головного квантового числа. Все це дає підставу стверджувати, що причиною виникнення тонкої структури термів і спектральних ліній атомних спектрів лужних металів є спін-орбітальна взаємодія. Під час розгляду складних багатоелектронних атомів потрібно враховувати оберталь-
ну складову енергії 2 1  2m0r2 . Їх вплив призводить до появи залежності Е не тільки від n, але й від квантового числа , тому мо-
2m0r2 . Їх вплив призводить до появи залежності Е не тільки від n, але й від квантового числа , тому мо-
жуть мати місце випадки, коли E42 S1/2 E32 D3/2 . Цей ефект збі-
льшується пропорційно 1/n2. Рівняння Шредінґера не дає кількісних величин розщеплення термів, бо воно не релятивістське, а в основі спін-орбітальної взаємодії лежить релятивістська магнітна взаємодія спінового і орбітального магнітних моментів. Для врахування магнітної взаємодії потрібно знайти нове фундаментальне рівняння, яке повинно бути інваріантним по відношенню до перетворень Лоренца. Таке рівняння було запропоновано нобелівським лауреатом
Полем Діраком.
ДІРАК ПОЛЬ АДРІЄН МОРЮ (1902-1984)
Англійський фізик.
У 1921 закінчив з відзнакою Брістольський університет за фахом електротехніка. У 1923 поступив в аспірантуру Кембріджського університету до Р.Фаулера, який познайомив його з новими ідеями у фізиці. Зацікавившись роботами Гейзенберга по матричній механіці, Дірак розвив власний оригінальний підхід до квантової проблематики і виклав його в серії статей, опублікованих в 1925-1926 у «Працях Лондонського королівського
товариства» («Proceedings of the Royal Society of London»). У 1926 одержав ступінь доктора філософії. Протягом року працював у Н.Бора в Копенгагені й у М.Борна в Геттінген. В 1932 став професором Кембріджського університету, одержавши кафедру, яку колись займав Ньютон. У 1933-1934 працював у Прінстонському інституті фундаментальних досліджень, потім повернувся в Кембридж. У 1968 пішов у відставку з посади професора Кембріджського університету і після нетривалої роботи в якості запрошеного професора університету штату Нью-Йорку Стоні-Брук та
Находкін М.Г., Харченко Н.П., Атомна фізика |
238 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
університету Майамі, став професором фізики університету Флориди в Талахасі. Роботи Дірака присвячені квантовій механіці, квантовій електродинаміці, теорії поля, теорії елементарних частинок, статистичній фізиці. У 1926-1927 він розробив математичний апарат квантової механіки . У 1927 застосував принципи квантової механіки до електромагнітного поля і побудував модель квантованого поля, заклавши основи квантової електродинаміки. Разом з Гейзенбергом у 1928 висунув ідею обмінної взаємодії. У 1928 Дірак вирішив проблему, яку не вдалося вирішити Шредінґеру - вивів релятивістське рівняння для електрона. Це рівняння мало важливу особливість – з нього випливало поняття спіну, яке було відсутнє в нерелятивістському рівнянні Шредінґера; крім того, воно пояснювало тонку структуру спектрів атома водню й ефект Зеємана. У 1931 Дірак висунув гіпотезу про існування елементарного магнітного заряду – монополя, у 1933 – антиречовини. Дірак вніс великий вклад у створення квантової статистики. У 1926 незалежно від Е.Фермі розробив статистику частинок з напівцілим спіном (статистика Фермі-Дірака). У 1931 обґрунтував можливість існування симетричної квантової електродинаміки, яка базується на концепції елементарних магнітних зарядів.
У 1937 Дірак висловив гіпотезу про зміну гравітації в часі. У 1962 розробив теорію мюона, розглядаючи останній як коливальний стан електрона, займався проблемою гамільтонового формулювання теорії гравітації з метою подальшого квантування гравітаційного поля. Лауреат Нобелівської премії 1933р. з фізики «за створення квантової механіки».
Розв’язок цього рівняння для найпростішого атома водню з урахуванням спін-орбітальної взаємодії дало величину енергії розщеплення термів, значення якої досить добре збігається з експериментальним. Воно виявилось прямо пропорційним квадрату сталої тонкої структури і квадрату атомного номера Z
або точніше
де e2 1
c 137
E En Z2 2 |
|
|
|
|
|
|
(9.32) |
||||
|
|
|
1 |
|
|
|
|
|
|
|
|
n, j n, j( 0) |
2Z2 |
|
|
3 |
|
|
(9.33) |
||||
|
|
|
|
|
|
|
|
|
|||
n |
j |
1 |
4n |
|
|
|
|||||
|
|
|
|
|
|
||||||
|
|
|
2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
e2Z2 |
|
||
- стала тонкої структури, а E |
|
- енер- |
|||||||||
2a n2 |
|||||||||||
|
|
|
|
|
|
|
n, j( 0) |
|
|
||
|
|
|
|
|
|
|
|
0 |
|
||
гія стаціонарного стану при = 0. З формули (9.33) видно, що величина спін-орбітального розщеплення залежить лише від двох квантових чисел n і j і не залежить для атома водню від орбітального кван-
тового числа . Тому у атома водню зберігається виродження за ор-
бітальним квантовим числом . При переході від атома водню до атомів лужних металів з одним валентним електроном виродження
Находкін М.Г., Харченко Н.П., Атомна фізика |
239 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
за числом знімається, а величина розщеплення збільшується в Z2 разів. Тому тонка структура спектрів, причиною виникнення якої є спін-орбітальна взаємодія, значно легше спостерігається в атомних спектрах лужних металів, ніж у атомному спектрі водню. Для спостереження за тонкою структурою спектрів атомів водню необхідно мати спектрограф з дуже великою роздільною здатністю такою, щоб/ < 2 10-5. Така тонка структура дійсно була знайдена і Е збільшувалось із збільшенням Z.
9.9. Надтонка структура спектральних термів атомів лужних металів
Використання спектрографів з надзвичайно великою роздільною здатністю ( / 2 10-5) виявило не тільки тонку, але й надтонку структуру спектральних ліній атомних спектрів лужних металів, а згодом і атомів водню. Наприклад, з’ясувалось, що дублет головної лінії головної серії атомного спектра натрію (D1 і D2) є сукупністю 10 близько розташованих ліній. Природа цієї надтонкої стру-
ктури пояснюється взаємодією сумарного моменту кількості руху електрона Lj з ядерним спіном LI.
Спіну протона відповідає магнітний момент протона, що дорі-
внює
|
|
g |
|
e |
, |
(9.34) |
|
p |
p 2 m p c |
||||||
|
|
|
|
||||
де mp = 1836,15 m0 - маса протона. Маса протона в 1836,1525 разів більша за масу електрона, тому магнітний момент протона буде в 1836,1525 разів менший за магнетон Бора ( p/ 0 = mp/m0 = 1/1836,1525).
Спін протона може мати дві проекції на вісь z,:
pz = 1/2 | p | (9.35) Lpz = 1/2 .
Ядерний спін повинен векторно складатися з сумарним моментом кількості руху електрона в атомі, і сумарний момент визначає терм. Застосуємо цю ідею до розгляду надтонкої структури термів атома натрію, у якого ядерний спін дорівнює 3/2 (I = 3/2). Абсолютна величина ядерного спіну визначається за формулою
Находкін М.Г., Харченко Н.П., Атомна фізика |
240 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
|
|
|
|
3 |
3 |
|
|
15 |
|||
LI |
|
I(I 1) |
|
||||||||
|
|
|
|
|
1 |
|
|
|
|||
2 |
2 |
|
4 |
||||||||
|
|
|
|
|
|
|
|
||||
Ядерний спін LI повинен взаємодіяти з сумарним спін-орбітальним моментом електрона Lj, утворюючи при цьому повний момент LF
|
LF Lj LI |
(9.36) |
|
LzF = mF |
(9.37) |
Нове квантове число F , що характеризує модуль повного моменту |
||
кількості руху |
|LF |, визначається нерівністю |
|
|
| j -I | F j + I. |
(9.38) |
Користуючись |
цією нерівністю розглянемо терми |
32S1/2; 32P1/2;; |
32P3/2, переходи між якими утворюють дублет D1 і D2.
Таким чином, терм 32S1/2 розщеплюється на два підтерми з
квантовими числами F = 2 і 1; терм 32P1/2 |
- на два підтерми з F = 2 і |
||||||||||||||||||||||||
1; терм 32З3/2 - на 4 підтерми з квантовими числами F = 3; 2; 1; 0. |
|||||||||||||||||||||||||
3 2 S 1 |
; j |
1 |
; I |
|
3 |
; F |
|
1 |
|
|
3 |
|
; |
1 |
|
3 |
1 2 ; 1 |
||||||||
|
|
2 |
2 |
|
2 |
|
|
2 |
|||||||||||||||||
2 |
2 |
|
|
1 |
|
|
|
|
3 |
|
2 |
|
|
||||||||||||
|
3 2 P 1 ; j |
|
; |
I |
; |
F 2 ; 1 |
|||||||||||||||||||
|
2 |
2 |
|||||||||||||||||||||||
|
2 |
3 |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
3 2 P 3 ; j |
; I |
|
|
; F 3 ; 2 ; 1; 0 |
||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
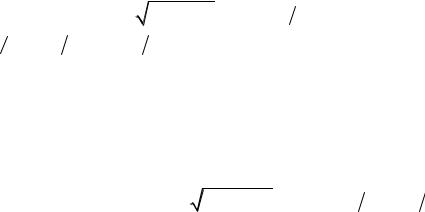
Ця система термів зображена на схематичній діаграмі на рис. 9.8. Правило відбору для квантового числа F подібне до правил відбору магнітного квантового числа
F = 0 ; 1. |
(9.39) |
Застосування цього правила відбору до переходів між термами атома натрію, як це показано на рис. 9.8, дає 10 окремих ліній. Перша лінія дублета D1 розпадається на 4 окремих лінії, а друга лінія дублета
|
|
|
|
|
|
|
3=F |
|
|
|
|
|
|
|
2 |
32P3/2 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
0 |
|
D2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
32P1/2 |
|
|
5 |
6 |
7 |
8 |
9 10 |
|
|
|
|
|
|
1 |
|
D1 |
2 |
3 |
4 |
|
|
|
|
1 |
|
|
|
|
|||
|
|
|
|
|
|
|
2 |
32S1/2 |
|
|
|
|
|
|
11 |
D1(1,2,3,4) |
|
|
|
1=F |
|||
D2(5,6,7,8,9,10) |
|||||||
Рис.9.8. Схема рівнів атома Na з урахуванням впливу ядерного спіну.
Находкін М.Г., Харченко Н.П., Атомна фізика |
241 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
D2 -на 6 окремих ліній. Крім того у спектрах поглинання з’являється ще одна одинадцята лінія, яка виникає при переході електрона із рівня 32S1/2 F=1 на рівень 32S1/2 F=2.
9.10.Висновки
1.Властивості атомів лужних металів вдається пояснити в рамках моделі квазіодноелектронного атома, у якого навколо екранованого атомного ядра з ефективним зарядом +еZеф<+еZ рухається один слабко зв’язаний валентний электрон.
2.Сильно зв’язані електрони створюють внутрішньоатомні електрично поля, які змінюють потенціал атомного ядра на периферії атома, де рухається валентний електрон. Внаслідок зміни потенціалу атомного ядра під дією екранування та поляризації атомного остову (9.2) знімається ви-
родження за орбітальним квантовим числом . Енергія стаціонарних станів, на відміну від атома водню, стає залежною від двох квантових чисел: головного n і орбитального .
3. Для пояснення тонкої структури спектральних ліній (їх мультиплетності) існуюча модель атома була доповнена гіпотезою про спін електрона – власний момент кількості
руху, для якого: |
LS |
|
s( s 1) |
, |
де s 1 2 ; LS , z |
m z , де |
||||
m s 1 2 і |
|
s |
Ls |
|
gs e 2m0c , де gs 2 . |
|
||||
|
|
|
||||||||
4. Внаслідок взаємодії спіна LS |
з |
орбітальним |
моментом |
|||||||
L , він орієнтується паралельно або антипаралельно ор-
бітальному моменту, що враховується магнітним кванто-
вим числом m s 1 2 або значенням квантового числа j ms , яке визначає сумарний кутовий момент елект-
2 або значенням квантового числа j ms , яке визначає сумарний кутовий момент елект-
|
|
|
|
|
|
|
рона Lj L Ls , |
де |
L j |
|
j( j 1) , |
j 1 2, 1 2, |
|
L j , z m j , де m j |
j, j 1, , j . |
|
||||
5. Внаслідок спін-орбітальної взаємодії, залежної від орієнтації спіну, енергія стаціонарного стану збільшується або
зменшується на E n, , j, Z . Терм розщеплюється на два підтерми, тобто він у лужних металів стає дублетним.
Находкін М.Г., Харченко Н.П., Атомна фізика |
242 |
