
s5_atomfiz_exam_nah_book
.pdfГлава 8. Уявлення про будову атомів в квантовій механіці
kr=ka=2 a/ <1) у випадку хвильових функцій електрона в атомі водню, для якого
|
|
|
|
|
|
|
|
n,m |
R (r) m ( ) |
m |
( ) |
. |
(8.83) |
||
|
|
|
|
|
|
|
|
n |
|
|
|
||||
Знайдемо середнє значення x r sin cos |
|
|
|
|
|
|
|||||||||
|
2 |
|
|
m |
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m r |
2 |
sin d d . (8.84) |
|||||
x Rn |
Rn |
|
|
r sin cos m |
|
||||||||||
0 0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Інтеграли в (8.78) можна записати як добуток трьох інтегралів по r,
і, тому що функції R(r), ( ) і Ф( ) залежать лише від своєї змінної r,
або . За умовою, що <x> 0, знаходимо дозволений перехід. Це означає, що всі три інтеграли в (8.84) повинні не дорівнювати нулеві. Обмежимося розглядом інтеграла за змінною .
2 |
|
|
1 |
2 i(m m ) |
|
|
1 |
|
2 |
i(m m ) |
i |
|
i |
|
|||||
m cos m d |
|
e |
|
cos d |
|
|
e |
|
|
(e |
e |
|
)d |
||||||
2 |
|
4 |
|
|
|
|
|||||||||||||
0 |
|
|
2 |
|
|
0 |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
1 |
|
i ( m m 1) |
|
i ( m m |
1) |
|
|
|
|
|
||||||||
|
|
|
[e |
|
|
|
|
e |
|
|
|
|
|
]d 0 |
(8.85) |
||||
|
4 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Умова (8.85) виконується лише, коли |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
m 1 |
|
|
|
|
|
|
|
(8.86) |
||
За умовою, що <z> 0, де |
z = r cos , таким же способом отримаємо |
||||||||||||||||||
ще одну умову відбору |
|
|
m 0 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(8.86*) |
|||
Тому правило відбору для магнітного квантового числа m для дипольних спонтанних дипольних переходів має наступний вигляд
(8.87)
Аналогічно, аналізуючи інтеграл за , знайдемо правила відбору для орбітального числа , яке має такий вигляд для спонтанних дипольних переходів
1 |
(8.88) |
Зміна головного квантового числа n не обмежується. Воно може змінюватись на будь-яке число одиниць.
Ці правила відбору справедливі лише для спонтанних дипольних переходів. Вони іноді називаються правилами відбору Лапорта. Для інших випадків більш складних переходів, наприклад. квадрупольних та для вимушених переходів ці правила відбору
Находкін М.Г., Харченко Н.П., Атомна фізика |
213 |
Глава 8. Уявлення про будову атомів в квантовій механіці
ускладнюються. Квадрупольне випромінювання значно слабше дипольного (в 106 раз). Правила відбору при квадрупольних переходах змінюються: l 0, 2, ml 0, 1, 2 .
8.11.Висновки
1.Електрони в атомі водню та ізоелектронних атомів водню мають дискретні стаціонарні стани, енергія яких
визначається головним квантовим числом n = 1, 2, 3, 4,.....
En = - |
|
|
e 2 |
|
Z 2 |
, |
(8.89) |
|
2a0n 2 |
||||||||
|
|
|
|
|
||||
де а0 - радіус першої борівської орбіти. |
|
|
||||||
a 0 = |
|
|
h 2 |
|
. |
|
|
|
|
e 2 m 0 |
|
|
|
||||
|
|
|
|
|
||||
2. Для Е > 0 спектр енергії електронів неперервний |
|
|||||||
E = |
|
|
p 2 |
|
|
|
(8.90) |
|
|
2 m 0 |
|
|
|
||||
|
|
|
|
|
|
|
||
3. Скінчена маса ядра викликає ізотопічний зсуву Еn і спектральних ліній відповідно
E n = -Z |
2 e 2 |
1 |
1 |
(8.91) |
|||||
|
|
|
|
|
|
|
|||
2 a 0 1 + m 0 |
M n 2 |
||||||||
|
|||||||||
4. Електрон в атомі “розмазаний” у просторі у вигляді “електронної хмари”. Імовірність знайти електрон в елементарному об’ємі dV = r2Sin d d dr визначається
Rn (r)Rn (r) m ( , ) m ( , )r2 sin d d dr (8.92)
ізалежить не тільки від координат r, , , але й від
квантових чисел n, та m . При n = 1 і Z = 1 вона має максимум на відстані r1max = a0 і при збільшенні n rmax збільшується.
5. Стаціонарні стани визначаються трьома квантовими числами:
n - визначає енергію і набуває таких значень: n = 1,2,3,..., ;
- визначає абсолютну величину моменту кількості руху
Находкін М.Г., Харченко Н.П., Атомна фізика |
214 |
Глава 8. Уявлення про будову атомів в квантовій механіці
L2 2 ( 1) і для заданого числа n набуває таких значень:
0,1,2,3,...,n 1;
m - визначає проекцію моменту кількості руху на вісь z
Lz ml і для заданого числа набуває таких значень : ml 0; 1; 2; 3;...; .
6. Для даного |
квантового |
|
числа |
число mj |
набуває |
(2 1) |
|||||||||
значень |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
1 |
2 |
|
|
3 |
4 |
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Стан |
s |
|
p |
D |
|
F |
g |
|
h |
|
|
|||
|
|
1 |
|
3 |
5 |
|
|
7 |
9 |
|
11 |
|
|
|
|
|
2 +1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7. При |
заданому |
значенні n існує n2 станів |
|
|
|||||||||||
|
|
n 1 |
|
|
|
1 |
[ 2 ( n 1) ] |
|
|
|
|
||||
|
|
|
( 2 1) |
|
n n 2 |
, |
(8.93) |
||||||||
|
|
|
|
||||||||||||
|
|
0 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
або n2 - виродження.
8.В атомі водню існує стан з орбітальним квантовим числом
= 0, у якого момент кількості руху дорівнює нулеві
L 0 |
|
( 1) |
0 . |
(8.94) |
9. Стан з орбітальним квантовим числом = 0 не має також орбітального магнітного моменту
|
|
|
|
L |
|
|
e |
|
e |
|
|
|
|
0. |
|
|
|
|
|
|
( 1) |
( 1) |
(8.95) |
||||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
2m0c |
|
2m0c |
0 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
z |
|
|
|
Lz |
|
e |
|
e |
|
|
0m |
0 . |
|
|
|
|
|
( 1) |
||||||||
|
|
|
|
2m0c |
2m0c |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
10. Виродження за орбітальним числом знімається |
|||||||||||||
магнітним полем, |
|
бо |
енергія |
|
електрона в |
атомі, що |
|||||||
знаходиться в магнітному полі з напруженістю Н, залежить
від магнітного квантового числа m |
|
E n = En + 0Hm , |
(8.96) |
яке може мати 2 +1 значень.
Находкін М.Г., Харченко Н.П., Атомна фізика |
215 |
Глава 8. Уявлення про будову атомів в квантовій механіці
4s,4p,4d,4f |
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
4 |
0,1,2,3 |
|
|
|
|
|
|
|
|
|
|
|
|||
3s,3p,3d |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
3 |
0,1,2 |
||
2s,2p |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
2 |
0,1 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
серія |
серія |
|
||||
серія Лаймана |
|
|
|
Бальмера |
Пашена |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||
1s |
|
|
|
|
|
|
|
|
|
|
1 |
0 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
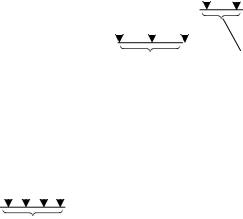
Рис.8.6. Схема термів і основних електронних переходів атома водню.
11. Спектральні лінії атома водню залежать лише від головного квантового числа n, бо енергія електрона в атомі водню не залежить від орбітального квантового числа, тобто має місце виродження по орбітальному числу . Якщо відсутнє зовнішнє магнітне поле, то існує ще й виродження за магнітним квантовим числом m.
8.12.Контрольні запитання та вправи
1.Як відображається специфічні властивості атома при розгляді його будови в квантовій механіці?
2.Як відображаються особливості поля центральних сил на просторовому розподілі ймовірності знаходження електронів в атомах?
3.Дайте визначення атомної орбіталі й наведіть приклади орбіталей атому водню.
4.Який фізичний зміст квантових чисел n, і m?
5.У чому полягає просторове квантування?
6.Проаналізуйте комутативність і не комутативність квадрату моменту кількості руху і його проекцій.
Находкін М.Г., Харченко Н.П., Атомна фізика |
216 |
Глава 8. Уявлення про будову атомів в квантовій механіці
7.Знайдіть середні значення <r> і <1/r> для електрона в атомі водню.
8.Знайдіть середні значення кінетичної й потенціальної енергій електрона в атомі водню в стані 1s.
9.Покажіть для атому водню, що Lx k1 і Lу k2 , де k1 і k2 - сталі. Який зміст має цей результат?
10.Знайдіть різницю між довжинами хвиль серії Бальмера в дейтерію, що виникає при переході електронів із рівня n = 3 на рівень з n = 2.
11.У чому причина появи правил відбору квантових чисел? 12.Знайдіть потенціал іонізації воднеподібного мезоатома з Z = 10. 13.Знайдіть енергію й момент імпульсу електронів в атомі водню, в
станах 2р, 3р і 3d?
14.Покажіть, що розмірність | | повинна бути см-3 для того, щоб вона вірно описувала густину ймовірності.
15.Покажіть, що якщо кожна з функцій 1 х і 2 х є розв’язком рівняння Шредінгера, то і їхня лінійна комбінація х а1 1 х а2 2 х) теж є рішенням того самого рівняння.
16.Обчисліть значення r, для якого r2 в 1s стані атома водню має максимум.
17.Знайдіть середнє значення хвильової функції в 1s стані атома водню. (Відповідь: 3а0/2)
18.Покажіть, що сума | | для всіх станів з 2р залежить лише від r і не залежить від і .
19.Знайдіть магнітний момент атома водню в стані 3d.
20.Знайдіть енергію стаціонарного стану 2р для воднеподібного атома з Z = 79.
Тестові завдання
1. ЯКІ ЧИСЛОВІ ЗНАЧЕННЯ МОЖУТЬ НАБУВАТИ НАЗВАНІ КВАНТОВІ ЧИСЛА АТОМІВ ІЗОЕЛЕКТРОННОГО РЯДУ ВОДНЮ?
1)головне квантове число;
2)орбітальне квантове число електрона
3)магнітне орбітальне квантове число.
Квантові числа можуть набувати числові значення з наступними характеристиками:
Находкін М.Г., Харченко Н.П., Атомна фізика |
217 |
Глава 8. Уявлення про будову атомів в квантовій механіці
1)позитивні;
2)від’ємні;
3)цілі числа, виключаючи 0 0,1,2,3, );
4)що дорівнюють тільки 0 ;
5)що дорівнюют 1 2 ;
2 ;
6)числа у вигляді змішаного дробу.
2.В ЯКИХ ІНТЕРВАЛАХ МОЖУТЬ ЗМІНЮВАТИСЬ НИЖЧЕ
ВКАЗАНІ КВАНТОВІ ЧИСЛА: 1) n , 2) , 3) ml ,.
Квантове число може змінюватися у межах:
1) 0 ; 2) 0 n 1; 3) 1 ; 4) |
0 ; 5) |
; 6) 1 n . |
4. ВІД ЯКИХ КВАНТОВИХ ЧИСЕЛ ЗАЛЕЖАТЬ У ЯВНОМУ ВИГЛЯДІ ФІЗИЧНІ ВЕЛИЧИНИ, ХАРАКТЕРНІ ДЛЯ АТОМА ВОДНЮ:
А) енергія електрона; Б) власний момент руху електрона;
Д) проекція орбітального моменту електрона.
Фізична величина залежить у явному вигляді від:
1)головного квантового числа;
2)орбітального квантового числа ;
3)магнітного квантового числа.
5.В ЯКИХ ВИПАДКАХ ТРЕБА ВРАХУВАТИ ПРАВИЛА ВІДБОРУ ДЛЯ КВАНТОВИХ ЧИСЕЛ:
1)при дипольних переходах;
2)при квадрупольних переходах;
3)при іонізації атомів;
4)при катодолюмінісценції;
5)в спектрах поглинання;
6)в спектрах випромінювання;
7)при фотолюмінесценції;
8)при термічному збудженні;
9)при збудженні електронним ударом.
Находкін М.Г., Харченко Н.П., Атомна фізика |
218 |
Глава 8. Уявлення про будову атомів в квантовій механіці
6. ЯКА КРАТНІСТЬ ВИРОДЖЕННЯ ЕНЕРГЕТИЧНОГО РІВНЯ АТОМА ВОДНЮ З ГОЛОВНИМ КВАНТОВИМ ЧИСЛОМ n=3 В НАБЛИЖЕННІ ТЕОРІЇ БОРА?
1) 3; 2) 5; 3) 6; 4) 9.
Лабораторні роботи
1.Спектр випромінювання атомарного водню (робота 3).
Овечко В.С., Харченко Н.П., Атомна фізика. Фізичний практикум.: Навчальний посібник, - К.: Видавничо-поліграфічний центр „Київський університет”, 2005. – 131 с.
2.Мультимедійна демонстрація
Література
1.Матвеев А.Н. Атомная физика. - М.: Высш. шк. ,1989. –489с. (
глава 7, §30 і 31).
2.Сивухин Д.В. Общий курс физики. Атомная и ядерная физика.
Часть 1.- М.: Наука. - 1986. 416 с. ( §27, §30...33).
3.Белый М.У., Охрименко Б.А. Атомная физика. Киев: «Вища шк.» . - 1984. -271с. ( §5.1.....5.3)
4.Соколов А.А., Тернов И.М., Жуковский В.Ч. Квантовая механика.
М.:Наука, - 1979, - 528, ( §10....12).
Додаткова література
1.Давыдов А.С., Квантовая механика, М.: Наука, 1973 (глава VI).
2.Вакарчук І.О., Квантова механіка: Підручник, - Львів, ЛНУ імені Івана Франка, 2004 (глава VII).
Задачі
1.Харченко Н. П., Прокопенко О. В., Карлаш Г. Ю. Атомна фізика в задачах. Академдрук, - 2007. – 336с. (розділи 4, 6).
2.Иродов И.Е. Задачи по квантовой физике, М.: Высшая школа, 1991
3.Мин Чен, Задачи по физике с решениями, М.: ИЛ, - 1978.
Находкін М.Г., Харченко Н.П., Атомна фізика |
219 |
Глава 8. Уявлення про будову атомів в квантовій механіці
4.Мультимедійні демонстрації. Графіки радіальної складової хвильової функції rRne та густини ймовірності для різних станів водневоподібного атома. Графіки густини ймовірності кутових складових хвильової функції для різних станів атома водню.
Находкін М.Г., Харченко Н.П., Атомна фізика |
220 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
Глава 9. ЕКСПЕРИМЕНТАЛЬНІ ДАНІ ПРО БУДОВУ ТА ВЛАСТИВОСТІ СКЛАДНИХ АТОМІВ
«Если смотреть прямым путем, хаос лишь виден, При взгляде вкривь рисуется закон».
В.Шекспир
9.1.Структура атомів лужних металів, валентний електрон. 9.2. Зняття виродження за квантовим числом . 9.3. Спектральні серії атомних спектрів лужних металів. 9.4. Дублетна структура термів та спектральних ліній атомів лужних металів. 9.5. Спін електрона. 9.6. Сума моментів кількості руху.
9.7.Тонка структура спектрів складних атомів як наслідок спін-орбітальної взаємодії. 9.8. Особливості тонкої структури атомних спектрів лужних металів. 9.9. Надтонка структура спектральних термів атомів лужних металів.
9.10.Висновки. 9.11. Контрольні запитання та вправи, тестові завдання. Література.
9.1. Структура атомів лужних металів, валентний електрон
Розрахунки енергетичної структури багатоелектронних атомів є складною задачею. Однак узагальненням властивостей атомів водню вдається пояснити основні властивості атомів лужних металів: літію (Li3), натрію (Na11), калію (К19), рубідію (Rb37), цезію (Cs55) і францію (Fr87).
Їх спектральні серії описуються узагальненою формулою Бальмера (4.10) з ефективним зарядом ядра Zеф Z та приведеною масою
m m0M 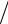 m0 M
m0 M
|
|
R |
Zеф2 |
|
1 |
1 |
|
|
||
|
|
|
|
|
|
|
|
, |
(9.1) |
|
|
1 m |
M |
n2 |
n2 |
||||||
|
|
0 |
|
|
1 |
|
|
|||
де R - стала Рідберга |
(R = e2/2a0hc), М - маса атомного ядра, а0 = |
|||||||||
2/e2m0 - радіус першої борівської орбіти, а n і n1 - квантові числа.
Їх перші потенціали іонізації - малі, а другі та треті потенціали іо-
нізації значно більші (таблиця 9.1) Vi3 > Vi2 > Vi1.
Таблиця 9.1. Перші і другі енергії іонізації лужних металів
|
H |
Li |
Na |
K |
Rb |
Cs |
|
|
|
|
|
|
|
еVi еВ |
13,6 |
5,37 |
5,12 |
4,32 |
4,16 |
3,88 |
еVi2еВ |
- |
121,9 |
71,3 |
31,45 |
27,14 |
23,3 |
Находкін М.Г., Харченко Н.П., Атомна фізика |
221 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
Вони одновалентні по відношенню до Н й утворюють сполуки: LiF, NaCl, CsCl, RbBr тощо.
Всі ці факти свідчать, що атоми лужних металів можна розглядати як воднеподібні атоми із одним валентним електроном,
що знаходиться в кулонівському полі атомного ядра, екранованого сильно зв’язаними електронами (Zеф Z).
9.2. Зняття виродження за квантовим числом
Стаціонарні стани валентного електрона в атомах лужних металів залежать від 3-х квантових чисел, як і в атомі водню: n, , m , але вони мають інші властивості з двох причин. По-перше, екранування атомного ядра сильно зв’язаними електронами змінює електричне поле в атомі, яке діє на зовнішній валентний електрон, що враховується ефективним зарядом ядра Zеф Z. По-друге, валентний електрон поляризує атомний остов, який складається з ядра і сильно зв’язаних електронів, створюючи з нього диполь, квадруполь тощо (рис.9.1), що також змінює внутрішньоатомне електричне поле в об-
|
|
|
|
e |
|
|
|
e |
|
e e |
|
|
|
|
e |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
e |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
e |
|
|
|
|
e |
|
e |
|
|
|
|
|
e |
|
|
|
e |
|||||||||||||||||
|
|
|
|
|
e |
|
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
e |
||||||||
e |
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
e |
|
|
e |
|
|
|
e |
|
e |
e |
|
|
|
e |
|
|
|
|
e |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис.9.1. Схема збурення атомного остову валентним електроном.
ласті руху валентного електрона. Потенціал внутрішньоатомного електричного поля такої збуреної системи атомного остову зручно навести у вигляді ряду
U (r) |
e2 Z |
a |
C1 |
e2 Z |
a |
C2 |
e2 Z |
a |
, |
(9.2) |
r |
|
r2 |
|
r3 |
|
|||||
де С1 та С2 - розмірні коефіцієнти |
(С1 [см] і С2 [cм2]). Перший член - |
|||||||||
дипольний, другийквадрупольний і т.д.
Находкін М.Г., Харченко Н.П., Атомна фізика |
222 |
