
s5_atomfiz_exam_nah_book
.pdf
Глава 9. Експериментальні дані про будову та властивості складних атомів
C 2 |
|
|
|
C1 |
|
1 |
для r a0. |
|
r 2 |
r |
|||||||
|
|
|
|
|
|
Обмежившись дипольним членом, підставимо (9.2) у радіальну частину рівняння Шредінґера для стаціонарних станів, а кутова частина рівняння Шредінґера (8.14) залишається незмінною, бо до неї не входить U(r)
|
2m0 |
|
2 |
Za |
|
2 |
Za |
|
2 |
( 1) |
|
r R |
E |
e |
C |
e |
|
|
R 0 . |
||||
2 |
r |
|
|
2m r3 |
|||||||
|
|
1 |
r2 |
|
|||||||
|
|
|
|
|
|
|
|
|
0 |
||
|
|
|
|
|
|
|
|
|
|
|
|
Введемо нове квантове число * за допомогою співвідношення
|
C |
|
e 2 Z a |
|
|
2 ( 1) |
|
|
2 * ( * 1) . |
|
|||||||||||||||||||||||
|
1 |
r 2 |
|
|
|
|
|
2 m |
0 |
r 2 |
|
|
|
|
2 m |
0 |
r 2 |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Із (9.4) знайдемо |
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
2 |
|
|
|
2 C |
|
|
|
2 Z |
a |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
0 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a 0 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
4C1 Z a |
. |
||||||||||||||||
|
|
[1 (1 |
2 |
) 1 |
|
|
8C1 Z a |
|
|
||||||||||||||||||||||||
2 |
a |
|
|
2 |
a |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
(1 |
2 )2 |
|
|
|
|
|
|
|
|
0 |
(1 2 ) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
(9.3)
(9.4)
(9.5)
(9.5*)
У (9.5*) використаний перед коренем квадратним знак плюс, бо * > 0, тому знак мінус не має фізичного змісту.
|
|
|
C 1 Z a |
|
|
, |
(9.6) |
|
|
|
1 |
|
|||||
|
|
a 0 |
|
|
|
|
||
|
|
|
|
|
|
|||
|
2 |
|
||||||
|
|
|
|
|
|
|
||
де квантовий дефект * дорівнює
|
|
|
C1Z a |
|
. |
(9.7) |
|
a0 1 |
2 |
Енергія стаціонарного стану для воднеподібних атомів визначається за формулою
2 |
1 |
|
|
e2 |
. |
(9.8) |
En, Za |
|
|
|
|
|
|
1 m0 |
M |
2a0 (nr 1 )2 |
|
|
Підставивши значення * із (9.6) в (9.8) і використавши вираз (8.63) для головного квантового числа атома водню (n=nr+1+ ), отримаємо:
nr+1+ * = nr+1+ - * = n - * . |
(9.9) |
Підставимо (9.9) у (9.8)
Находкін М.Г., Харченко Н.П., Атомна фізика |
223 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
|
|
2 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
e2 |
|
|
|
|
|
|
|
|
|
(9.10) |
||||||||
|
En, Za |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 m |
|
|
|
M |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
0 |
|
2a |
n2 |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
n |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
або |
|
E n , |
|
|
|
|
|
Z е2ф |
|
|
|
|
|
|
e 2 |
|
|
, |
|
|
|
(9.11) |
|||||||||||||
|
|
1 m 0 M |
|
|
2 a0 n 2 |
|
|
|
|||||||||||||||||||||||||||
де |
Z e ф |
= |
|
|
|
Z a |
|
|
|
|
|
|
Z a + |
|
|
Z a |
= Z a |
+ |
|
C |
1 Z a2 |
|
|
(9.12) |
|||||||||||
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
1 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a0 |
|
1 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
||||||||||||||
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Таким чином, виявляється, що енергія стаціонарних станів в атомах лужних металів залежить не тільки від головного квантового числа n але й від орбітального квантового числа , бо наявність екра-
нуючих електронів та поляризації атомного остову створює внут-
рішнє поле в атомі, яке знімає виродження в атомах лужних металів.
9.3. Спектральні серії атомних спектрів лужних металів
Система термів - енергій стаціонарних станів валентного електрона атомів лужних металів, що залежать від двох квантових чисел n і , наведена в таблиці 9.2 та на енергетичних діаграмах
Таблиця 9.2. Система термів лужних металів.
|
S |
p |
D |
f |
G |
H |
|
|
|
|
|
|
|
n\ |
0 |
1 |
2 |
3 |
4 |
5 |
1 |
1S |
- |
- |
- |
- |
- |
2 |
2S |
2P |
- |
- |
- |
- |
3 |
3S |
3P |
3D |
- |
- |
- |
4 |
4S |
4P |
4D |
4F |
- |
- |
5 |
5S |
5P |
5D |
5F |
5G |
- |
6 |
6S |
6P |
6D |
6F |
6G |
6H |
(рис.9.1-9.3). Між термами можуть відбуватись дипольні переходи, коли виконуються правила відбору орбітального квантового числа= 1. Дипольні переходи мають місце, коли розміри атомів менші за довжину хвилі фотона, що випромінюється (а0 < ). У цьому разі ймовірність переходу пропорційна матричному елементу дипольного переходу
Находкін М.Г., Харченко Н.П., Атомна фізика |
224 |
Глава 9. Експериментальні дані про будову та властивості складних атомів |
|||||
|
|
4 3 d |
2 |
(9.13) |
|
|
|
w |
12 |
, |
|
|
|
3c3 |
|
|
|
де d12 1 ex 1d 3r - дипольний момент. |
|
||||
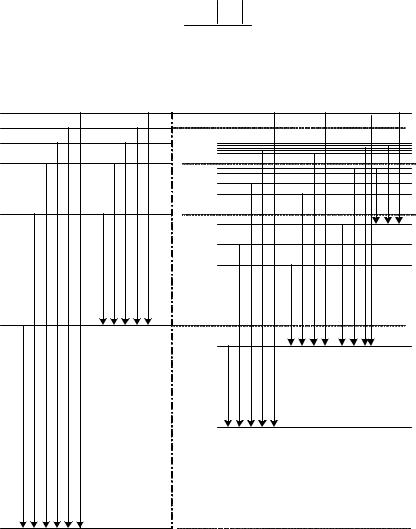
Окремі лінії можна згрупувати в |
серії (рис.9.2). |
|
|||
n 6 |
|
5S5P5D5F5G |
|
||
5SP5D5F5G |
|
|
|||
4S4P4D4F |
|
4F |
|
|
|
|
|
4D |
|
|
|
|
|
4P |
|
|
|
3S3P3D |
|
4S |
|
|
|
|
|
|
|
|
|
|
|
3D |
|
|
fundamental |
|
|
3P |
|
|
|
|
|
|
|
|
|
|
|
3S |
|
|
|
2S2P |
|
|
|
|
|
|
|
2P |
|
sharp |
diffusion |
|
|
|
|
||
|
|
2S |
|
|
|
|
|
|
pricipal |
|
|
1 S |
H |
|
|
Li |
|
Рис.9.2. Схема термів і переходів між ними для атомів водню і літію. |
|||||
Головна серія (principal) включає переходи між P і S станами
*Li = 2S - nP |
, де |
n = 2, 3, 4... |
*Na = 3S - nP |
, де |
n = 3, 4, 5,.. |
*K = .4S - nP , де |
n = 4, 5, 6,... |
|
*Rb = 5S - nP |
, де |
n = 5, 6, 7,.. |
*Cs = 6S - nP |
, де |
n = 6, 7, 8,... |
Находкін М.Г., Харченко Н.П., Атомна фізика |
225 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
Довжини хвиль ліній випромінювального спектра цієї серії рівні довжинам хвиль відповідних ліній спектра поглинання. Такі лінії в спектроскопії називаються резонансними. Вони легко збуджуються, інтенсивні і спостерігаються навіть у спектрах поглинання холодних не збуджених додатково парах металів.
Різка серія (sharp) або друга побічна включає переходи між S і P станами
*Li = 2P - nS |
n = 3, 4, 5,... |
*Na = 3P - nS |
n = 4, 5, 6,... |
*К = 4P - nS |
n = 5, 6, 7,.. |
*Rb = 5P - nS |
n = 6, 7, 8,.. |
Находкін М.Г., Харченко Н.П., Атомна фізика |
226 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
|
|
2S1/2 |
|
|
|
|
|
|
2P3/21/2 |
|
|
|
|
|
2D5/2 7/2 |
|
||||||||
|
|
s |
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5d |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
4s |
|
|
|
|
|
|
|
4p |
|
|
|
|
4d |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
,2 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
2 |
0 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|||||||
4 |
|
|
8 |
|
|
|
|
|
|
|
|
|
, |
|
7 |
|
7 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|||||||||||
|
|
3 |
|
|
|
|
|
|
|
|
2 |
|
|
|
6 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|||||||||
|
|
|
|
8 |
|
3p |
|
|
|
3 |
|
|
|
|
|
|
9 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
||||||||||
|
|
|
|
, |
|
|
1 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
||||||
|
|
|
|
2 |
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
||||||
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|||||
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
3s |
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
1 |
|
|
|
|
|
|
|
, |
0 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
9 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
3 |
|
8 |
|
|
|
|
|
|
|
6 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|||
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
1 |
0 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,84 |
|
3 |
|
|
|
|
|
|
2p |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
, |
|
|
|
|
, |
8 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
2s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2F7/25/2 f
cм
6f
5000
5f
10000
15000
20000
25000
30000
35000
40000
45000
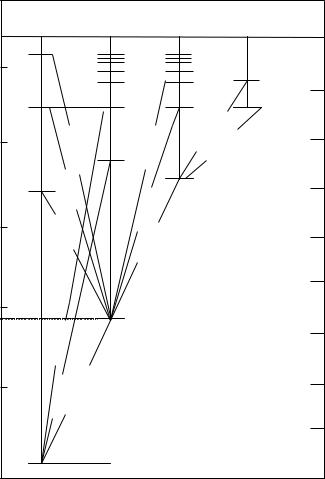
Рис.9.3.Схема рівнів енергії і переходів для атома літію.
*Cs = 6P - nS |
n = 7, 8, 9,... |
Находкін М.Г., Харченко Н.П., Атомна фізика |
227 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
Рис.9.4. Схема енергетичних рівнів і переходів між ними для атомів натрію.
Лінії цієї серії різкі. Вони знаходяться в більш довгохвильовому діапазоні довжин хвиль, ніж лінії головної серії. В спектрах не збуджених „холодних” парів лужних металів не спостерігається інверсії (обертання) ліній, тобто в холодних парах не спостерігається спектрів
Находкін М.Г., Харченко Н.П., Атомна фізика |
228 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
поглинання (вбирання) цієї |
серії. В збуджених (нагрітих) парах |
|
з’являються лінії спектра поглинання (вбирання). |
||
Дифузна серія (diffusion) |
або перша побічна виникає при пере- |
|
ході валентного електрона із nD рівнів на (n - 1)P рівні. |
||
*Li = 2P - nD |
n = 3, 4, 5,... |
|
*Na = 3P - nD |
n = 4, 5, 6,... |
|
*K = 4P - nD |
n = 5, 6, 7,... |
|
*Rb = 5P - nD |
n = 6, 7, 8,.. |
|
*Cs = 6p - nD |
n = 7, 8, 9,... |
|
Лінії цієї серії дещо розмиті. |
|
|
Фундаментальна серія (fundamental) виникає при переходах |
||
валентного електрона із nF рівнів на (n - 1)D рівні. |
||
*Li = 3D - nF |
n = 4, 5, 6,.. |
|
*Na = 3D - nF |
n = 4, 5, 6,... |
|
*k = 4D - nF |
n = 5, 6, 7,... |
|
*Rb = 5D - nF |
n = 5, 6, 7,.. |
|
*Cs = 6D - nF |
n = 6, 7, 8,.. |
|
9.4. Дублетна структура термів та спектральних ліній атомів лужних металів
Дослідним шляхом було встановлено, що спектральні лінії атомних спектрів лужних металів мають складну тонку структуру. Кожна лінія головної і різкої серій – дублети, бо складається із двох близьких ліній, а лінії дифузної й фундаментальної серій - три-
плети. Різниці частот між окремими лінями тонкої структури по різному залежать від головного квантового числа n: у дублетів головної серії вона зменшується із збільшенням квантового числа ( = 1 - 2 n-3), у ліній різкої серії не залежить від n, у триплетів дифузної серії різниця частот 12 = 1 - 2 не залежить від n а 23 = 2 - 3 n-3 зменшується обернено пропорційно кубу головного квантового числа тощо. Наявність тонкої структури свідчить, що енергія електро-
нів залежить не тільки від квантових чисел n і . Мультиплетна структура не знайшла пояснення в межах не релятивістської теорії, що базується на основі рівняння Шредінґера. Отже потрібно було шукати нові причини появи тонкої структури термів та мультиплетності спектральних ліній. Виникла необхідність припустити, що електрону притаманна внутрішній ступінь свободи.
Находкін М.Г., Харченко Н.П., Атомна фізика |
229 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
9.5.Спін електрона
В20-х роках ХХ століття виникла гіпотеза, що електрон має
власний момент кількості руху - спін. До цього спонукали такі екс-
периментальні факти, які без уведення спіну не вдавалось пояснити:
мультиплетна структура спектральних ліній;
експериментального значення гіромагнітного фактору g = 2, за-
мість розрахованого для орбітального моменту gрозрах = 1
, z |
|
|
e |
|
g |
|
, де g = 1; |
L , z |
|
2m |
|
|
|||
|
|
0 c |
|
|
|||
наявність у не збудженого атома Н в стані 1S магнітного моменту
( 1S,Н , тоді як водень не повинен його мати ( 1S,Н = 0);
розщеплення атомних спектральних ліній в неоднорідному магнітному полі (досліди Штерна і Герлаха розділ 15.5) на парну кількість складових компонентів, тоді як атоми з орбітальними ма-
гнітними моментами можуть розщепитись лише на непарне число компонент.
Всі ці факти примусили припустити, що електрон має власний магнітний момент кількості руху LS, який був названий спі-
ном. Цю гіпотезу в 1925 році висунули американські вчені Юленбек і Гаудсміт, згідно якої спін електрона за абсолютною величиною дорівнює
Ls |
|
s s 1 |
, |
(9.14) |
де s -спінове квантове число, яке для електрона рівне
s |
1 |
. |
(9.15) |
|
2 |
||||
|
|
|
||
Проекція спіну на вісь z визначається за формулою |
|
|||
Lz mS , |
mS =s, s-1, |
(9.16) |
||
де mS - магнітне спінове число, яке може мати 2 значення: 1/2 і -1/2. Електронному спіну відповідає спіновий магнітний момент,
який за абсолютною величиною визначається із співвідношення
|
S |
|
|
g |
S |
e |
|
, |
(9.17) |
L S |
2 m |
|
|||||||
|
|
0 c |
|
||||||
Находкін М.Г., Харченко Н.П., Атомна фізика |
230 |
Глава 9. Експериментальні дані про будову та властивості складних атомів
де gS =2 - гіромагнітний фактор спіну. Аналогічно для проекції спінового магнітного моменту маємо
z,S |
|
g |
|
e |
|
|
|
|
|
(9.18) |
|
L |
|
||||
|
|
S 2m c |
|||
z,S |
|
|
0 |
|
|
Нагадаємо, що в рівнянні Шредінґера спін не враховувався, бо воно не релятивістське. Спін це квантова величина, яка не має класичного аналога, хоча іноді його намагаються представити як
власний момент кількості руху електрона, в якому маса, що рівно-
мірно розподілена по колу радіуса r, рухається навколо осі з лінійною швидкістю v. Однак, за допомогою класичних образів не вдається описати властивості спіну.
9.6. Сума моментів кількості руху
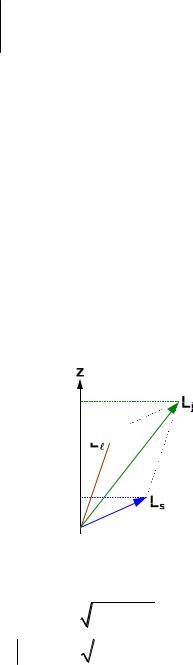
Коли атом має орбітальний момент L і спін Ls , то вони векторно
складаються і утворюють сумарний момент кількості руху (сумарний кутовий момент) (рис.9.5).
Lj L Ls . |
(9.19) |
Lj,z = mj
L ,z = m 

Ls,z = ms
Рис.9.5. Схема складання орбітального і спінового моментів.
Кожний із векторів цієї суми квантований, тобто повинен визначатись за абсолютною величиною квантовими числами , s, j
|
Ll |
|
|
|
|
|
|
|
|
( 1) , |
(9.20) |
||||
LS |
|
|
|
, |
|
||
|
s( s 1) |
(9.21) |
|||||
Находкін М.Г., Харченко Н.П., Атомна фізика |
231 |

Глава 9. Експериментальні дані про будову та властивості складних атомів
|
|
|
|
|
LJ |
|
j( j 1) , |
(9.22) |
|
де введено нове квантове число j, яке визначає сумарний момент кількості руху за абсолютною величиною. Проекції моментів кількості руху, як і раніше, визначаються магнітними квантовими числами m , ms , mj за формулами
L z m , |
|
|
|
|
|
|
m 0, 1, 2, , |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
Lsz ms , |
|
|
|
|
|
|
ms |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||||
L |
|
m |
|
, |
m |
|
|
|
|
|
2 |
|
(9.23) |
||
jz |
j |
j |
j, j 1, j 2, , j 1 , , j |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Кожний із векторів |
L |
, |
L |
, L |
j |
здійснює прецесію1 |
навколо осі z, тому |
||||||||
|
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
визначеними будуть лише їх абсолютні величини і проекції на вісь z.
Знайдемо тепер максимальне і мінімальне значення квантових чисел jmax та jmin. Максимальне значення квантового числа jmax отримаємо, коли вектори jmax і jmin паралельні. В цьому випадку
jmax m max ms max s .
Коли ці вектори антипаралельні, то маємо jmin
|
jmin |
|
m max ms max |
|
s |
|
||
|
|
|
|
|||||
Отже квантове число j повинно знаходитись у межах |
||||||||
|
s |
|
j s |
(9.25) |
||||
|
|
|||||||
Нерівність (9.25) дозволяє визначити всі можливі значення квантового числа j, бо вони відрізняються одне від іншого на ціле число. Для перевірки цього твердження запишемо можливу кількість станів
вектора L . Вона визначається кількістю можливих станів числа m
тобто числом (2 +1). Кількість станів вектора L s визначається спів-
1 Прецесія (від лат. preccesio - передування, виступ попереду) -рух твердого тіла, що має нерухому точку, який складається із обертання навколо осі, жорстко зв'язаної з тілом, і обертання навколо деякої іншої осі, яка проходить крізь цю нерухому точку. Прецесією гіроскопа називається обертання осі гіроскопа навколо нерухомої осі. Вісь гіроскопа описує при цьому круговий конус.
Находкін М.Г., Харченко Н.П., Атомна фізика |
232 |
