
pat_phy_book
.pdfпатологического гемоглобина (гемоглобиназы) и нарушения свертывания крови при появлении патологических фибриногенов.
К необычным белкам крови относятся криоглобулины, способные выпадать в осадок при температуре ниже 37°С, что ведет к тромбообразованию. Их появление сопровождает нефроз, цирроз печени и другие заболевания.
Патология межуточного белкового обмена (нарушение обмена
аминокислот). Основные пути межуточного обмена белка составляют реакции переаминирования, дезаминирования, амидирования,
декарбоксилирования, переметилирования, пересульфирования.
Центральное место в межуточном обмене белков занимает реакция
переаминирования как основной источник образования новых аминокислот.
Нарушение переаминирования может возникнуть в результате недостаточности в организме витамина В6. Это объясняется тем, что фосфорилированная форма витамина В6 — фосфопиродоксаль является активной группой трансаминаз — специфических ферментов переаминирования между амино- и кетокислотами. Беременность,
длительный прием сульфамидов тормозят синтез витамина В6 и могут послужить основой нарушения обмена аминокислот. Патологическое усиление реакции переаминирования возможно в условиях повреждения печени и инсулиновой недостаточности, когда значительно увеличивается содержание свободных аминокислот.
Наконец, причиной снижения активности переаминирования может послужить угнетение активности трансаминаз вследствие нарушения синтеза этих ферментов (при белковом голодании), либо нарушение регуляции их активности со стороны ряда гормонов.
Так, тирозин (незаменимая аминокислота) как поступающий с белками пищи, так и образующийся из фенилаланина, частично окисляется в печени до фумаровой и ацетоуксусной кислот. Однако это окисление тирозина
221
совершается только после его переаминирования альфа-кетоглутаровой кислотой.
При белковом истощении переаминирование тирозина заметно ослаблено, вследствие этого нарушено его окисление, что приводит к увеличению содержания тирозина в крови. Накопление тирозина и крови и выделение его с мочой может быть связано и с наследственно обусловленным дефектом тирозинаминотрансферазы.
Клиническое состояние, развивающееся в результате этих нарушений,
известно под названием тирозиноз. Для болезни характерны цирроз печени,
рахитоподобные изменения костей, геморрагии, поражения канальцев почек.
Процессы переаминирования аминокислот тесно связаны с процессами окислительного дезаминирования, в ходе которого осуществляется ферментативное отщепление аммиака от аминокислот. Дезаминирование определяет как образование конечных продуктов белкового обмена, так и вступление аминокислот в энергетический обмен. Ослабление дезаминирования может возникнуть вследствие нарушения окислительных процессов в тканях (гипоксия, гиповитаминозы С, РР, В2). Однако наиболее резкое нарушение дезаминирования наступает при понижении активности аминооксидаз, либо вследствие ослабления их синтеза (диффузное поражение печени, белковая недостаточность), либо в результате относительной недостаточности их активности (увеличение содержания в крови свободных аминокислот).
Следствием нарушения окислительного дезаминирования аминокислот будет ослабление мочевинообразования, увеличение концентрации аминокислот и увеличение выведения их с мочой — аминоацидурия.
Межуточный обмен ряда аминокислот совершается не только в форме переаминирования и окислительного дезаминирования, но и путем их
декарбоксилирования (потеря СО2 из карбоксильной группы) с образованием соответствующих аминов, получивших название «биогенные амины».
222
Так, при декарбоксилировании гистидина образуется гистамин,
тирозина — тирамин, 5-гидрокситриптофана — серотонин и т.д. Эти амины биологически активны и оказывают выраженное фармакологическое действие на сосуды. Если в норме они образуются в малых количествах и довольно быстро разрушаются, то при нарушении декарбоксилирования создаются условия для накопления в тканях соответствующих аминов и проявления их токсического действия. Причинами нарушения процесса декарбоксилирования могут служить усиление активности декарбоксилаз,
торможение активности аминоксидаз и нарушение связывания аминов белками.
Изменение скорости распада белка. Белки организма постоянно находятся в динамическом состоянии, в процессе непрерывного распада и биосинтеза. Нарушение условий, необходимых для существования этого подвижного равновесия, также может привести к развитию общей белковой недостаточности.
Обычно полупериод существования разных белков колеблется в пределах от нескольких часов до многих суток. Так, биологическое время уменьшения наполовину альбумина человеческой сыворотки составляет около 15 суток. Величина этого периода в значительной степени зависит от количества белков в пище: при уменьшении содержания белков он увеличивается, при увеличении — уменьшается. Значительное увеличение скорости распада белков тканей и крови наблюдается при повышении температуры организма, обширных воспалительных процессах, тяжелых травмах, гипоксии, злокачественных опухолях и т.д., что связано либо со значительным увеличением активности протеолитических ферментов крови
(при гипоксии), либо с токсическим действием продуктов распада тканей
(при травмах).
В большинстве случаев ускорение распада белков сопровождается развитием в организме отрицательного азотистого баланса в связи с преобладанием процесса распада белков над их биосинтезом.
223
Патология конечного этапа белкового обмена. Основными конечными продуктами белкового обмена являются аммиак и мочевина.
Патология конечного этапа белкового обмена может проявляться нарушением образования конечных продуктов, либо нарушением их выведения.
Связывание аммиака в тканях организма имеет большое физиологическое значение, так как аммиак обладает токсическим эффектом,
прежде всего, в отношении центральной нервной системы, вызывая ее резкое возбуждение. Связывание и обезвреживание аммиака осуществляется при помощи двух механизмов:
 в печени — путем образования мочевины;
в печени — путем образования мочевины;
 в других, тканях — путем присоединения аммиака к глутаминовой кислоте (посредством аминирования) с
в других, тканях — путем присоединения аммиака к глутаминовой кислоте (посредством аминирования) с
образованием глутамина.
Основным механизмом связывания аммиака является процесс образования мочевины в цируллин-аргининорнитиновом цикле.
Нарушения образования мочевины могут наступить при снижении активности ферментных систем, участвующих в этом процессе (гепатиты,
цирроз печени), и общей белковой недостаточности. При нарушении мочевинообразования в крови и тканях накапливается аммиак и увеличивается концентрация свободных аминокислот, что сопровождается развитием гиперазотемии.
При тяжелых формах гепатитов и цирроза печени, когда резко нарушена ее мочевинообразовательная функция, развивается выраженная аммиачная интоксикация (нарушение функций центральной нервной системы).
В основе нарушения образования мочевины могут лежать наследственные дефекты активности ферментов. Так, увеличение концентрации аммиака в крови (аммониемия) может быть связано с блокированием карбамилфосфатсинтетазы и орнитинкарбомоилтрансферазы,
224

катализирующих связывание аммиака и образование орнитина. При наследственном дефекте аргининсукцинатсинтетазы в крови резко увеличивается концентрация цируллина, в результате чего с мочой экскретируется цируллин (до 15 г в сутки) — развивается цируллинурия.
В таких органах и тканях, как мышцы, нервная ткань, аммиак связывается в реакции амидирования с присоединением к карбоксильной группе свободных дикарбоновых аминокислот. Главным субстратом служит глутаминовая кислота. Нарушение процесса амидирования может иметь место при снижении активности ферментных систем, обеспечивающих реакцию (глутаминаза) или в результате интенсивного образования аммиака в количествах, превосходящих возможности его связывания.
Другим конечным продуктом белкового обмена, образующимся при окислении креатина (азотистое вещество мышц), является креатинин. При этом нормальное суточное содержание креатинина в моче составляет около
1-2 г.
Креатинурия — повышение уровня креатинина в моче.
В норме наблюдается у беременных женщин и у детей в период интенсивного роста. При голодании, авитаминозе Е, лихорадочных инфекционных заболеваниях, тиреотоксикозе и ряде других заболеваний, при которых имеют место нарушения обмена в мышцах, креатинурия свидетельствует о нарушении креатинового обмена.
Еще одна общая форма нарушения конечного этапа белкового обмена возникает при нарушении выведения конечных продуктов пелкового обмена при патологии почек. Нарушение выделительной функции почек (нефриты)
обусловливает задержку мочевины и иных азотистых продуктов в крови;
накапливается остаточный азот и как следствие развивается гиперазотемия.
Крайней степенью нарушения экскреции азотистых метаболитов является
уремия.
225
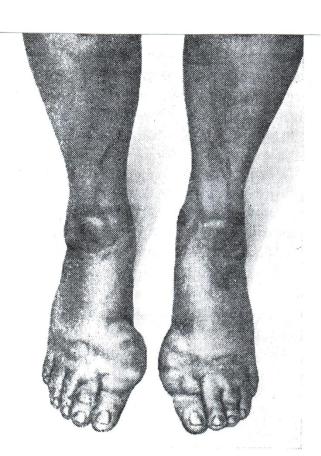
При одновременном поражении печени и почек возникает нарушение образования и выделения конечных продуктов белкового обмена.
Клинически это может проявляться в виде подагры.
Мочевая кислота — это конечный продукт обмена пуриновых оснований, входящих в структуру нуклеиновых кислот, которыми особенно богаты ядра клеток. При подагре соли мочевой кислоты задерживаются в организме и откладываются в тканях, в основном в сухожилиях, суставных
капсулах, хрящах, вызывая реактивное воспаление.
Причины подагры: избыточное поступление в организм пуринов
(пища, богатая мясом, вино и пиво) или молибдена (наблюдается в районах с повышенным содержанием его в почве). Молибден входит в состав ксантиноксидазы, переводящей ксантин в гипоксантин, который затем
превращается в мочевую кислоту.
Имеет значение конституциональное предрасположение в виде гиперурикемии, наследуемое по доминантному типу, пол и возраст
(чаще развивается в пожилом возрасте, преимущественно у мужчин).
Процесс развития подагры включает в себя несколько звеньев:
1. Накопление мочекислых соединений в организме (связано с недостаточным выделением их почками и усиленным
образованием их из глицина).
2. Отложение солей мочевой кислоты в тканях (в местах со
226
слабым кровоснабжением; рН ткани — кислая, а в кислой среде натриевая соль мочевой кислоты легче выпадает в осадок).
3. Острое подагрическое воспаление (возникает в суставах, в которых наблюдается отложение уратов и сопровождается недомоганием,
лихорадкой, ухудшением состояния). Сустав резко болезненен, отечен,
гиперемирован. Заболевание заканчивается образованием подагрических узлов в мелких суставах, либо деформацией крупных суставов.
4. Аллергический компонент в развитии приступа (крапивница,
эозинофилия и др.). Сам характер течения болезни — периодичность приступов, провокация их факторами внешней среды (например, изменением атмосферного давления), внезапность развития и острый характер воспалительных явлений — указывает на возможность участия в патогенезе данного заболевания аллергического компонента. При лечении подагры целесообразно применять лекарства с различным механизмом действия:
препараты, уменьшающие отложение солей мочевой кислоты в тканях
(щелочное питье, уродан), лекарственные средства, ингибирующие образование мочевой кислоты (угнетающие фермент ксантиноксидазу,
участвующующие в синтезе мочевой кислоты) — аллопуринол и другие,
препараты, способствующие урикурии (атофан и др.) и
десенсибилизирующие средства (димедрол, тавегил и др.).
Подагра часто отмечается в некоторых странах Западной Африки,
встречаются случаи довольно тяжелого ее течения. Этим заболеванием страдают преимущественно представители зажиточных слоев населения,
ведущие европеизированный образ жизни.
Наряду с общими нарушениями белкового обмена при белковой недостаточности могут возникать и специфические нарушения в обмене отдельных аминокислот. В педиатрической практике особое место принадлежит наследственным аминоацидопатиям. В настоящее время насчитывается около 60 различных нозологических форм.
227
По типу наследования почти все они относятся к аутосомнорецессивным. Патогенез обусловлен недостаточностью того или иного фермента, осуществляющего катаболизм и анаболизм аминокислот.
Общим биохимическим признаком аминоацидопатий служит ацидоз тканей и аминоацидурия. Наиболее частыми наследственными дефектами обмена являются четыре энзимопатии, которые связаны друг с другом общим путем метаболизма аминокислот: фенилкетонурия, тирозинемия, альбинизм,
алькаптонурия.
Фенилкетонурия характеризуется умственным недоразвитием ребенка, возникающим в течение первых 2-3 лет жизни. В основе патогенеза болезни лежит недостаточность фермента фенилаланин-4-гидроксилазы,
которая катализирует превращение пищевого фенилаланина в аминокислоту тирозин. Блокада превращения фениналанина в тирозин приводит к гиперфенилаланинемии. Продукты метаболизма фенилаланина, в частности кетокислота фенилпируват, оказывают токсическое воздействие на нервную систему. Фенилпируват появляется в моче и дает зеленую окраску с трихлорным железом, что служит ранней диагностикой фенилкетонурии у новорожденных.
Альбинизм. Основные проявления заболевания — отсутствие меланина в клетках кожи, волос, радужной оболочке глаз и повышенная чувствительность к ультрафиолетовому облучению. Клиническую картину альбинизма создает мутационная блокада активности фермента тирозиназы,
катализирующей синтез меланина и тирозина.
Нарушение белкового состава крови проявляется либо в его снижении (гипопротеинемия), либо в повышении (гиперпротеинемия).
Гипопротеинемия появляется чаще всего вследствие снижения количества альбуминов и встречается при различных видах голодания,
заболеваниях печени, кровопотере, наследственных нарушениях синтеза белка и потере белка при нарушении его реабсорбции в почках.
228
Гиперпротеинемия возникает при сгущении крови за счет повышения количества глобулинов, в основном -глобулинов (абсолютная).
Для нормализации белкового обмена применяются в зависимости от показаний либо средства, стимулирующие синтез белков (витамины,
анаболические средства), либо ингибирующие синтез белков (цитостатики,
антиметаболиты и др.).
Базисные понятия (определения)
Анаболизм — ферментативный синтез клеточных компонентов,
совершающийся с потреблением энергии.
Ассимиляция — усвоение питательных веществ.
Диссимиляция — расщепление питательных веществ.
Катаболизм — совокупность химических реакций распада сложных органических веществ в организме.
Метаболизм — обмен веществ в организме.
229

Глава 9
Инфекционный процесс. Лихорадка
9.1. Инфекционный процесс
Инфекционный процесс – это динамически развивающиеся патологические, защитно-приспособительные и компенсаторные реакции, возникающие в результате инфекции.
Под инфекцией следует понимать сложный комплекс взаимодействия двух самостоятельных биосистем – макроорганизма и микроорганизма в определенных условиях внешней, а для человека и социальной среды.
Инфекционный процесс может проявляться на всех уровнях организации биологической системы (организма человека) –
субмолекулярном, субклеточном, клеточном, тканевом, органном,
организменном – и составляет сущность инфекционной болезни.
Собственно инфекционная болезнь – это частичное проявление инфекционного процесса, крайняя степень его развития, т.е. взаимодействие возбудителя и макроорганизма необязательно и далеко не всегда приводит к заболеванию. Инфицированность еще не означает, что болезнь развивается.
Кроме того, инфекционная болезнь является лишь одной из форм инфекционного процесса.
Следует отметить те общие для всех инфекционных болезней признаки, которые отличают их от других заболеваний. Прежде всего, это наличие возбудителя, заразительность, реакция организма на возбудитель,
цикличность течения, формирование постинфекционного иммунитета.
Формы взаимодействия инфекционного агента с организмом человека может быть различными, и зависят от условий инфицирования, биологических
230
