
pat_phy_book
.pdfфибринолитической, как правило, приводит к внутрисосудистому свертыванию крови (ВССК) и тромбозу.
ВССК обусловлено быстрым и значительным поступлением в сосудистое русло факторов свертывания крови, в частности, тканевого тромбопластина, что наблюдается при шоке, остром массивном гемолизе эритроцитов.
3. Замедление кровотока и его нарушения (завихрения в области аневризмы). Этот фактор, вероятно, имеет меньшее значение, однако он позволяет объяснить, почему в венах тромбы образуются в пять раз чаще,
чем в артериях, в венах нижних конечностей – в три раза чаще, чем в венах верхних конечностей, а также высокую частоту тромбообразования при декомпенсации кровообращения, пребывании на длительном постельном режиме.
Процесс тромбообразования условно можно разделить на две фазы:
фазу адгезии, агрегации и агглютинации тромбоцитов (клеточная фаза) и
фазу коагуляции (плазматическая фаза свертывания). Физико-химическая сущность клеточной фазы (первичный гемостаз) заключается в изменении электрического потенциала сосудистой стенки, заряда тромбоцитов и других клеток крови, повышении адгезивно-агрегационной способности тромбоцитов, вызывающих их оседание на поврежденной («чужеродной»)
поверхности внутренней оболочки сосудов (адгезия) и «прилипание» друг к другу (агрегация).
С момента распада тромбоцитов и выхода тромбоцитарных факторов свертывания крови в окружающую среду начинается следующий этап тромбоза – плазматическая фаза (фаза коагуляции крови). Физико-
химическая и биохимическая сущность этой фазы заключается в нескольких последовательных превращениях по типу проэнзим – энзим. Некоторые из этих превращений имеют истинную ферментативную природу.
На первом этапе фазы коагуляции крови происходит активация протромбопластина ткани и крови с переводом их в активный внешний и
101
внутренний тромбопластин. Внешний тромбопластин образуется при взаимодействии тканевых и плазменных компонентов системы свертывания крови. Кровяной, или внутренний тромбопластин (фактор 3 тромбоцитов)
образуется из тромбоцитного протромбопластина при взаимодействии факторов свертывания плазмы. Время образования тканевого тромбопластина составляет несколько секунд, в то время как для образования кровяного тромбопластина требуются минуты.
На втором этапе образуется активный тромбин. Под действием протеолитического фермента тромбопластина происходит отщепление пептидов с обоих концов белковой молекулы протромбина с образованием тромбина (молекулярная масса 61000) – высокоспецифического протеолитического фермента.
На третьем этапе под влиянием тромбина осуществляется превращение фибриногена в фибрин с образованием сгустка. В ходе первой реакции превращения от молекулы фибриногена (гликопротеид с молекулярной массой 340000) отщепляются два или четыре отрицательно заряженных пептида А и В. Вторая реакция представляет собой процесс полимеризации образовавшегося фибрина-мономера в крупные молекулы фибрина с молекулярной массой 5000000. В последующем межмолекулярные водородные связи в фибрине-полимере становятся еще более прочными под действием фибринстабилизирующего фактора плазмы крови. В норме этот фактор неактивен, однако под действием тромбоцина и ионов кальция активируется.
Фибрин в виде рыхло или компактно лежащих нитей представляет собой основную массу тромба. В ячейках образованной сети располагаются клетки крови (агрегированные тромбоциты, скопления лейкоцитов и эритроцитов).
На заключительном этапе свертывания крови под действием тромбостенина (ретрактозима), который выделяется из интактных тромбоцитов, наступает сокращение (по типу сокращения актомиозина)
102
фибриновых волокон и волоконец, обнаруженных в тромбоцитах с помощью электронного микроскопа. Происходит сжатие (ретракция) и уплотнение сгустка.
Ретракция – это лабильный процесс, нарушающийся при воздействии на тромбоциты химических (соли ртути, кобальта, меди, фтора,
формальдегид, эфир, хлороформ) и физических (нагревание свыше 57°С,
замораживание, воздействие ультразвука) факторов. При этом наблюдается полное подавление ретракции.
Для нормального течения ретракции необходимо наличие ионов кальция, глюкозы, АТФ, физиологическое течение гликолиза, определенные соотношения между концентрацией тромбина и фибриногена, а также фибриногена и тромбоцитов.
Однако механизм тромбообразования в артериях и венах различный.
Венозные тромбозы возникают в результате активации плазменного звена гемостаза, артериальные – на почве сосудисто-тромбоцитарных конфликтов.
Клиническим вариантом венозного тромбоза являются ДВС-синдром,
врожденный дефицит антитромбина III, протеинов С и S. К клиническим вариантам артериального тромбоза относят тромботическую тромбоцитопеническую пурпуру (ТТП) и гемолитикоуремический синдром
(ГУС).
Клиническая картина ТТП складывается из тромбоцитопении,
гемолитической анемии и флуктуирующих признаков ишемии,
сочетающихся с расстройствами нервной системы. Большинство этих синдромов характерно для ГУС, отличающегося от ТТП наличием признаков острой почечной недостаточности и отсутствием неврологической симптоматики. Тромботические массы, состоящие из тромбоцитов и небольших количеств фибрина, разбросаны по ТТП по всей артериокапиллярной системе, вызывая при этом характерную интермиттирующую симптоматику и признаки ишемии в самых различных органах.
103
При ГУС внутрисосудистая агрегация тромбоцитов с усиленным фибринолизом почти исключительно ограничена бассейном почечных сосудов. В обеих ситуациях (и при ТТП, и при ГУС) степень внутрисосудистой агрегации коррелирует с уровнем тромбоцитопении. У
больных ТТП количество тромбоцитов ниже, чем у больных ГУС. Наряду с тромбоцитопенией для большинства больных ТТП и ГУС характерна фрагментация эритроцитов, вызванная затруднением движения их по частично тромбированным артериолам и капиллярам. Часто развиваются симптомы микроангиопатической гемолитической анемии с характерной морфологической картиной шизоцитоза («обрезанная» форма эритроцитов),
выявляющейся в мазках периферической крови.
Последствия тромбозов могут быть различными. Учитывая его значение как кровоостанавливающего механизма при острой травме,
сопровождающейся кровотечением, тромбоз следует рассматривать с общебиологических позиций как приспособительное явление.
В то же время тромбообразование при различных заболеваниях
(атеросклероз, облитерирующий эндартериит, сахарный диабет и др.) может сопровождаться тяжелыми последствиями, вызванными острым нарушением кровообращения в зоне тромбированного сосуда.
Развитие некроза (инфаркта) в зоне тромбированного, лишенного коллатералей, сосуда – конечный этап тромбоза. Особенно велика роль тромбоза венечных артерий в развитии инфаркта миокарда.
Кроме того, согласно тромбогенной теории с пристеночным тромбообразованием и внутристеночным свертыванием крови,
сопровождающимися организационно-пластическими процессами,
связывают развитие атеросклероза.
Исходы тромбоза: асептическое (ферментативное, аутолитическое)
расплавление; организация (рассасывание с замещением соединительной тканью); реканализация; септическое (гнойное) расплавление. Последнее
104

особенно опасно, так как способствует септикопиемии и образованию
множественных абсцессов в различных органах.
5.6. Эмболия
Эмболия – это процесс перенесения током крови или лимфы элементов, в норме в сосудистом русле не встречающихся, и закупорка ими кровеносных или лимфатических сосудов.
В зависимости от характера эмболов различают эмболию экзогенную
(воздушную, газовую, плотными инородными телами, бактериальную,
паразитарную) и эндогенную, вызванную тромбом, жиром, различными тканями, околоплодными водами.
По локализации различают эмболию большого, малого круга кровообращения и системы воротной вены.
Во всех этих случаях движение эмболов обычно осуществляется в соответствии с естественным поступательным движением крови.
Следовательно, источником эмболии большого круга кровообращения являются патологические процессы в легочных венах, полостях левой половины сердца, артериях большого круга кровообращения; малого – патологические изменения в венах большого круга кровообращения и правой половине сердца.
К возникновению эмболии воротной вены ведут патологические изменения в бассейне воротной вены. Исключением является ретроградная эмболия, когда движение эмбола подчиняется не гемодинамическим законам,
а силе тяжести самого эмбола. Различают также парадоксальную эмболию,
которая наблюдается при незаращении межпредсердной или межжелудочковой перегородки, в результате чего эмболы из вен большого
105

круга кровообращения и правой половины сердца переходят в левую, минуя малый круг.
Базисные понятия (определения)
Гемодинамика – движение крови в организме.
Дилатация – расширение (например, просвета сосуда).
Организация (тромба) – рассасывание с замещением соединительной тканью.
Эмбол – частица, которая в нормальных условиях в крови и лимфе отсутствует.
5.7. Нарушение микроциркуляции
Микроциркуляция – кровоток через систему мелких сосудов
(диаметр менее 100 мкм), находящихся в каком-либо органе или ткани, посредством которого клетки получают питание и освобождаются от метаболитов,
катаболитов, в результате изменяющегося потока крови,
соответствующего потребностям тканей (А.М. Чернух,
1975).
В последнее время в системе периферического кровообращения условно выделяют микроциркуляторное, или сосудистое русло, которое в свою очередь в соответствии с делением сосудов на кровеносные и лимфоносные делится на микроциркуляторное кровеносное и лимфоносное русло. Микроциркуляторное кровеносное русло состоит из сосудов, диаметр которых не превышает 100 мкм, т.е. артериол, метартериол, капиллярных сосудов, венул и артериоловенулярных анастомозов. В нем осуществляется доставка питательных веществ и кислорода к тканям и клеткам, удаление из них углекислоты и шлаков, поддерживается равновесие притекающей и
106
оттекающей жидкости, оптимальный уровень давления в периферических сосудах и тканях.
Микроциркуляторное лимфоносное русло представлено начальным отделом лимфатической системы, в котором происходит образование лимфы и поступление ее в лимфатические капилляры. Процесс образования лимфы имеет сложный характер и заключается в переводе жидкости и растворенных
вней веществ, в том числе белков, через стенку кровеносных капиллярных сосудов в межклеточное пространство, распространении веществ в периваскулярной соединительной ткани, резорбции капиллярного фильтрата
вкровь, резорбции белков и избытка жидкости в лимфоносные пути и т.д.
Таким образом, с помощью микроциркуляторного кровообращения
осуществляется тесное гематоинтерстициальное и лимфоинтерстициальное взаимодействие, направленное на поддержание необходимого уровня метаболизма в органах и тканях в соответствии с их собственными потребностями, а также потребностями организма в целом.
Методы изучения микроциркуляторного сосудистого русла.
Комплексное изучение состояния микроциркуляции в норме и при ее нарушениях достигается с помощью физиологических и морфологических методов. Прежде всего, следует указать на широкое использование в клинике
иэксперименте кино- и фотосъемки, телевизионной микроскопии,
фотоэлектрической регистрации и др.
Классическими объектами для биомикроскопии в условиях эксперимента являются брыжейка лягушки, крысы и других теплокровных животных, перепонка крыла летучей мыши, защечный мешок хомяка, ухо кролика, радужная оболочка глаза, а также другие органы и ткани.
Для изучения микроциркуляции у человека используют микрососуды конъюнктивы и радужной оболочки глад, слизистой оболочки носа и рта.
Применение световодной техники позволяет изучить особенности микроциркуляции и во внутренних органах (головном мозге, почках, печени,
селезенке, легких, скелетной мышце и др.). Большой вклад в дело разработки
107
теоретических, экспериментальных и прикладных аспектов проблемы микроциркуляции внесли видные патофизиологи А.М.Чернух (1979), Ю.В.
Быць (1995) и др.
Типические нарушения микроциркуляции. В соответствии с общепринятой классификацией Е.Маggio (1965) расстройства микроциркуляции делят на внутрисосудистые нарушения, связанные с изменением самих сосудов, и внесосудистые нарушения.
Внутрисосудистые нарушения. Наиболее важными внутрисосудистыми нарушениями являются расстройства реологических особенностей крови в связи с изменением суспензионной стабильности клеток крови и ее вязкости. В нормальных условиях кровь имеет характер стабильной суспензии клеток в жидкой части.
Сохранность суспензионной стабильности крови обеспечивается величиной отрицательного заряда эритроцитов и тромбоцитов, определенным соотношением белковых фракций плазмы (альбуминов, с одной стороны,
глобулинов и фибриногена, с другой), а также достаточной скоростью кровотока. Уменьшение отрицательного заряда эритроцитов, причиной которого чаще всего является абсолютное или относительное увеличение содержания положительно заряженных макромолекул глобулинов и (или)
фибриногена и их адсорбция на поверхности эритроцитов, приводит к снижению суспензионной стабильности крови, к агрегации эритроцитов и других клеток крови. Снижение скорости кровотока усугубляет этот процесс.
Описанный феномен получил название «сладжа» (рис. 5.2).
108
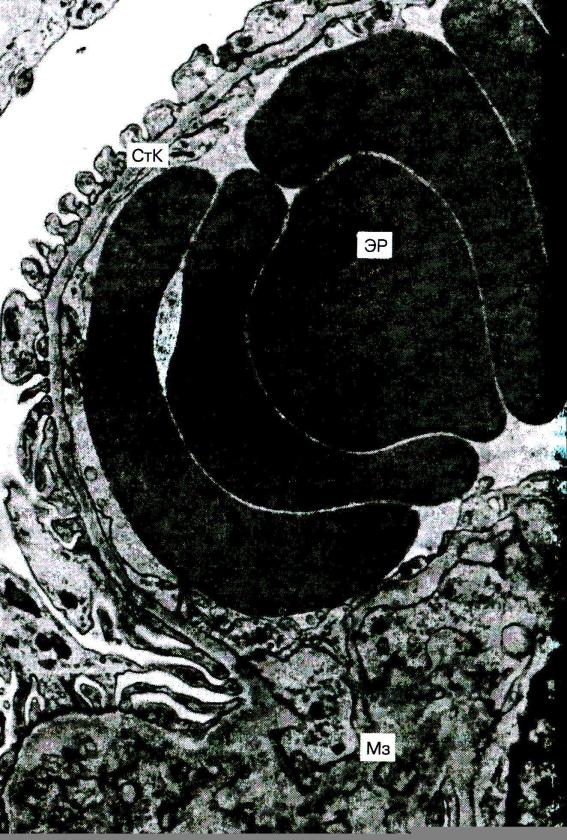
Рис. 5.2. Сладж-феномен. В просвете капилляра почечного клубочка гемолизирующиеся эритроциты (Эр) в виде монетных столбиков: СтК – стенка капилляра; Мз – мезангий х 14500 (по С.М. Секаловой)
109

Основными особенностями сладжированной крови являются прилипание друг к другу эритроцитов, лейкоцитов, тромбоцитов и повышение вязкости крови, что затрудняет ее перфузию через микрососуды.
В зависимости от характера воздействия сладж может быть обратимым
(при наличии только агрегации эритроцитов) и необратимым. В последнем случае имеет место агглютинация эритроцитов. В зависимости от размеров агрегатов, характера их контуров и плотности упаковки эритроцитов различают такие типы сладжа:
классический (крупные размеры агрегатов, неровные очертания контуров и плотная упаковка эритроцитов);
декстриновый (различная величина агрегатов, округлые очертания,
плотная упаковка эритроцитов);
аморфный гранулированный (огромное количество мелких агрегатов в виде гранул, состоящих всего из нескольких эритроцитов).
Размеры агрегатов при различных видах сладжа колеблются от 10 х 10
до 100 х 200 мкм и более.
Процесс формирования агрегатов клеток крови имеет определенную последовательность. В первые минуты после повреждения преимущественно в капиллярных сосудах и венулах образуются агрегаты из тромбоцитов и хиломикронов. Они плотно фиксируются к стенке микрососудов, образуя
«белый» тромб, или уносятся в другие отделы сосудистой системы к новым очагам тромбообразования.
Эритроцитарные агрегаты образуются в первые часы после повреждения первоначально в венулах, а затем и в артериолах, что обусловлено снижением скорости кровотока. Спустя 12-18 ч развитие указанных нарушений прогрессирует как по выраженности проявлений, так и по распространенности. Возможно и обратное развитие процесса в направлении дезагрегации.
Нарушения микроциркуляции проявляются частичной или полной закупоркой сосудов, резким замедлением кровотока, сепарацией и
110
