
pat_phy_book
.pdf
Ожирение – это склонность организма к чрезмерному
отложению жира в жировой клетчатки под влиянием
определенных условий
Ожирение развивается в результате трех основных патогенных
факторов:
1)повышенного поступления в пищу углеводов и жиров при несоответствующем этому поступлению энергетическом расходовании жира;
2)недостаточного использования (мобилизации) жира из депо как источника энергии;
3)избыточного образования жира из углеводов.
В зависимости от механизма развития различают следующие виды ожирения:
алиментарное;
церебральное (при травме, опухоли головного мозга);
гормональное (при синдроме Фрелиха и Иценко-Кушинга,
адипозогенитальной дистрофии, гипотериозе и др.);
наследственное.
По внешним проявлениям различают:
симметричный тип (равномерное распределение жира);
верхний (лицо, затылок, шея, верхний плечевой пояс);
средний (в области живота в виде фартука);
нижний (в области бедер и голеней).
В зависимости от процента повышения массы тела:
І степень – 20-29%;
ІІ степень – 30-49%;
ІІІ степень – 50-59%;
ІV степень – 60% и более.
Последствия ожирения: нарушение толерантности к глюкозе;
гиперлипемия, гиперинсулинемия; увеличение экскреции глюкокортикоидов
211
с мочой (в отличие от больных синдромом Иценко-Кушинга соотношение экскреции глюкокортикоидов и креатинани остается у ожиревших нормальным) после физической нагрузки; во время сна; после введения аргинина наблюдаются меньшие колебания концентрации соматотропного гормона в плазме; понижение чувствительности к инсулину увеличенных алипоцитов и мускулатуры; увеличение содержания ненасыщенных жирных кислот в крови – повышенное потребление их мускулатурой;
гипертрофированные липоциты сильнее реагируют на норадреналин и другие липолитические вещества.
У больных с ожирением часто развиваются сердечно-сосудистые заболевания, гипертензия, желчно-каменная болезнь (желчь при ожирении оказывается литогенной, т.е. содержит мало детергенов, растворяющих эфиры холестерина). Тучные люди плохо переносят наркоз и оперативные вмешательства. Как послеоперационное осложнение часто возникает тромбоэмболия. Одним из грозных осложнений ожирения является сахарный диабет. При ожирении увеличена вероятность цирроза печени. Женщины,
страдающие ожирением, чаще заболевают раком эндометрия, так как их жировая ткань обладает большей способностью метаболизировать андростендион в эстрон. При ожирении наблюдается одышка, поскольку массивные подкожно-жировые отложения ограничивают движения грудной клетки, скопление жира в брюшной полости препятствует опусканию диафрагмы. Увеличена потребность в кислороде, но затруднен газообмен,
относительная легочная недостаточность усиливается, развивается частое поверхностное дыхание.
8.6. Патофизиология белкового обмена
Обеспечение организма белками из нескольких источников определяет полиэтиологичность нарушений белкового обмена, которые могут носить первичный или вторичный характер. Одной из наиболее частых причин
212

общих нарушений белкового обмена является количественная и качественная белковая недостаточность первичного (экзогенного) происхождения.
Дефекты, связанные с этим, обусловлены ограничением поступления экзогенных белков при полном или частичном голодании, низкой биологической ценностью пищевых белков, дефицитом незаменимых аминокислот (валин, изолейцин, лейцин, лизин, метионин, тиронин,
триптофан, фенилаланин, гистидин, аргинин).
Нарушения белкового обмена при ряде заболеваний могут наступать вследствие расстройства переваривания и всасывания белковых продуктов
(гастроэнтериты, язвенный колит), повышенного распада белка в тканях
(стресс, инфекционные болезни), усиленной потери эндогенных белков
(кровопотери, нефроз, травмы), нарушения синтеза белка (гепатиты).
Чтобы получить суммарное представление о нарушениях белкового обмена исходят из понятия об азотистом равновесии. У нормального взрослого человека количество азотистых веществ, выводимых из организма,
равняется тому, которое он получает с пищей. Однако, при различных патологических состояниях в организме это равновесие может нарушаться.
Положительный азотистый баланс – состояние, при котором азота выводится из организма меньше, чем поступает, т.е. анаболические процессы преобладают над катаболическими
Отрицательный азотистый баланс – состояние, при котором расходуется большое количество белков и катаболические процессы преобладают над анаболическими
Нарушения азотистого баланса представлены на рис. 8.1.
213
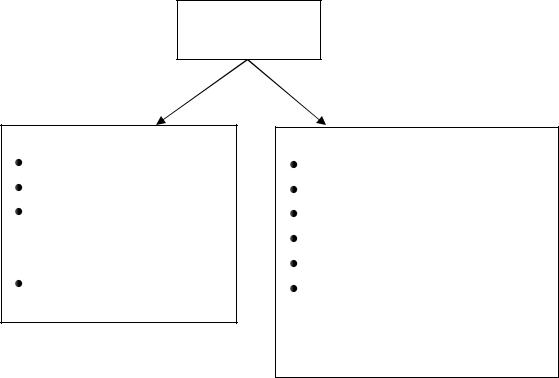
Азотистый
баланс
положительный
рост организма беременность прием анаболических
гормонов (СТГ, половые гормоны, инсулин)
состояние после голодания
отрицательный
голодание
протеинурия инфекционные заболевания ожоги операции
прием катаболических гормонов (тироксин, глюкокортикоиды), усиливающих распад белков
Рис. 8.1. Виды нарушений азотистого баланса
Нарушение обмена белков может быть результатом нарушения:
 поступления, переваривания и всасывания белков в ЖКТ
поступления, переваривания и всасывания белков в ЖКТ
 синтеза и распада белков в клетках и тканях
синтеза и распада белков в клетках и тканях
 межуточного обмена аминокислот
межуточного обмена аминокислот
а) нарушение дезаминирования
б) нарушение декарбоксилирования  конечных этапов белкового обмена
конечных этапов белкового обмена
Нарушения расщепления и всасывания белков. В пищеварительном тракте белки расщепляются под влиянием протеолитических ферментов. При этом, с одной стороны, белковые вещества и другие азотистые соединения,
входящие в состав пищи, теряют свои специфические особенности, с другой стороны, из белков образуются аминокислоты, из нуклеиновых кислот –
нуклеотиды и т.д. Образовавшиеся при переваривании пищи или
214
находившиеся в ней азотсодержащие вещества с небольшой молекулярной массой подвергаются всасыванию.
Различают первичные (при различных формах патологии желудка и кишечника: хронических гастритах, язвенной болезни, раке) и вторичные,
или функциональные, расстройства секреторной и всасывательной функции эпителия в результате отека слизистой оболочки желудка и кишечника,
нарушения переваривания белков и всасывания аминокислот в желудочно-
кишечном тракте.
Основные причины недостаточного расщепления белков – количественное уменьшение секреции соляной кислоты и фермента,
снижение активности протеолитических ферментов (пепсина, трипсина,
хемотрипсина) и связанное с этим недостаточное образование аминокислот,
уменьшение времени их воздействия (ускорение перистальтики).
Так, при ослаблении секреции соляной кислоты снижается кислотность желудочного сока, что ведет к уменьшению набухания пищевых белков в желудке и ослаблению превращения пепсиногена в его активную форму – пепсин. В этих условиях часть белковых структур переходит из желудка в двенадцатиперстную кишку в неизменном состоянии, а это затрудняет действие трипсина, хемотрипсина и других протеолитических ферментов кишечника. Дефицит ферментов, расщепляющих белки растительного происхождения, ведет к непереносимости белков риса, пшеницы и других злаков и развитию целиакии.
Недостаточное образование свободных аминокислот из пищевых белков может иметь место при ограничении поступления в кишечник сока поджелудочной железы (панкреатит, сдавление, закупорка протока).
Недостаточность функции поджелудочной железы ведет к дефициту трипсина, хемотрипсина, карбоангидраз А, Б и других протеаз,
воздействующих на длинные полипептидные цепи или расщепляющих короткие олигопептиды, что снижает интенсивность полостного или пристеночного пищеварения.
215
Недостаточное действие пищеварительных ферментов на белки может возникнуть вследствие ускоренного прохождения пищевых масс по кишечнику при усилении его перистальтики (энтероколиты) либо уменьшения площади всасывания (оперативное удаление значительных участков тонкого кишечника). Это ведет к резкому сокращению времени контакта содержимого химуса с апикальной поверхностью энтероцитов,
незапершенности процессов энзиматического распада и процессов активного и пассивного всасывания.
Причинами нарушения всасывания аминокислот являются повреждения стенки тонкого кишечника (отек слизистой оболочки,
воспаление) или равномерное по времени всасывание отдельных аминокислот, что обусловливает нарушение (дисбаланс) соотношения аминокислот в крови и нарушение синтеза белка в целом, поскольку незаменимые аминокислоты должны поступать в организм в определенных количествах и соотношениях. Чаще всего имеет место нехватка метионина,
триптофана, лизина и ряда других аминокислот.
Помимо общих проявлений нарушения аминокислотного обмена, могут иметь место специфические нарушения, связанные с отсутствием конкретной аминокислоты.
Так, недостаток лизина (особенно в развивающемся организме)
одерживает рост и общее развитие, понижает содержание в крови гемоглобина и эритроцитов. При недостатке в организме триптофана возникает гипохромная анемия. Дефицит аргинина приводит к нарушению сперматогенеза, а гистидина – к развитию экземы, отставанию в росте,
угнетению синтеза гемоглобина.
Кроме того, недостаточное переваривание белка в верхних отделах желудочно-кишечного тракта сопровождается увеличением перехода продуктов его неполного расщепления в толстый кишечник и усилением процесса бактериального расщепления аминокислот. Это вызывает увеличение образования ядовитых ароматических соединений (индол,
216
скатол, фенол, крезол) и развитие общей интоксикации организма этими
продуктами гниения.
Замедление поступления аминокислот в органы и ткани.
Всосавшиеся из кишечника аминокислоты поступают непосредственно в кровь и частично в лимфатическую систему, представляя собой тот
«метаболический фонд» разнообразных азотистых веществ, которые затем участвуют во всех видах обмена. В норме аминокислоты, всосавшиеся в кровь из кишечника, циркулируют в крови 5-10 мин и очень быстро поглощаются печенью и частично другими органами (почками, сердцем,
мышцами). Всякое увеличение времени этой циркуляции указывает на нарушение способности тканей и органов (в первую очередь печени)
поглощать аминокислоты.
Поскольку ряд аминокислот является исходным материалом при образовании биогенных аминов, задержка их в крови создает условия для накопления в тканях и крови соответствующих протеиногенных аминов и проявления их патогенного действия на различные органы и системы.
Увеличение содержания в крови тирозина способствует накоплению тирамина, который участвует в патогенезе злокачественней гипертонии.
Длительное повышение количества гистидина ведет к увеличению концентрации гистамина. Кроме того, увеличение содержания аминокислот в крови проявляется увеличением их выведения с мочой и формированием особой формы нарушений обмена – аминоацидурией.
Аминоацидурия может быть общей, связанной с повышением концентрации в крови нескольких аминокислот, или избирательной при увеличении содержания в крови какой-нибудь одной аминокислоты.
Нарушение синтеза белков. Синтез белковых структур в организме является центральным звеном метаболизма белка. Даже небольшие нарушения специфичности биосинтеза белка могут вызвать глубокие
патологические изменения в организме.
217
Среди причин, вызывающих нарушения синтеза белка, важное место занимают различные виды алиментарной недостаточности (полное, неполное голодание, отсутствие в пище незаменимых аминокислот, нарушение количественных соотношений между незаменимыми аминокислотами,
поступающими в организм). Если, например, в тканевом белке триптофан,
лизин, валин, содержатся в равных соотношениях (1:1:1), а с пищевым белком эти аминокислоты поступают в соотношении 1:1:0,5, то синтез тканевого белка будет обеспечиваться при этом ровно наполовину.
Отсутствие в клетках хотя бы одной (из 20) незаменимой аминокислоты прекращает синтез белка в целом.
Нарушение скорости синтеза белка может быть обусловлено расстройством функции соответствующих генетических структур, на которых совершается этот синтез (транскрипция ДНК, трансляция,
реконструкция). Повреждение генетического аппарата может быть как наследственным, так и приобретенным, возникшим под влиянием различных мутагенных факторов (ионизирующее излучение, ультрафиолетовые лучи и пр.).
Нарушение синтеза белка могут вызвать некоторые антибиотики. Так, «ошибки» в считывании генетического кода могут возникнуть под влиянием стрептомицина и ряда других антибиотиков. Тетрациклины тормозят присоединение новых аминокислот к растущей полипептидной цепи.
Митомицин угнетает синтез белка за счет алкилирования ДНК (образование прочных ковалентных связей между ее цепями), препятствуя расщеплению нитей ДНК.
Одной из важных причин, вызывающих нарушение синтеза белка,
является нарушение регуляции этого процесса. Регуляция интенсивности и направленности белкового обмена осуществляется нервной и эндокринной системами, действие которых осуществляется, вероятно, через их влияние на различные ферментные системы. Клинический и экспериментальный опыт свидетельствует, что отключение органов и тканей от ЦНС приводит к
218
местному нарушению процессов обмена в денервированных тканях, а
повреждение ЦНС вызывает расстройства белкового обмена. Децеребрация животных ведет к снижению синтеза белка. Соматотропный гормон гипофиза, половые гормоны и инсулин оказывают усиливающее влияние на синтез белка. Наконец, причиной патологии синтеза белка может стать изменение активности ферментных систем клеток, участвующих в биосинтезе белка. В наиболее выраженных случаях речь идет о блоке метаболизма, представляющем собой вид молекулярных расстройств,
составляющих основу наследственных заболеваний.
Результатом действия всех перечисленных факторов является обрыв или снижение скорости синтеза, как отдельных белков, так и общего белка в целом.
Выделяют качественные и количественные нарушения биосинтеза белков. О том, какое значение могут иметь качественные изменения биосинтеза белков в патогенезе различных заболеваний, можно судить на примере некоторых видов анемий при появлении патологических гемоглобинов. Замена только одного аминокислотного остатка (глутамина) в
молекуле гемоглобина на валин приводит к тяжелому заболеванию —
серповидноклеточной анемии.
Особый интерес представляют количественные изменения в биосинтезе белков органов и крови, приводящие к сдвигу соотношений отдельных фракций белков в сыворотке крови – диспротеинемии.
Выделяют две формы диспротеинемии: гиперпротеинемия (увеличение содержания всех или отдельных видов белков) и гипопротеинемия
(уменьшение содержания всех или отдельных белков).
Так, ряд заболеваний печени (цирроз, гепатит), почек (нефрит, нефроз)
сопровождаются выраженным уменьшением содержания альбуминов, а
инфекционные заболевания — обширными воспалительными процессами,
увеличением содержания гамма-глобулинов.
219
Развитие диспротеинемии сопровождается, как правило, серьезными сдвигами в гомеостазе организма (нарушением онкотического давления,
водного обмена). Значительное уменьшение синтеза белков, особенно альбуминов и гамма-глобулинов, ведет к резкому снижению сопротивляемости организма к инфекциям, снижению иммунологической устойчивости. Значение гипопротеинемии в форме гипоальбуминемии обусловлено еще и тем, что альбумин образует более или менее прочные комплексы с различными веществами, обеспечивая их транспорт между различными органами и перенос через клеточные мембраны при участии специфических рецепторов.
Известно, что соли железа и меди (чрезвычайно токсичны для организма) при рН сыворотки крови труднорастворимы, и транспорт их возможен только в виде комплексов со специфическими белками сыворотки
(трансферином и церулоплазмином), что предотвращает интоксикацию этими солями. Около половины кальция удерживается в крови в форме,
связанной с альбуминами сыворотки. При этом в крови устанавливается определенное динамическое равновесие между связанной формой кальция и его ионизированными соединениями. При всех заболеваниях,
сопровождающихся снижением содержания альбуминов (заболевания почек)
ослабляется и способность регулировать концентрацию ионизированного кальция в крови. Кроме того, альбумины являются носителями некоторых компонентов углеводного обмена (глюкопротеиды) и основными переносчиками свободных (неэстерифицированных) жирных кислот, ряда гормонов.
При поражении печени и почек, ряде острых и хронических воспалительных процессов (ревматизме, инфекционном миокардите,
пневмонии) в организме начинают синтезироваться особые белки с измененными свойствами или с атипичной структурой (не встречающиеся в норме). Классическим примером болезней, вызванных наличием патологических белков, являются болезни, связанные с присутствием
220
