
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •2.1. Аналитические реакции
- •2.2. Систематический и дробный анализ
- •3.1. Общая характеристика химического равновесия. Константа химического равновесия
- •3.2. Активность и коэффициент активности
- •3.3. Отклонения от идеальности в растворах сильных электролитов
- •3.5. Общие принципы расчёта состава равновесных систем
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.5. Применение органических реагентов в аналитической химии
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •6.3. Влияние различных факторов на растворимость
- •7.1. Общая характеристика окислительно-восста- новительных реакций
- •7.2. Количественная оценка окислительно-восстано- вительной способности веществ
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •9.1. Общая характеристика и классификация
- •9.2. Жидкость - жидкостная экстракция
- •10.1. Приближённые вычисления и значащие цифры
- •10.2. Понятие об аналитическом сигнале
- •10.4. Неопределённость и погрешности измерений
- •10.6. Пример статистической обработки результатов измерений. Исключение промахов
- •10.7. Основные характеристики методики анализа
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •ГЛАВА 13 Кислотно-основное титрование
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Ки- слотно-основные индикаторы
- •13.3. Кривые титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.3. Применение в фармацевтическом анализе
- •ГЛАВА 15 Комплексометрическое титрование
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •ГЛАВА 16 Осадительное титрование
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •18.1. Иодометрическое титрование
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.7. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
- •20.3. Атомно-абсорбционная спектроскопия
- •20.3.1. Процессы, приводящие к появлению аналитического сигнала
- •20.3.2. Измерение аналитического сигнала
- •20.3.3. Практическое применение
- •20.4.2. Измерение аналитического сигнала
- •20.5. ИК-спектроскопия
- •20.5.1. Процессы, приводящие к появлению аналитического сигнала
- •20.5.2. Общая характеристика ИК-спектров
- •20.5.3. Измерение аналитического сигнала
- •20.5.4. Практическое применение
- •21.1. Атомно-эмиссионная спектроскопия
- •21.1.1. Процессы, приводящие к появлению аналитического сигнала
- •21.1.2. Измерение аналитического сигнала
- •21.1.3. Практическое применение
- •21.2. Люминесцентная спектроскопия
- •20.2.1 Классификация видов люминесценции
- •21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
- •21.2.5. Измерение аналитического сигнала
- •22.1. Общая характеристика
- •22.2. Классификация хроматографических методов
- •22.3. Хроматографические параметры
- •22.4. Теории хроматографического разделения
- •ГЛАВА 23 Газовая хроматография
- •23.1. Общая характеристика
- •23.2. Устройство газового хроматографа
- •23.3. Особенности газотвёрдофазной хроматографии
- •23.4. Особенности газожидкостной хроматографии
- •23.5. Индексы удерживания Ковача
- •23.6. Практическое применение
- •ГЛАВА 24 Жидкостная хроматография
- •24.1. Общая характеристика
- •24.2. Плоскостная хроматография
- •24.2.1. Методика получения плоскостной хроматограммы
- •24.2.2. Анализ плоскостной хроматограммы
- •24.2.3. Практическое применение
- •24.3. Колоночная жидкостная хроматография
- •24.3.1. Устройство жидкостного хроматографа
- •24.3.2. Практическое применение
- •24.4. Характеристика отдельных видов жидкостной хроматографии
- •24.4.1. Ионообменная хроматография
- •24.4.2. Эксклюзионная хроматография
- •25.2. Классификация электрохимических методов анализа
- •25.3. Кондуктометрия
- •25.3.1. Теоретические основы и классификация
- •25.3.2. Измерение аналитического сигнала
- •25.3.4. Практическое применение
- •25.3.5. Понятие о высокочастотной кондуктометрии
- •26.1. Потенциометрический метод анализа
- •26.1.1. Общая характеристика и классификация
- •26.1.2. Условия измерения аналитического сигнала
- •26.1.3. Индикаторные электроды
- •26.1.4. Прямая потенциометрия
- •26.1.5. Потенциометрическое титрование
- •26.2. Кулонометрический метод анализа
- •26.2.1. Общая характеристика и классификация
- •26.2.2. Прямая кулонометрия
- •26.2.3. Кулонометрическое титрование
- •27.1. Принцип измерения аналитического сигнала.
- •27.2. Вольтамперограмма
- •27.4. Практическое применение вольтамперометрии. Амперометрическое титрование
- •ЛИТЕРАТУРА
- •Общая
- •Справочная
- •Дополнительная литература к отдельным темам
- •Химические методы обнаружения неорганических веществ
- •Хемометрика
- •Химические методы анализа
- •Инструментальные методы анализа (общая литература)
- •Спектроскопические методы анализа
- •Хроматографические методы анализа
- •Электрохимические методы анализа

Раздел 2
15.3. Комплексонометрическое титрование
15.3.1. Понятие о комплексонах
Комплексонометрическим титрованием называется титри-
метрический метод анализа, основанный на образовании хелатов при взаимодействии катионов металлов с комплексонами.
Комплексоны – органические соединения, в молекулах которых содержится большое число оснόвных донорных центров и кислотных функциональных групп, расположенных так, что при их взаимодействии с катионами металлов образуются высокоустойчивые внутрикомплексные соединения, содержащие не менее двух циклов.
В качестве оснόвных донорных центров в молекулах комплексонов выступают атомы азота, фосфора или серы; кислотные центры обычно представлены карбоксильными или фосфоновыми группами. Например:
CH2COOH |
|
|
CH PO H |
||
HOOCH2C N |
H |
|
2 |
3 |
2 |
O PH C N |
|
|
|||
CH2COOH |
2 |
3 |
2 |
PO H |
|
|
|
CH |
|||
|
|
|
2 |
3 |
2 |
CH2CH2COOH |
|
|
CH COOH |
|
|
HOOCH2CH2C P |
|
|
2 |
|
|
|
|
S |
|
|
|
CH2CH2COOH |
|
|
CH COOH |
|
|
|
|
|
2 |
|
|
Максимально возможная дентатность у различных комплексонов может изменяться от 3 до 8:
|
|
|
|
COOH |
|
|
CH COOH |
HOOCH C |
CH2 |
CH2COOH |
|
H N |
2 |
|
2 |
NCH2CH2 N CH2CH2N |
|
|
CH COOH |
HOOCH2C |
|
CH2COOH |
|
|
2 |
|
|
|
|
иминодиуксусная кислота |
диэтилентриаминпентауксусная кислота |
||||
(тридентатный лиганд) |
|
|
(октадентатный лиганд) |
||
В титриметрии наибольшее значение имеют комплексоны, относящиеся к аминополикарбоновым кислотам: этилендиаминтетрауксусная кислота и её динатриевая соль.
15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
Этилендиаминтетрауксусная кислота (ЭДТА) представляет собой белое кристаллическое негигроскопичное вещество. Мало растворима в воде и этаноле. Растворимость ЭДТА в воде минимальна при рН 1,6 – 1,8 и увеличивается при уменьшении или увеличении рН.
176
Химические методы анализа
ЭДТА (H6Y2+) является шестиосновной кислотой: pKa1 0,8;
pKa2 1,6; pKa3 = 2,0; pKa4 = 2,67; pKa5 = 6,16; pKa6 = 10,26. Её ней-
тральная форма (H4Y) имеет цвиттер-ионную структуру.
HOOC |
|
CH2 |
|
|
|
|
|
|
CH CH |
|
|
|
|
CH2 |
|
COO |
|
|
|||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
N |
|
|
|
|||||||||||||||||
|
|
|
|
|
N |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
OOC |
|
CH2 |
|
|
|
2 |
2 |
|
H CH2 |
|
COOH |
||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
H |
|
|
|
|||||||||||||||
Отщепление первого и второго протонов у H4Y происходит от карбоксильных групп. У дианиона ЭДТА карбоксильные группы депротонированы, а атомы азота, наоборот, остаются протонированными. Третий и четвёртый протоны отщепляются от N-H кислотных центров. Анионы ЭДТА имеют сложное строение, так как протонизированные атомы водорода могут образовывать внутримолекулярные водородные связи –N-H…O, что приводит к формированию циклов.
На рис. 15.1 приведена зависимость состава водных растворов ЭДТА от рН.
α 1,0 |
|
H2Y2- |
|
HY3- |
|
Y4- |
|
|
|
|
|
|
|
|
|
0,8 |
|
|
|
|
|
|
|
0,6 |
H4Y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,4 |
|
- |
|
|
|
|
|
|
|
H3Y |
|
|
|
|
|
0,2 |
|
|
|
|
|
|
|
0,00 |
2 |
4 |
6 |
8 |
10 |
12 |
pH |
Рис. 15.1. |
Распределительная диаграмма для ЭДТА |
|
|
||||
При рН 3-6 в растворе доминирует анион H2Y2-, при рН 6-10 – HY3- а при рН > 10,5 – Y4-. В общем случае значение α(Y4-) можно рассчитать:
α(Y4−) = |
Ka1Ka2...Ka6 |
|
[H3O+]6 +Ka1[H3O+]5 +Ka1Ka2[H3O+]4 +...+Ka1Ka2...Ka6 |
|
|
|
|
По мере увеличения рН формула для расчёта α(Y4-) будет упрощаться. Например, при рН > 8 можно принять, что
177

Раздел 2
α(Y |
4− |
) = |
|
K a6 |
|
или |
α(Y |
4− |
) = |
|
|
1 |
|
|
||
|
[H3O |
+ |
] + Ka6 |
|
|
1 +10 |
pKa6 |
−pH |
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЭДТА образует комплексы с катионами большинства металлов
Mn+ + HmY(m-4)- î [MY](n-4)+ + mH+
При рН 9 это уравнение будет выглядеть как
|
|
Mn+ + HY3- î [MY](n-4)+ + H+ |
|
|
||||
|
|
|
|
ЭДТА является |
гексадентат- |
|||
|
|
|
|
|||||
|
|
|
|
ным лигандом и в подавляющем |
||||
|
|
|
|
большинстве случаев |
взаимодейст- |
|||
|
|
|
|
вует с катионами металлов в мо- |
||||
|
|
|
|
лярном соотношении 1:1. В струк- |
||||
|
|
|
|
туре |
образующегося |
внутриком- |
||
|
|
|
|
плексного соединения имеется 5 пя- |
||||
|
|
|
|
тичленных циклов (рис. 15.2.), что |
||||
|
|
|
|
делает его очень устойчивым. Устой- |
||||
Рис. 15.2. |
Структура комплекса |
|||||||
чивость комплексов |
металлов |
с |
||||||
металла с |
ЭДТА |
ЭДТА, |
как правило, |
повышается |
с |
|||
|
|
|
|
|||||
увеличением заряда иона металла. Так ионы Cr3+, Al3+, Bi3+ или Fe3+
образуют комплексы, величины констант образования которых превышают 1020.
На устойчивость комплексов катионов металлов с ЭДТА влияют
вещества, взаимодействующие с катионами металла либо с анионом
Y4-.
образование ↑pH n+☺4- ↓pH протонирование гидроксокомплексов M Y
и малорастворимых гидроксидов
образование комплексов с NH3
идругими компонентами буферного раствора
Практически устойчивость комплексов катионов металлов с ЭДТА удобно описывать с помощью условных констант образования, которые могут быть использованы лишь при тех условиях (рН, концентрация постороннего лиганда), для которых они рассчитаны.
β′MY =βMYαM αY4−
178

Химические методы анализа
15.3.3. Кривые титрования
Кривая комплексонометрического титрования обычно представляют собой зависимость рM = -lg[M] от степени оттитрованности. В качестве примера рассмотрим кривую титрования 1,0 10-3 М Zn2+ 1,0 10-3 М раствором ЭДТА. Титрование проводится в аммиачном буферном растворе, рН которого равен 9,50, а концентрация NH3 – 5 10-2 моль/л. Поскольку C(NH3) значительно больше С(Zn2+), будем считать, [NH3] ≈ С(NH3). Константа образования комплекса ZnY2- равна 3,2 1016, а её десятичный логарифм – 16,50.
Катион цинка образует аммиачные комплексы, содержащие от 1 до 6 молекул лиганда. Общие константы образования этих комплек-
сов: β1 = 1,5 102; β2 = 2,7 104; β3 = 8,5 106; β4 = 1,2 109; β5 = 2,9 109; β5 =
5,6 1012. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
αZn2+ = |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
= |
||
|
|
1 + β |
[NH |
3 |
] |
+ β |
2 |
[NH |
3 |
]2 |
+... + β |
6 |
[NH |
3 |
]6 |
|||||||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
=1,0 10−5 |
||
|
|
|
1 |
+1,1 10 |
3 |
+ 7,5 10 |
3 |
+ 9,1 |
10 |
2 |
+ 8,8 |
10 |
4 |
|
||||||||||||||||
1 + 7,5 + 6,8 10 |
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
lg αZn2+ = −5,00 |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
α(Y 4− ) = |
|
|
|
1 |
|
|
|
|
= 1,5 10-1, lg αY4− |
= −0,83. |
||||||||||||||||||
|
|
|
|
|
10,26−9,50 |
|
||||||||||||||||||||||||
|
|
|
|
1 +10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
lg β′ |
2− = lg β |
ZnY |
2− |
+ lg α |
Zn |
2+ + lg α |
Y |
4− = 16,50 − 5,00 − 0,83 =10,67 |
||||||||||||||||||||||
|
ZnY |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
До начала титрования
pZn = −lg(C0,Zn αZn2+ ) = −lg C0,Zn − lg αZn2+
До точки эквивалентности
pZn = −lg C0,Zn |
− lg α |
|
2+ |
− lg |
|
1 |
− f |
|
Zn |
1 |
+ f |
||||||
|
|
|
|
|||||
Чтобы получить формулу для расчёта величины pZn в точке эквивалентности, воспользуемся выражением β′ZnY2− .
β′ |
2− = |
[ZnY2− ] |
|
||
ZnY |
|
CZn CY |
|
|
где СZn и CY – общие концентрации, соответственно ионов Zn2+ и ЭДТА, образовавшихся при диссоциации комплекса ZnY2-.
С учётом того, что в точке эквивалентности CZn = CЭДТА
179

Раздел 2
β′ |
2− |
= |
[ZnY2− ] |
|
|
C2Zn |
|||
ZnY |
|
|
|
|
Если принять, что степень диссоциации комплекса ZnY2- пренебрежимо мала, то
|
|
|
|
|
[ZnY |
2− ] ≈ |
|
C0,Zn |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
1 + f |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
С учётом того, что [Zn 2+ ] = CZn αZn2+ : |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
+ |
|
|
|
C0,Zn |
|
|
|
= |
|
||||||
|
|
pZn = −lg α |
Zn |
2 |
β′ |
|
2− (1 |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
+ f ) |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
ZnY |
|
|
|
|
|
|
|
|
|
|||
= |
1 |
lg β′ |
2− |
− |
|
1 |
lg C0,Zn |
|
− lg α |
|
|
2+ |
+ |
1 |
lg(1 |
+ f ) |
|||||||
2 |
2 |
|
Zn |
2 |
|||||||||||||||||||
|
ZnY |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Для того чтобы получить формулу для расчёта pZn после точки эквивалентности, также воспользуемся формулой, описывающей условную константу образования комплекса.
C′Y = С0,Y 1f +−f1
Так как С0,Zn = С0,Y , то
|
|
|
|
|
|
|
|
C0 (1 + f ) |
|
|
|
|
pZn = −lg |
α |
Zn |
2 |
+ |
|
|
|
|
|
|
|
= |
β′ |
|
(1 + f ) C |
|
(f −1) |
||||||||
|
|
|
|
|
2− |
0 |
|
|
||||
|
|
|
|
|
|
ZnY |
|
|
|
|
|
= lg β′ZnY2− − lg αZn2+ + lg(f −1) = lg βZnY2− + lg αY4− + lg(f −1)
Формулы для расчёта рZn в различных точках кривой титрования и рассчитанные по ним значения рZn приведены в табл. 15.1. Кривая титрования показана на рис. 15.3.
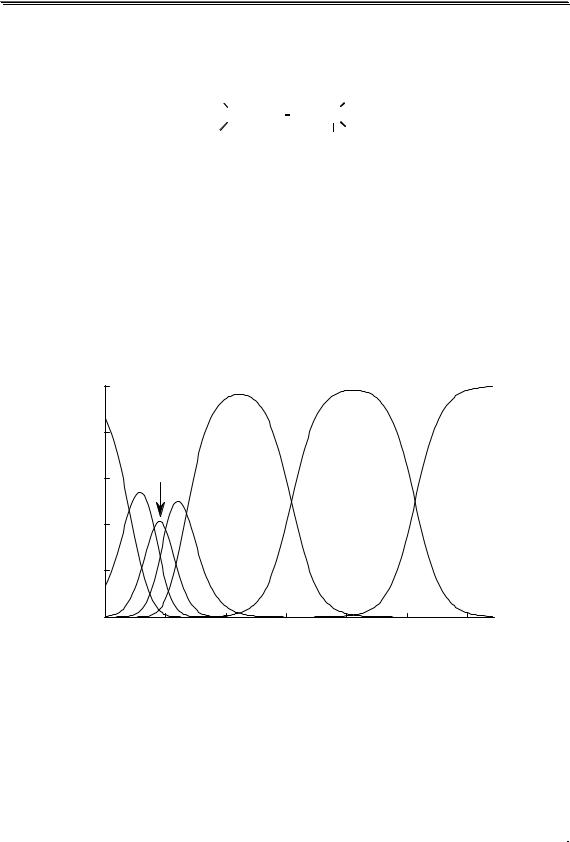
На величину скачка титрования в комплексонометрии влияют
(рис. 15.4):
•исходные концентрации титруемого иона и титранта,
•устойчивость комплекса катиона металла с ЭДТА,
•величины α(Y 4− ) и αM в условиях титрования.
Молярная доля Y4- зависит от рН, а величина αM – от концен-
трации комплексообразующего реагента и устойчивости образующихся комплексов
180

Химические методы анализа
Табл. 15.1
Расчёты для построения кривой титрования 1,0 10-3 М Zn2+ 1,0 10-3 М раствором ЭДТА при рН 9,50 в присутствии 5 10-2 М NH3
f |
|
|
|
|
|
Расчётная формула |
|
|
|
|
|
pZn |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
0 |
|
|
|
|
pZn = −lgC0,Zn −lgαZn2+ |
|
|
|
|
8,00 |
|||||||||||
0,10 |
|
|
pZn = −lgC0,Zn −lgα |
|
|
2+ −lg |
1−f |
|
|
8,09 |
|||||||||||
|
|
|
Zn |
1+ f |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
0,50 |
|
|
|
|
|
|
|
аналогично |
|
|
|
|
|
|
|
8,48 |
|||||
0,90 |
|
|
|
|
|
|
|
аналогично |
|
|
|
|
|
|
|
9,28 |
|||||
0,99 |
|
|
|
|
|
|
|
аналогично |
|
|
|
|
|
|
|
10,3 |
|||||
0,999 |
|
|
|
|
|
|
|
аналогично |
|
|
|
|
|
|
|
11,3 |
|||||
1,00 |
|
1 |
′ |
|
|
|
1 |
|
|
|
|
|
|
|
|
1 |
|
|
12,0 |
||
|
pZn = |
|
lgβ |
ZnY |
2− |
− |
|
|
|
lgC0,Zn −lgα |
Zn |
2+ + |
|
lg(1 |
+ f ) |
|
|||||
1,001 |
2 |
2 |
|
2 |
12,7 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
pZn = lgβ |
ZnY |
2− + lgα |
Y |
4− + lg(f −1) |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1,01 |
|
|
|
|
|
|
|
аналогично |
|
|
|
|
|
|
|
13,7 |
|||||
1,10 |
|
|
|
|
|
|
|
аналогично |
|
|
|
|
|
|
|
14,7 |
|||||
1,50 |
|
|
|
|
|
|
|
аналогично |
|
|
|
|
|
|
|
15,4 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рZn16
14
12
10
8 |
|
|
|
0 |
0,5 |
1 |
1,5 f |
Рис. 15.3. Кривая титрования 1,0 10-3 М Zn2+ 1,0 10-3 М раствором ЭДТА при рН 9,50 в присутствии 5 10-1 М NH3
181

|
|
|
Раздел 2 |
|
|
|
|
pM |
A |
|
|
pM |
Б |
|
1 |
10 |
|
|
10 |
|
|||
8 |
|
|
|
8 |
|
|
2 |
|
|
|
|
|
|
|
|
6 |
1 |
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
0 |
0,5 |
1,0 |
1,5 |
0 |
0,5 |
1,0 |
1,5 |
0,0 |
0,0 |
||||||
|
|
|
f |
|
|
|
f |
pM |
B |
|
1 |
pM |
Г |
|
|
10 |
|
16 |
|
|
|||
8 |
|
|
2 |
14 |
|
|
|
6 |
|
|
|
12 |
1 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
10 |
2 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
8 |
|
|
|
0 |
0,5 |
1,0 |
1,5 |
6 |
0,5 |
1,0 |
1,5 |
0,0 |
0,0 |
||||||
|
|
|
f |
|
|
|
f |
Рис. 15.4. Влияние различных факторов на величину скачка комплексоно- |
|||||||
метрического титрования |
|
|
|
|
|
||
А- концентрация титруемого иона (pH 10, Ca2+) - 1) 1,0 10-4 М; 2) 1,0 10-2 М;
Б-устойчивость комплекса (рН 10, 1,0 10-2 М) - 1) Ca2+, 2) Ba2+;
B - pH ( Сa2+, 1,0 10-2 М) - 1) pH 10; 2) pH 7;
Г – концентрация NH3 (рН 9,5, 1,0 10-3 М Zn2+) – 1) [NH3] = 1 10-1 М; 2) [NH3] = 5 10-2 М
Изменение исходной концентрации титруемого вещества и концентрации вспомогательного реагента (а также и рН, если про-
исходит образование гидроксокомплексов металла) влияют на ход кривых титрования до точки эквивалентности, в то время как pH и устойчивость комплекса – после точки эквивалентности.
Для каждого металла существует определённое значение рН, ниже которого комплексонометрическое титрование с удовлетворительной погрешностью оказывается невозможным.
182
