
физкал
.pdfI.1. Основные понятия термодинамики
Термодинамика представляет собой научную дисциплину, которая изучает энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания; переходы энергии из одной формы в другую и от одной части системы к другой, а также возможность, направление и предел самопроизвольного протекания самих процессов в данных условиях.
В более узком понимании, термодинамика – это наука о законах взаимных превращений различных видов энергии друг в друга, переходах энергии от одной части системы к другой.
Теоретической базой термодинамики являются еѐ основные законы – первое и второе начала термодинамики. Первое начало носит всеобщий характер и является отражением закона сохранения энергии; второй закон устанавливает понятие энтропии и выполняется при определенных ограничениях. Наряду с учением о строении вещества, термодинамика является теоретической основой современной химии.
Химическая термодинамика изучает положения и законы общей термодинамики применительно к химическим явлениям. Она исследует тепловые балансы процессов, фазовые равновесия в системах, состоящих из индивидуальных веществ или смесей, химические равновесия, позволяет теоретически предсказать принципиальную невозможность протекания того или иного процесса либо указать его направление.
Термодинамический метод основан на ряде строгих понятий: «система», «состояние системы», «процесс» и др.
Объектом изучения термодинамики является термодинамическая система, под которой понимают тело или группу тел находящихся во взаимодействии и мысленно или реально выделенных из окружающей среды. Окружающая (внешняя) среда – это всѐ, что находится в прямом или косвенном контакте с системой. Принято считать, что окружающая среда настолько велика, что отданная или принятая ею теплота не изменяет еѐ температуру.
Различают изолированные, закрытые и открытые системы. Изолиро-
ванные системы с внешней средой не обмениваются ни энергией, ни массой; закрытые системы обмениваются с внешней средой лишь энергией (масса закрытых систем остаѐтся постоянной); открытые системы обмениваются с внешней средой и энергией, и массой. Термодинамические системы разделяются также на гомогенные и гетерогенные. Гомогенные (однофазные) системы характеризуются постоянством физических и химических свойств во всех их частях. Гетерогенные системы состоят из различных по свойствам частей, отделенных друг от друга поверхностями раздела. Свойства системы на этих поверхностях резко отличаются от свойств в других точках системы.
Свойства систем в термодинамике характеризуют термодинамическими параметрами. Параметры системы, которые можно определить, произведя непосредственно их измерения, называются основными параметрами. К
ним относятся температура, давление, объем, концентрация веществ в системе. Различные сочетания основных параметров определяют другие, более общие параметры системы: внутреннюю энергию (U), энтальпию (Н) и энтропию (S). Общие параметры рассматриваются как функции основных параметров системы. Свойства системы, которые не зависят от массы и которые выравниваются при контакте систем (температура, давление, плотность, концентрация, химический потенциал и др.), называются интенсивными свойствами. Свойства, которые зависят от массы (объѐм, масса, теплоѐмкость, энтальпия, внутренняя энергия и др.), называются экстенсивными. При контакте систем экстенсивные свойства суммируются. Совокупность параметров, принимающих определенное значение, характеризует состояние системы. Изменение состояния системы, характеризующееся изменением хотя бы одного параметра, называется термодинамическим процессом. Процесс, при котором система, выйдя из начального состояния и претерпев ряд изменений, снова возвращается в это же исходное состояние, называется циклом или круговым процессом. В цикле изменение любого параметра системы равно нулю.
В термодинамике рассматриваются два основных способа обмена энергией между системой и окружающей средой: теплота и работа. Передача энергии в виде теплоты осуществляется посредством хаотического, неупорядоченного движения частиц, а передача энергии в виде работы – посредством упорядоченного, направленного движения частиц.
Работа, совершаемая системой, считается положительной, а совершаемая над системой – отрицательной. Механическая работа обозначается через А, а немеханическая – А. В термодинамике под механической работой понимают работу, совершаемую системой против внешнего давления (работу расширения), а под немеханической работой (еѐ также называют полезной работой) – сумму всех остальных работ (магнитной, электрической и др.). Теплота, поглощаемая системой, считается положительной, а выделяемая системой – отрицательной.
I.2. Первое начало термодинамики. Внутренняя энергия системы. Энтальпия
Сдавних времен известно, что работа и теплота могут переходить друг
вдруга. Если система, взаимодействуя с внешними телами, совершает работу А и получает извне количество тепла Q, то совершив цикл, согласно принципу эквивалентности А = Q. В науке принцип эквивалентности теплоты и работы утвердился благодаря работам Р. Майера, Дж. Джоуля и Р. Клаузиуса. Последний предложил называть принцип эквивалентности теплоты и работы первым началом термодинамики и формулировать его следующим образом:
во всех случаях, когда из теплоты получается работа, тратится пропорциональное полученной работе количество теплоты, и, наоборот, при затрате работы получается то же количество теплоты.
Открытие эквивалентности теплоты и работы имело революционное

значение в науке. Оно было отнесено к числу трех крупнейших достижений естествознания XIX века.
Из принципа эквивалентности теплоты и работы вытекает существование у термодинамической системы такого параметра, который обладает двумя особенностями: 1) при переходе системы из одного состояния в другое изменение этого параметра не зависит от пути перехода; 2) при совершении системой цикла изменение этого параметра равно нулю. Параметры, обладающие такими особенностями, называются функциями состояния.
Рассмотрим термодинамическую систему, совершающую цикл, переходя из состояния а в состояние b по путям 1 или 2 и возвращаясь в состояние а из состояния b по пути 3. Обозначим теплоту и работу, которыми система обменивается с окружающей средой на
пути 1 через Q1 и А1, на пути 2 через Q2 и А2, на
пути 3 через Q3 и А3. Получаем два возможных цикла: а1b3а и а2b3а, для которых, в соответствии с принципом эквивалентности теплоты и
работы, запишем:
I цикл: Q1 + Q3 = A1+A3
II цикл: Q2 + Q3 = A2+A3
Вычитая из первого равенства второе, получим:
Q1 – Q2 = A1 – A2 или Q1 – A1 = Q2 – A2.
Полученное выражение указывает на независимость величины (Q – A) от пути перехода системы из одного состояния в другое, и эта величина рав-
на изменению некоторой функции состояния системы U. |
|
U = Q – A |
(I – 1) |
Эта функция состояния названа внутренней энергией системы. Под ней понимают энергию, которая заключена в теле в скрытом состоянии и освобождающуюся или накапливающуюся при физических процессах или химических реакциях. Величина U данного вещества зависит от его химической природы, массы, агрегатного состояния и температуры. Она складывается из энергии различных видов движения и взаимодействия частиц, входящих в систему: энергии поступательного и вращательного движения молекул, колебательного движения атомов и атомных групп, энергии межмолекулярного взаимодействия, внутриатомной и внутриядерной энергии. Представленное выше уравнение является математическим выражением первого начала (первого закона) термодинамики, который имеет несколько формули-
ровок, одна из которых гласит, что переход различных видов энергии друг в друга происходит в строго эквивалентных соотношениях. Из этого постулата вытекает вторая формулировка: общий запас энергии в изолированных
системах остается постоянным. |
|
Уравнение (I – 1)можно записать в виде: |
|
Q = U + A |
(I – 2). |
В этом случае первый закон термодинамики может быть сформулиро-
ван так: количество теплоты, подведѐнное к системе или отведѐнное от

неѐ, идѐт на изменение внутренней энергии и на работу, совершаемую системой или совершаемую над системой.
Так как в цикле начальное и конечное состояния системы совпадают, то для кругового процесса U = 0 и Q = А. Работа в этом случае может совершаться системой только при получении теплоты извне. По этой причине невозможно создать такого рода периодически действующего устройства (двигатель), которое совершало бы работу, не используя для этого энергию извне. Поэтому первое начало термодинамики может быть дано и в следующей формулировке: вечный двигатель первого рода невозможен.
Поскольку величина изменения внутренней энергии определяется только начальным и конечным состоянием системы, то внутренняя энергия является функцией состояния, а еѐ бесконечно малое изменение выражается полным дифференциалом (dU). Величины же Q и А зависят от пути процесса и не являются функциями состояния, а их бесконечно малые изменения (δQ и δA) не обладают свойствами полного дифференциала. В уравнениях (I – 1) и (I – 2) под работой А понимают сумму механической и немеханической работ. Как уже отмечалось выше, под механической работой понимается работа расширения, бесконечно малое изменение которой может быть определено так:
δА = рdV,
где р – внешнее давление, Па; dV – бесконечно малое изменение объѐма системы, м3. С учѐтом этого полная дифференциальная форма математического выражения первого закона термодинамики имеет вид:
δQ = dU + рdV + δA (I – 3),
где δA – бесконечно малое изменение немеханической (полезной) работы. В химической термодинамике принимают во внимание только работу расширения, а величину δA считают равной нулю. В этом случае математическое
выражение первого закона термодинамики принимает вид: |
|
δQ = dU + рdV |
(I – 3а) |
Рассмотрим, какими параметрами описывается обмен энергии в виде теплоты и работы при различных условиях. Систему, которая получает или отдает энергию в виде некоторого количества теплоты Q, принято характеризовать теплоемкостью. Под теплоѐмкостью С понимают то количество теплоты, которое необходимо сообщить телу (системе), чтобы нагреть его на 1 градус. Различают молярную, удельную, среднюю и истинную теплоѐмкости. Молярной теплоѐмкостью называют количество теплоты, которое необхо-
димо сообщить 1 моль вещества, чтобы нагреть его на 1 градус. * +. Удельная теплоѐмкость – это теплоѐмкость единицы массы вещества (1 г или 1кг). * +. Средней теплоѐмкостью ̅ называют отношение количества
поглощенного или выделенного системой тепла к вызванному этим изменению температуры:
|
|
|
Q |
|
С |
|
|||
|
. |
|||
T T |
||||
|
|
2 |
1 |
|
Истинной теплоѐмкостью называют отношение бесконечно малого количества поглощѐнной или выделенной теплоты к вызванному этим бесконечно
малому изменению температуры: |
С |
δQ |
. |
|
|||
|
|
dT |
|
В зависимости от условий |
нагревания или охлаждения вещества |
||
различают изохорную Сv и изобарную Ср теплоѐмкости. Взаимосвязь этих величин определяется выражением:
Cp = Cv + R (I – 4).
Изохорная и изобарная теплоѐмкости веществ зависят от температуры. Эту зависимость приближенно представляют двумя или тремя членами степенно-
го ряда: |
|
|
|
С = а + вТ + сТ2 |
или |
C = а + вТ + сТ–2 |
(I – 5) |
где а, в и с – числовые коэффициенты, приводимые в справочниках. Рассмотрим, как вычисляются теплота, работа и изменение внутренней
энергии при совершении важнейших термодинамических процессов в простых системах (идеальном газе).
Изохорный процесс (V = const). Так как при совершении этого процесса изменение объема системы не происходит ( V = 0), то работа расширения не совершается (А = р V = 0), и вся поглощенная системой теплота расходуется на увеличение внутренней энергии (QV = U). Теплота изохорного элементарного процесса с участием n моль вещества определяется по уравнению:
δ QV dU nCVdT (I – 6),
а теплота конечного процесса рассчитывается по уравнению:
T2
QV U n |
∫ |
|
|
|
CV dT |
(I – 7), |
|
T1 |
|
|
|
Если не учитывать зависимость теплоѐмкости от температуры, то дан- |
|||
ное выражение после интегрирования принимает вид: |
|
||
QV U nСV |
|
T2 - T1 |
(I – 8). |
Следовательно, изменение внутренней энергии идеального газа в изохорном процессе равно количеству поглощенной или выделенной системой теплоты, равной произведению изохорной теплоемкости на разность температур.
Изобарный процесс (р = const). Если системой при постоянном давлении поглощено некоторое количество теплоты Qp, то для сохранения давления постоянным система должна расшириться, например, от объема V1 до объема V2. При этом часть теплоты расходуется на увеличение внутренней
энергии, а вторая часть – на совершение работы расширения: |
|
Qр = U + p V |
(I – 9). |
Энергию такой расширенной при постоянном давлении системы оказалось удобным выражать через другую функцию состояния – энтальпию (Н), которой обозначают сумму внутренней энергии и произведения давления и
объѐма, характеризующих состояние системы: |
|
Н = U + pV |
(I – 10). |
Поэтому Qр = U + p V = U2 – U1 + pV2 – pV1 =
= U2 + pV2 – (U1 + pV1) = Н2 – Н1 = Н
Количество теплоты в изобарном процессе равно изменению энтальпии и определяется по формуле:
T2
∫ |
|
Qр Н n Cр dT |
(I – 11) |
T1 |
|
Если не учитывать зависимость теплоѐмкости от температуры, то после |
|
интегрирования данное уравнение для n молей вещества имеет вид: |
|
Qр = nCp(T2 – T1) |
(I – 12) |
Работа расширения для n молей идеального газа в изобарном процессе |
|
равна: |
|
Ар = р(V2 – V1) = nR(T2 – T1) |
(I – 13). |
Изотермический процесс ( Т = 0). В этом случае изменение внутренней энергии системы будет равно нулю. В этом процессе все сообщаемое системе количество теплоты будет расходоваться на совершение работы (АТ), поэтому работа расширения в этом случае будет максимальной. Для n молей газа
|
|
|
V2 |
dV |
|
|
|
|
|||
AТ равно: |
AТ |
nRT |
или после интегрирования: |
||||||||
V |
|||||||||||
|
|
|
V1 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||
|
|
A |
|
nRT ln |
V2 |
nRT ln |
p1 |
(I – 14). |
|||
|
|
Т |
V1 |
p2 |
|||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
Адиабатный процесс протекает без теплообмена системы с внешней средой (Q = const). В этом случае А = – U. Это значит, что если система сжимается без теплообмена с внешней средой (А < 0), то внутренняя энергия еѐ увеличивается, и поэтому температура повышается. В технике это явление используется в двигателях внутреннего сгорания для воспламенения топлива. Если же система расширяется, то работа над внешними телами совершается за счет убыли внутренней энергии и температура понижается. В технике это явление используется для получения низких температур.
А = – nСv(Т2 – Т1) = nСv(Т1 – Т2) |
(I – 15). |
I.3. Термохимия. Закон Гесса
Протекание практически всех химических реакций сопровождается выделением или поглощением энергии в виде тепла, света, излучений и др. Реакции или процессы, при протекании которых энергия выделяется, называ-
ются экзотермическими, если же энергия поглощается – эндотермически-
ми. Для количественного сравнения энергетических эффектов химических реакций путем пересчета их приводят к одному виду энергии – тепловому, в соответствии с законом сохранения энергии. Тепловым эффектом реакции
называется максимальное количество теплоты, выделенной или поглощенной системой в ходе реакции, протекающей при определѐнных условиях, когда единственной работой является только работа расширения. Тепловой эффект химической реакции при постоянных Т и V равен изменению внутренней энергии ( U), а при постоянных Т и р – изменению энтальпии ( Н) системы.
Запись реакций, при которых учитывается тепловой эффект, осуществляется при помощи термохимических уравнений. В отличие от химических уравнений, термохимические уравнения обладают следующими особенностями:
1.в них, кроме исходных веществ и конечных продуктов, указывается тепловой эффект реакции;
2.стехиометрические коэффициенты в них означают не число атомов и молекул, а количество (моль) вещества, поэтому в них возможны дробные коэффициенты;
3.в термохимических уравнениях указываются агрегатные состояния и аллотропные модификации веществ;
4.с этими уравнениями можно производить алгебраические действия – сложение, вычитание и т.д.
Основным методом определения тепловых эффектов химических реакций является калориметрический метод. Другой метод основан на использовании экспериментальных данных о химическом равновесии при различных температурах и расчетов тепловых эффектов по уравнениям изобары или изохоры химических реакций. Третий метод основан на измерении ЭДС гальванических элементов при различных температурах. В последнее время появилась возможность определения тепловых эффектов реакций по данным масс-спектрометрических измерений.
Большое практическое значение имеет возможность определения теплового эффекта реакции расчетным путем, используя теплоты образования или сгорания всех веществ, участвующих в реакции. Эти данные приведены в справочниках для большого числа веществ при стандартных условиях (р =
1,013 10 5 Па, Т = 298К) в виде стандартных энтальпий образования ( |
) |
|
и сгорания ( |
). |
|
В 1840 г. русский академик Г.И. Гесс установил основной закон термохимии:
тепловой эффект химических реакций зависит только от природы и состояния исходных веществ и конечных продуктов реакции, но не зависит от пути и числа промежуточных стадий процесса.
Учитывая, что закон Гесса и следствия из него при стандартных условиях изучены в курсе общей химии, в данной главе будет рассмотрена лишь зависимость теплового эффекта химической реакции от температуры.
I.4. Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа
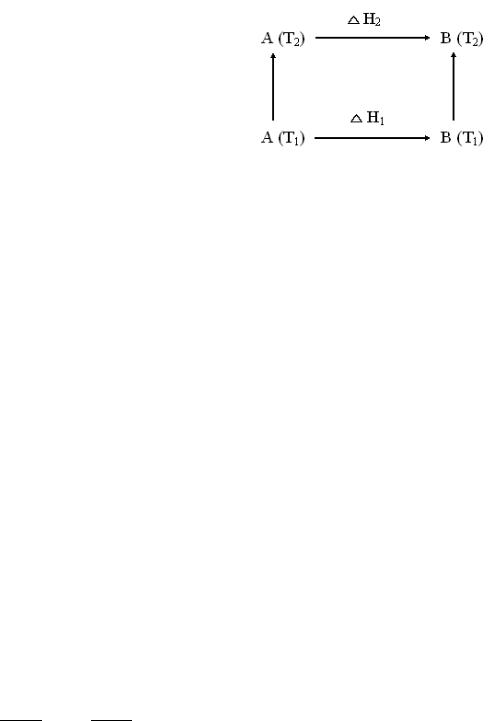
Тепловые эффекты химических реакций зависят от температуры. Данная зависимость устанавливается уравнением Кирхгофа. Рассмотрим его вывод. Пусть исходное вещество А надо перевести в продукт В. При этом температура исходного вещества будет Т1, а продукта – Т2. Этот процесс можно осуществить двумя путями. Первый путь заключается в том, что А превращается в В при Т1, тепловой эффект реакции будет ∆Н1, и потом продукт В нагревается до Т2, на что тратится ко-
Т2
личество теплоты равное Ср (В)dT. По второ-
Т1
му пути вещество А нагревается до Т2, на что
Т2
тратится Ср (А)dT тепла, и потом при Т2 пре-
Т1
вращается в В. Тепловой эффект будет ∆Н2. Согласно закону Гесса:
∫ ( ) |
∫ ( ) |
Выразим отсюда ∆Н2:
∫ ( ( ) ( ))
где ∆Н1 – известный тепловой эффект при какой то температуре Т1, чаще всего 298К, (Ср(В) – Ср(А)) – разность теплоѐмкостей продуктов и исходных веществ, которую можно обозначить ∆Ср. Тогда
|
|
T2 |
|
НТ2 |
|
Но298 Ср dT |
(I – 16) |
|
|
298 |
|
Это интегральная форма уравнения Кирхгофа. В дифференциальной форме уравнение Кирхгофа можно представить так:
( |
( ) |
) |
(I – 17) |
|
Аналогичное выражение получится для изохорного теплового эффекта, если проследить зависимость изменения внутренней энергии системы от температуры:
( |
( ) |
) |
(I – 18) |
|
Величины ( ( )) и ( ( )) называются температурными коэффици-
ентами теплового эффекта химической реакции. Полученные уравнения и являются математическим выражением закона Кирхгофа: температур-
ный коэффициент теплового эффекта равен разности суммарных молярных теплоемкостей конечных и исходных веществ с учетом стехиометрических

коэффициентов перед формулами веществ в уравнении химической реакции.
Проанализируем уравнение Кирхгофа:
1. Если , то ( ( )) также больше ноля. Это значит, что с
увеличением температуры тепловой эффект реакции возрастает.
2. |
Если |
, то ( |
( ) |
) |
|
и с увеличением температуры тепловой |
|
|
|
||||||
эффект реакции уменьшается. |
|
||||||
3. |
Если |
, то ( |
( ) |
) |
. В этом случае тепловой эффект |
||
|
|||||||
реакции не зависит от температуры.
Эти уравнения можно использовать только для узкого интервала температур. Для широкого же интервала температур и при сильной зависимости теплоѐмкости веществ от температуры следует учитывать зависимость теплоемкостей участников реакции от температуры (уравнения I – 5). В этом случае из суммы уравнений зависимости теплоемкости от температуры продуктов реакции необходимо почленно вычесть сумму уравнений зависимости теплоемкости от температуры исходных веществ и проинтегрировать уравнение Кирхгофа по температуре. :В этом случае получается выражение:
НТо |
Но298 а Т - 298 |
в |
Т2 |
2982 |
|
с |
Т3 |
2983 |
|
(I – 19), |
|
2 |
3 |
||||||||||
|
|
|
|
|
|
|
|
|
пользуясь которым определяют изменение энтальпии реакции при любой температуре.
I.5. Обратимые и необратимые в термодинамическом смысле процессы
Первое начало термодинамики имеет всеобщий характер и применяется для всех процессов, протекающих в окружающем мире. Однако оно не дает никаких указаний относительно возможности, направления и предела самопроизвольного протекания этих процессов. Между тем далеко не все процессы в реальных условиях осуществимы. В связи с этим, независимо от первого начала термодинамики, в науку введено в качестве научного принципа второе начало (второй закон) термодинамики, характеризующее процессы превращения энергии с качественной стороны и также являющееся обобщением человеческого опыта. Второе начало термодинамики было сформулировано прежде всего для того, чтобы учесть всегда существующую необратимость реальных процессов. Поэтому необходимо остановиться на понятиях «тер-
модинамически обратимые и необратимые процессы».
Термодинамически обратимыми называют процессы, которые могут быть проведены в прямом и обратном направлении так, что ни в самой системе ни в окружающей среде не остается никаких изменений. Иными словами, в термодинамическом понимании обратимый процесс – это процесс,
который можно провести в обратном направлении, затрачивая такую же работу, которую система произвела в прямом процессе. Так, если в прямом процессе система совершает работу над внешней средой, то в обратном процессе внешняя среда производит работу над системой, равную по абсолютной величине работе, произведенной в прямом процессе. Например, если в прямом процессе система расширяется, то в обратном – сжимается.
Термодинамически необратимыми называются процессы, при прове-
дении которых в прямом и обратном направлениях система не возвращается в исходное состояние без каких-либо изменений в окружающей среде. Иначе говоря, при возвращении системы в исходное состояние в окружающей среде остаются какие-то изменения.
Типичными примерами термодинамически необратимых процессов являются:
1)работа, затрачиваемая на преодоление трения, необратимо превращающаяся в теплоту;
2)падение жидкости с высоты;
3)расширение газа в вакуум;
4)растворение вещества с образованием раствора;
5)переход теплоты от более нагретого тела к менее нагретому.
Из приведенных примеров видно, что все самопроизвольные процессы, протекающие в природе, являются термодинамически необратимыми. Термодинамически обратимых самопроизвольных процессов в природе нет. Необходимо различать понятие обратимости в химическом и термодинамическом смысле. В химии обратимыми считаются все реакции, которые могут протекать в обратном направлении, однако при этом система не обязательно повторяет в точности все состояния, в которых она находилась при протекании реакции в прямом направлении.
I.6. Максимальная работа и максимальная полезная работа
При соответствующих условиях степень необратимости можно настолько уменьшить, что процесс осуществляется как практически обратимый. Это возможно при бесконечно медленном проведении процесса, когда система проходит через непрерывную последовательность равновесных состояний, которые могут быть воспроизведены при обратном проведении процесса.
Основным свойством таких процессов является то, что при обратимом процессе работа, совершаемая системой при переходе из начального состояния в конечное, максимальна, а работа, затрачиваемая на обратный перевод системы в начальное состояние, минимальна. В дальнейшем максимальную работу будем обозначать Аmax.
Важной особенностью термодинамически обратимых процессов является также то, что только для них можно вывести строгие термодинамические уравнения, описывающие переход системы из первого состояния во второе. Для необратимых процессов вместо термодинамических уравнений
