
физкал
.pdf
их и частичная концентрация – уменьшаются. Наряду с этим, ускоряется и оседание частиц (седиментация).
Итак, молекулярно-кинетические свойства присущи не только молеку- лярно-ионным – истинным растворам низкомолекулярных соединений, но и коллоидным. Нет качественных различий в их молекулярно-кинетических свойствах. Различия только количественные, обусловленные различием размера частиц этих систем.
Седиментация
Седиментация – это процесс оседания частиц дисперсной фазы в дисперсионной среде под действием силы тяжести.
На частицы дисперсной фазы в растворе действуют:
-сила тяжести;
-сила трения.
Силу тяжести, под действием которой оседают частицы дисперсной фазы, по закону Архимеда можно вычислить по формуле:
F |
4 |
3 |
r 3 |
( )g , |
(XI-6) |
т |
|
|
o |
|
|
|
|
|
|
где Fm - сила тяжести, кг•м/с2;
r – радиус частицы дисперсной фазы, м;
ρ и ρо – плотность частиц д.ф. и д.с., кг/м3; g – ускорение силы тяжести (9,8 м/с2).
Сила трения (Fтр), действующая на сферическую частицу, согласно закону Стокса равна:
Fтр. 6 π r η u , |
(XI-7) |
где η – вязкость дисперсионной среды, Па•с; |
|
u – скорость движения частицы, м/с; |
|
r – радиус частицы дисперсной фазы, м. |
|
Если Fm = Fтр, то седиментация частиц дисперсной фазы происходит с постоянной скоростью:
|
u |
2 |
|
r 2 |
( o ) g |
(XI-8) |
|||
|
9 |
|
|
|
|||||
|
|
|
|
|
|
|
|||
Способность к седиментации часто выражают через константу седи- |
|||||||||
ментации (К ): |
К |
|
|
|
u |
. |
|
||
сед. |
|
|
|||||||
сед |
|
|
|
g |
|
||||
|
|
|
|
|
|
|
|||
1/Ксед – это мера кинетической устойчивости дисперсной системы. Седиментации противодействует диффузия, которая стремится вырав-
нить концентрацию частиц дисперсной фазы по всему объему дисперсионной среды.
Состояние, при котором скорость диффузии равна скорости оседания,
называется седиментационно-диффузионным равновесием. При этом мелкие частицы находятся в основном в верхних слоях, а более крупные – в нижних

слоях дисперсной системы. Путем подсчета числа частиц на двух уровнях можно определить массу и размер частиц.
Если при установлении седиментационного равновесия основная масса частиц дисперсной фазы за небольшое время окажется в осадке, то систему считают седиментационно-неустойчивой.
Коллоидные растворы являются седиментационно-относительно устойчивыми.
Скорость седиментации коллоидных частиц можно сильно увеличить, если использовать центрифуги и ультрацентрифуги. В ультрацентрифугах центробежная сила в сотни тысяч млн. раз больше g. Центральной частью центрифуги является ротор с частотой вращения 60 000 об/мин. и выше.
С помощью центрифугирования можно определять размер коллоидных частиц; разделять смесь белков, нуклеиновых кислот, полисахаридов и гормонов; выделять из растений и биосред организма биологически активные вещества.
XI.1.4. Оптические свойства коллоидных растворов
По оптическим свойствам коллоидные растворы отличаются от истинных растворов низкомолекулярных веществ. Это обусловлено их дисперсностью и гетерогенностью.
Свет, проходя через дисперсную систему, может преломляться, отражаться, поглощаться или рассеиваться. Зависит это от соотношения между размером коллоидных частиц и длиной волн (λ) падающего света (белый свет имеет длины волн (3,6 7,6∙10-7 м)).
В истинных растворах (молекулярно-ионная дисперсность) частицы растворенного вещества имеют размеры меньше, чем длины волн видимого света, поэтому они пропускают свет (оптически пусты) и являются прозрачными.
Грубодисперсные системы, размеры частиц в которых больше 10-6м, т.е. значительно превышают λ видимого света, отражают свет и поэтому мутные.
Размер коллоидных частиц λ падающего света. Поэтому для коллоидов характерно дифракционное рассеяние света. Световая волна огибает коллоидную частицу. Свет рассеивается, и частица становится вторичным источником света. Рассеяние света можно наблюдать при боковом освещении коллоидного раствора: в случае точечного источника света – в виде светяще-
гося конуса (эффект Фарадея-Тиндаля) - (рис. XI.3.), а при обычном боковом
освещении - в виде голубоватой опалесценции раствора. По конусу легко отличить коллоидные растворы от истинных.
Рис. XI.3. Эффект Фарадея-Тиндаля.

1 – источник света;
2 – коллоидный раствор;
3 – направление наблюдения
Закон светорассеяния был установлен Рэлеем:
Интенсивность рассеянного света (J) прямо пропорциональна интен-
сивности падающего света (Jo), частичной концентрации золя (Сv), квадрату объема коллоидной частицы (V) и обратно пропорциональна длине волны падающего света (λ) в четвертой степени:
С V 2 |
(XI-9) |
||
J K Jo |
4 |
, |
|
v |
|
|
|
где К – константа. Зависит от соотношения показателей преломления дисперсной фазы (n1) и дисперсионной среды (no):
|
n2 |
n2 |
2 |
|
К 24π3 |
1 |
0 |
. |
|
2 |
2 |
|||
|
|
|||
n1 |
2n0 |
|
||
Интенсивность рассеянного света тем больше, чем больше различаются показатели преломления коллоидной частицы и среды (при равенстве показателей преломления рассеяние света может отсутствовать).
Уравнение Рэлея справедливо при условиях:
частицы имеют сферическую форму и не поглощают свет, т.е. бесцветны;
коллоидный раствор является разбавленным (расстояние между частицами больше длин волн падающего света).
Из уравнения (XI-9) видно, что чем меньше длина волны падающего света, тем больше будет рассеяние. Поэтому сильнее рассеиваются короткие волны (голубая часть спектра). Этим объясняется голубоватая окраска многих бесцветных золей при наблюдении сбоку и желтовато-красная – в проходящем свете. Явление изменения окраски коллоидов в результате рассеяния света называется опалесценция.
Явление рассеяния света коллоидными частицами использовано в приборах ультрамикроскопах. Ультрамикроскопы имеют такую же разрешающую способность, как и обычные биологические микроскопы, но с их помощью можно видеть частицы коллоидного раствора. Объясняется это тем, что в них используется боковое освещение и темный фон. В результате дифракции света коллоидные частицы обнаруживаются в виде светящихся точек. Интенсивность рассеянного света зависит от концентрации золя, размеров и формы коллоидных частиц.
Ультрамикроскопию применяют при исследовании крови, лимфы, вакцин, для контроля чистоты инъекционных растворов, воды и воздушной среды. С помощью ультрамикроскопа можно определить форму и размер коллоидных частиц.
Более точно о форме и размерах коллоидных частиц можно судить с помощью электронного микроскопа. В нем используются не лучи света, а поток электронов. Источником электронов служит вольфрамовая проволока,
которая при накаливании испускает электроны. Стеклянные линзы заменены магнитными или электрическими полями. Микроскоп дает увеличение до 900 000 раз. Он позволяет видеть микробы, вирусы, структурные элементы клеток, крупные молекулы.
Окрашенные золи поглощают часть проходящего через них света. Светопоглощение тоже сильно зависит от дисперсности. Чем меньше размер частиц, тем сильнее поглощаются более короткие волны. Этим определяется различный цвет окрашенных золей (золота, рубина и др.) в зависимости от размера частиц.
Белые золи не поглощают свет. Поглощение света (оптическую плотность) измеряют на ФЭК, спектрофотометрах и других приборах.
XI.1.5. Определение формы и размеров коллоидных частиц
Форму коллоидных частиц можно определить при помощи ультрамикроскопа. Если частицы ассиметричны, то они обладают переменной яркостью. Шарообразные частицы обладают постоянной яркостью.
Размеры коллоидных частиц можно определить:
по коэффициенту диффузии (см. уравнение Эйнштейна – (XI-3));
с помощью ультрамикроскопа: в определенном объеме (V) поля зрения микроскопа подсчитывают число частиц (n), равное числу светящихся точек. Радиус частиц r определяют по формуле:
r 3 |
|
3 |
|
с V |
|
, |
|
|
|||||
4 |
n |
где С – концентрация;
ρ– плотность раствора.
с помощью электронного микроскопа. Для этого учитывают увеличение, с
которым производится фотографирование частиц. По масштабу определяют размер частиц;
нефелометрически. Метод основан на сравнении светорассеяния стандартного коллоидного раствора (с известным радиусом частиц) и исследуемого золя той же массовой концентрации.
ультрацентрифугированием;
Скорость седиментации частиц в ультрацентрифуге рассчитывают по уравнению (XI-8), заменив в нем g на w2x,
где w – угловая скорость вращения ротора центрифуги;
х– расстояние от частицы до оси вращения.
на молекулярных ситах - метод гельфильтрации (см. X.6).
XI.1.6. Электрические свойства дисперсных систем. Электрокинетические явления
Электрокинетические явления характерны для систем, в которых на границе раздела фаз имеется двойной электрический слой. При воздействии

постоянного электрического тока на дисперсную систему можно наблюдать перемещение дисперсной фазы и дисперсионной среды относительно друг друга.
Впервые электрокинетические явления изучал ученый Ф.Ф.Рейсс. Рейсс проводил такой опыт: в сырую глину помещались две стеклянные трубки, в которые наливалась вода и опускались электроды (рис. XI.4.).
Рис. XI.4. Опыт Рейсса.
При пропускании постоянного тока в анодном пространстве вода становилась мутной (частицы глины передвигались к положительному электроду), а в катодной трубке вода оставалась прозрачной, но уровень еѐ повышался.
Направленное движение частиц дисперсной фазы под действием электрического поля называется электрофорезом.
Движение дисперсионной среды в постоянном электрическом поле называется электроосмосом.
Итак, при наличии неподвижной капиллярно-пористой перегородки (в опыте Рейсса - это влажная глина) под действием постоянного электрического поля передвигаются дисперсионная среда (электроосмос) и дисперсная фаза (электрофорез).
Позже были обнаружены ещѐ 2 электрокинетические явления:
1.Квинке обнаружил, что при течении воды под давлением через пористые материалы - М (глина, песок, графит и др.) возникает разность по-
тенциалов - потенциал протекания (рис. XI.5.).
Рис. XI.5. Схема установки для наблюдения за потенциалом протекания.
2.Дорн установил, что при оседании частиц песка в сосуде с водой гальванометр (Г) фиксирует наличие тока (рис. XI.6.). Это явление, обратное электрофорезу, получило название потенциал седиментации.

Рис. XI.6. Схема прибора Дорна.
Эти 4 явления получили название электрокинетических явлений. Причина электрокинетических явлений – наличие двойного электрического слоя (ДЭС) на границе раздела дисперсной фазы и дисперсионной среды.
В медико-биологических исследованиях широко используется электрофоретический анализ белков сыворотки крови с целью диагноза заболеваний. С помощью электрофореза в организм вводят различные лекарственные вещества и определяют чистоту лекарственных препаратов.
Электроосмос используется при обезвоживании перевязочных материалов, фильтров, для концентрирования растворов.
Механизм образования ДЭС у коллоидных частиц
ДЭС на границе раздела фаз возникает двумя основными путями:
1. За счет избирательной адсорбции.
При этом возможны два случая:
а) Избирательная адсорбция ионов, которые способны достраивать кри-
сталлическую решетку частиц дисперсной фазы в соответствии с пра-
вилом Панета-Фаянса. Это рассмотрено ранее (см. X.5.5.) на примере возникновения заряда на поверхности AgJ при избытке в растворе AgNO3 или KJ.
б) Избирательная адсорбция без достройки кристаллической решетки. Примером может служить образование ДЭС на частицах парафина, диспергированного в разбавленном водном растворе KOH. ДЭС образуется за счет избирательной адсорбции гидроксильных ионов, которые обладают большей адсорбционной способностью, чем ионы щелочного металла:
2. За счет ионизации поверхности кристалла твердой частицы.
Таким путем возникает ДЭС на частицах водного золя SiO2. Поверхность кристаллов оксида SiO2 частично гидратируется. Образуется H2SiO3,
способная ионизироваться: |
|
H2SiO3 H+ + HSiO3-. |
|
Ионы HSiO3-, «родственные» SiO2, избирательно |
ад- |
сорбируются на поверхности SiO2, придавая ей |
отри |

рицательный заряд, а ионы водорода переходят в раствор. Схематически ДЭС на поверхности частиц SiO2 можно изобразить так:
И в этом случае весь комплекс в целом электронейтрален.
Аналогично возникает отрицательный заряд на частицах гидрозолей металлов.
Строение двойного электрического слоя. Потенциалы ДЭС
Согласно современным представлениям:
-ДЭС состоит из потенциалопределяющих ионов, прочно связанных с поверхностью дисперсной фазы, и эквивалентного количества противоположно заряженных ионов, находящихся в дисперсионной среде. Потенциалопределяющие ионы создают на поверхности частиц дисперсной фазы элек-
тротермодинамический или межфазный потенциал (υ).
-ДЭС рассматривается как плоско параллельный.
-Дисперсионная среда представляется всегда как непрерывная фаза, влияние которой на ДЭС определяется еѐ диэлектрической проницаемостью
ивязкостью.
-Противоионы имеют конечные размеры, поэтому не могут подходить к твердой дисперсной фазе ближе, чем на расстояние радиуса одного иона.
-Слой противоионов, которые компенсируют заряд твердой поверхности, состоит из двух частей: адсорбционного слоя и диффузного слоя. Адсорбционный слой противоионов плотно прилегает к заряженной поверхности твердой частицы и имеет толщину, равную примерно диаметру гидратированного противоиона. Противоионы адсорбционного слоя прочно связаны с заряженной твердой частицей адсорбционными и электростатическими силами. Противоионы диффузного слоя притягиваются к заряженной частице только за счет электростатических сил, поэтому в отличие от адсорбционных противоионов отрываются от неѐ при движении. На границе скольжения между адсорбционной и диффузной частями ДЭС коллоидной частицы воз-
никает электрокинетический - дзета (ζ) потенциал. Электрокинетический потенциал – часть электротермодинамического потенциала. Чем больше диффузный слой, тем больше ζ-потенциал. Электрокинетический потенциал
– мера устойчивости лиофобных коллоидов (прямая зависимость).
Рассмотрим образование ДЭС коллоидной частицы AgJ при взаимодействии разбавленных водных
растворов нитрата серебра и иодида калия, взятого в избытке, ионы которого J- и К+ выполняют роль стабилизатора.
Как рассмотрено ранее (правило Панета-
Фаянса), на твердой фазе (кристаллах AgJ) будут адсорбироваться «родственные ионы» - J-. Это потен-
циалопределяющие ионы (ПОИ). Они образуют внут-
реннюю обкладку ДЭС и создают отрицательный по
знаку, а по величине – электротермодинамический или межфазный потенциал (υ). Ионы К+ - противоионы (ПРИ) образуют внешнюю часть двойного электрического слоя. Часть противоионов K+ располагаются близко от твердой поверхности AgJ и составляют с ПОИ плотный адсорбционный слой. Остальные противоионы К+ под влиянием теплового движения образуют диффузную часть двойного электрического слоя (рис., а). В адсорбционном слое электрический потенциал падает линейно, а в диффузном слое – постепенно (рис., б).
Схематично ДЭС отрицательно заряженной частицы AgJ можно представить так:
Двойной электрический слой: а) – распределение зарядов; б) - падение электротермодинамического потенциала.
Строение мицелл лиофобных коллоидных растворов
Структурной единицей лиофобных коллоидов является мицелла. Ми-
целла состоит из электронейтрального агрегата и ионогенной части. Агре-
гат состоит из некоторого числа m молекул малорастворимого вещества дисперсной фазы. Ионогенная часть – это адсорбционный и диффузный слои ДЭС.
Рассмотрим строение мицеллы коллоидного раствора AgJ (стабилиза-
тор KJ).
В данном случае агрегат – это m[AgJ].
Агрегат m[AgJ] вместе с ПОИ (ионы J- в количестве n ионов) составляют ядро мицеллы, еѐ твердую фазу, схематично представляемую так:
m[AgJ] ∙ nJ-
│ядро мицеллы│
Часть противоионов - (n – х) катионов К+, вместе с ядром составляют
гранулу:
{ m[AgJ] ∙ nJ- ∙ (n – х)K+}X-
│ гранула │ Знак заряда гранулы определяют потенциалопределяющие ионы. В
приведенном примере гранула имеет отрицательный заряд (х-).
Гранула с окружающим еѐ диффузным слоем (х катионов К+, необходимых для компенсации заряда ПОИ) образуют мицеллу. В отличие от гранулы мицелла имеет заряд, равный нулю.
Структура мицеллы рассмотренного выше коллоидного раствора AgJ, стабилизированного KJ, представлена на рис. XI.7.a.
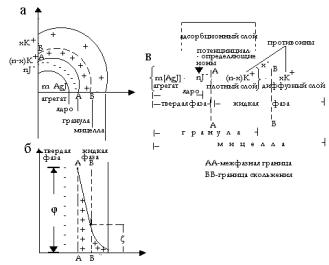
Рис. XI.7. Схемы строения мицеллы коллоидного раствора AgJ, полученного при избытке KJ (a, в) и еѐ двойного электрического слоя (б).
Строение мицеллы этого золя схематично можно изобразить и в виде
формулы (рис. XI.7.в),
где m – число структурных единиц кристалла труднорастворимого вещества;
n – число потенциалопределяющих ионов (число противоионов тоже n) при этом n << m;
n-x – число противоионов в адсорбционном слое;
х – число противоионов в диффузном слое коллоидной частицы; х- - (вверху за фигурной скобкой) – заряд гранулы.
Формулу мицеллы золя BaSO4, полученного при избытке K2SO4, можно записать так:
{m[BaSO4]∙nSO42-∙2(n-x)K+}2x-2xK+ (коэффициент 2 - для компенсации заряда потенциалопределяющих двухзарядных ионов SO42-).
Итак, в гетерогенной микросистеме, которой является мицелла с ионным стабилизатором, твердую фазу составляет агрегат с ПОИ, а все ПРИ находятся в жидкой фазе. Граница АА на схемах мицелл называется межфазной границей. Граница ВВ (между гранулой и диффузным слоем) называется границей скольжения. В электрическом поле по этой условной границе происходит взаимное перемещение дисперсной фазы (гранулы) и дисперсионной среды (ПРИ диффузного слоя) к противоположно заряженным электродам. Это рассмотренные ранее явления электрофорез и электроосмос.
Влияние электролитов на величину ζ – потенциала
Раньше отмечалось, что величина ζ – потенциала зависит от толщины диффузного слоя и является мерой устойчивости коллоидных систем. При сжатии диффузного слоя, например, вследствие увеличения концентрации
электролитов в дисперсионной среде, часть противоионов переходит за границу скольжения в адсорбционный слой. Дзета – потенциал при этом уменьшается по абсолютному значению.
Многозарядные ионы понижают величину ζ – потенциала больше однозарядных и могут вызвать перезарядку (изменить знак заряда коллоидных частиц).
При равенстве заряда больше понижают величину ζ – потенциала ио-
ны с большим радиусом:
Li+ < Na+ < K+ < Rb+ < Cs+
─────────────────────────→
способность понижать ζ – потенциал
Влияние электролитов, добавленных к золю, на величину его ζ – потенциала проявляется по-разному в зависимости от природы и концентрации добавляемых электролитов:
I. Введение в коллоидный раствор индифферентного электролита (ионы такого электролита не способны достроить кристаллическую решетку частицы дисперсной фазы).
При этом возможны два случая:
1.Добавляемый электролит имеет один ион, одинаковый с противоионами ДЭС золя. Например, к золю AgJ, стабилизированному KJ, добав-
лен KNO3.
Добавление такого электролита приведет к увеличению общего числа ПРИ (ионов К+). В результате этого возрастет, в первую очередь, их содержание в адсорбционном слое (для компенсации заряда ПОИ), что приведет к уменьшению количества ПРИ в диффузном слое, а, следовательно, и к уменьшению ζ – потенциала.
2.Вводимый электролит не содержит ионов, входящих в ДЭС золя.
Например, к тому же золю AgJ добавили FeCl3.
В этом случае ион Fe3+, заряд которого одинаков по знаку с зарядом ПРИ, будет выступать в роли иона – конкурента за нахождение в ДЭС. Будет происходить ионный обмен, в результате которого ζ – потенциал золя будет уменьшаться. Может произойти и перезарядка коллоидной частицы, поскольку адсорбционная способность иона-конкурента в данном случае больше, так как больше его заряд.
II. Добавление к золю неиндифферентного электролита (один из ионов электролита может достраивать кристаллическую решетку частицы дисперсной фазы).
Здесь тоже возможны два случая:
1. К золю добавлен тот же электролит, который образовал его ДЭС. Например, к золю AgJ с отрицательным зарядом частиц, добавлен KJ.
При небольших концентрациях такого электролита ζ – потенциал будет возрастать, а при больших концентрациях – уменьшаться, так как увеличение концентрации противоионов K+ будет приводить к уменьшению толщины диффузного слоя.
