
физкал
.pdf
Для гидрофильных поверхностей Б > 1, а для гидрофобных Б < 1. Природу твердой поверхности можно изменить, превратив гидрофильную поверхность в гидрофобную, а гидрофобную – в гидрофильную. Для этого на твердой поверхности создают адсорбционный
слой поверхностно-активного вещества.
Например, поверхность алюминиевой пластинки, обычно покрытая оксидной пленкой, гидрофильна (θ 40о). Такую пластинку можно сделать гидрофобной, обработав еѐ любым ПАВ (рис. Х.15).
Рис. Х.15. Схема инверсии смачивания.
Наоборот, можно сделать, чтобы гидрофобная поверхность парафина, например, смачивалась водой. Для этого в воде надо растворить небольшое количество ПАВ. Механизм инверсии смачивания связан с ориентацией ПАВ.
Инверсия смачивания – это превращение гидрофильной поверхности в гидрофобную и, наоборот, за счет адсорбции ПАВ.
Это используют в фармации для того, чтобы исключить отсыревание гигроскопических лекарственных порошков (изучается на кафедре фармацевтической технологии).
Х.5.4. Молекулярная адсорбция из растворов на твердых адсорбентах
Существенное отличие адсорбции веществ из раствора от адсорбции из газовой фазы состоит в том, что из раствора могут конкурентно адсорбироваться и растворитель, и растворенное вещество. Возможны два случая:
положительная адсорбция – если растворенное вещество адсорбируется в большем количестве, чем растворитель;
отрицательная адсорбция – если в большем количестве
адсорбируется растворитель.
Наличие положительной или отрицательной адсорбции определяется: 1) природой адсорбента, адсорбата и растворителя; 2) концентрацией раствора; 3) температурой.
1) Влияние природы адсорбента на процесс адсорбции молекул из растворов, как и в случае адсорбции газов, определяется: удельной поверхностью адсорбента и его сродством к сорбату (на гидрофильных адсорбентах хорошо адсорбируются полярные вещества, на гидрофобных – неполярные).
Природа растворителя должна сильно отличаться от природы растворенного вещества и адсорбента:

Если растворитель плохо смачивает твердую поверхность, то из раствора будет хорошо адсорбироваться растворенное вещество, т.е. будет положительная адсорбция. Например, гидрофобный адсорбент активированный уголь плохо смачивается полярной водой, поэтому он хорошо адсорбирует растворенные вещества из водных растворов.
Влияние природы адсорбата определяется несколькими правилами:
-Необходимо сродство между адсорбируемым веществом и адсорбентом
(правило «подобное взаимодействует с подобным»);
-правилом Шилова Н.А.:
Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента.
- правилом выравнивания полярности (правило Ребиндера П.А.):
На поверхности раздела фаз в первую очередь адсорбируются те вещества, которые выравнивают полярности контактируемых фаз.
Отсюда следует, что на полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей, а на неполярных адсорбентах – неполярные адсорбаты из полярных растворителей.
Эффективнее всего адсорбируются вещества, молекулы которых дифильные (ПАВ). Будет происходить их адсорбция на твердом адсорбенте с самопроизвольной чѐткой ориентацией молекул ПАВ на границе раздела твердое тело-раствор в соответствии с правилом уравнивания полярностей Ребиндера:
С увеличением молярной массы растворенного вещества его адсорбционная способность возрастает. Ароматические соединения адсорбируются лучше алифатических, а непредельные органические соединения – лучше предельных.
2) Относительно влияния концентрации можно указать, что положительная адсорбция эффективнее идет из разбавленных растворов, а отрицательная - из растворов большой концентрации.
На рисунке приведена зависимость удельной
адсорбции |
со |
с |
от исходной концентрации |
|
m |
||||
|
|
|||
адсорбтива в растворе (со). Вначале количество адсорбированного вещества растет с увеличением его концентрации в растворе, но затем начинает

преобладать адсорбция растворителя, поэтому со |
– с < 0 и дробь |
со с |
|
m |
|||
|
|
становится отрицательной (кривая опускается ниже оси абсцисс).
Влияние концентрации растворенного вещества на его адсорбцию из раствора при постоянной температуре описывается также уравнением изотермы адсорбции Ленгмюра (Х-5).
Для средних концентраций справедливо и уравнение изотермы адсорбции Фрейндлиха):
Г К с 1п (для растворов) и |
(Х-6) |
Г К р 1п (для газов),
где с и р – равновесные концентрация и давление, К и n – константы.
При логарифмировании уравнение Фрейндлиха переходит в линейную форму, которая дает возможность определить графически константы уравнения (рис. Х.16).
Рис. Х.16. Нахождение констант в уравнении Фрейндлиха графическим методом.
3) При повышении температуры адсорбция веществ из раствора обычно уменьшается. Причинами этого являются ослабление взаимодействия между адсорбтивом и адсорбентом, а также улучшение растворимости вещества в растворителе.
При адсорбции из смеси растворов могут наблюдаться явления синергизма, аддитивности и антагонизма.
Х.5.5. АДСОРБЦИЯ ИОНОВ ИЗ РАСТВОРОВ
На твердых адсорбентах могут адсорбироваться и ионы.
В зависимости от природы адсорбента процессы адсорбции ионов электролитов подразделяются на ионную и ионообменную адсорбцию.
При ионной адсорбции ионы из растворов электролитов адсорбируются на поверхности твердых веществ, кристаллическая решетка которых состоит из ионов или полярных молекул, т.е. на полярных адсорбентах.
Ионная адсорбция имеет ряд особенностей:
1. На поверхности адсорбента в результате адсорбции ионов, называемых потенциалопределяющими, возникает определенный заряд, который притягивает из раствора противоположно заряженные ионы –
противоионы, т.е. на границе раздела фаз возникает двойной электрический слой (ДЭС). Потенциалопределяющие ионы образуют внутреннюю обкладку

ДЭС, а противоины, расположенные в жидкой фазе, составляют внешнюю обкладку ДЭС.
2.Ионная адсорбция не всегда обратима, так как она может сопровождаться хемосорбцией, в результате которой может образоваться малорастворимое вещество.
3.Скорость ионной адсорбции меньше скорости молекулярной адсорбции, поскольку скорость диффузии сольватированных ионов меньше скорости диффузии молекул.
Адсорбируемость ионов зависит от:
величины заряда иона (многозарядные ионы адсорбируются лучше однозарядных);
радиуса и степени сольватации ионов.
Если заряд ионов одинаковый, то лучше адсорбируются ионы с большим радиусом (меньше их сольватация). По величине адсорбции ионы располагаются в лиотропные ряды:
Увеличение адсорбции
КАТИОНЫ: Li+ < Na+ < K+ < NH4+ < Rb+ < Cs+
Увеличение радиуса гидратированного иона
АНИОНЫ: F- < Cl- < Br- < J- < CNS-
Увеличение адсорбции
Адсорбция сильных электролитов бывает:
1.эквивалентная,
2.избирательная
3.ионообменная.
Эквивалентная – катионы и анионы адсорбируются в эквивалентных
количествах.
Избирательная адсорбция.
Она подчиняется правилу Панета–Фаянса:
На поверхности кристаллов труднорастворимого соединения из раствора преимущественно адсорбируются те ионы, которые могут достраивать его кристаллическую решетку, и изоморфные им по строению, или которые могут образовать с ионами противоположного знака в данном кристалле малорастворимое соединение.
Для иллюстрации этого правила рассмотрим зарядку поверхности кристаллического осадка AgJ, полученного в результате реакции:
mAgNO3 (p) + mKJ (p) → mAgJ (тв) + mKNO3(р).
-Если количества AgNO3 и KJ эквивалентны, то поверхность осадка не заряжена (образуется осадок AgJ);
-при избытке AgNO3 поверхность твердой фазы приобретает положительный заряд за счет адсорбции потенциалопределяющих ионов Ag+:
mKJ + (m + n)AgNO3 = [mAgJ∙nAg+]+ + nNO3- + mKNO3
тверд.
- при избытке KJ- поверхность AgJ заряжена отрицательно за счет адсорбции потенциалопределяющих ионов J-:
(m + n)KJ + mAgNO3 = [mAgJ∙nJ-]- + nK+ + mKNO3
тверд.
Ионы К+ и NO3- имеют малое химическое сродство к AgJ, не образуют с ионами Ag+ или J- труднорастворимые соединения, поэтому адсорбироваться не будут. Таким образом, потенциалопределяющие ионы, внедряясь в кристаллическую решетку малорастворимого вещества, в результате избирательной адсорбции сообщают соответствующей заряд поверхности кристалла, а противоионы нейтрализуют этот заряд, оставаясь в растворе. Потенциалопределяющими будут ионы, которые имеют большее химическое сродство к веществу твердой фазы и химический потенциал которых в растворе выше, чем в твердой фазе.
Избирательность адсорбции ионов позволяет сделать вывод, что избирательность имеет место и в живой природе. Так, токсины микробов избирательно поражают органы и ткани организма. Очень большой селективностью обладают иммунные белки (система антиген-антитело) и ферменты (система фермент - субстрат). Избирательная ионная адсорбция лежит в основе процессов образования коллоидных частиц (см. ХI.2).
Ионообменная адсорбция.
Ионообменной адсорбцией называется процесс эквивалентного обмена ионов адсорбента на ионы того же знака в растворе.
Ионообменная адсорбция протекает только на тех адсорбентах, которые являются практически нерастворимыми полиэлектролитами. В результате поверхностной диссоциации таких полиэлектролитов на границе раздела с растворителем образуется ДЭС из собственных ионов.
Адсорбенты, которые содержат катионы или анионы, способные к обмену с катионами или анионами в растворе, называются ионитами.
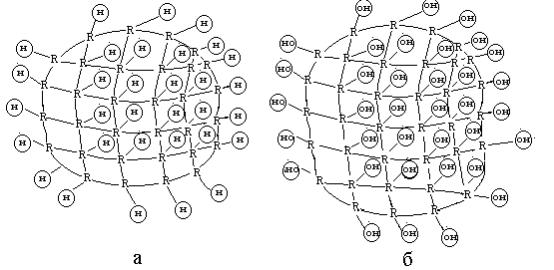
Иониты обладают сетчатой структурой (каркас, матрица) (рис. Х.17.).
Рис. Х.17. Структура зерна катионита (а) и анионита (б).

Полимерная матрица ионитов содержит ионогенные (функциональные) группы, в состав которых входят подвижные катионы или анионы.
Благодаря сетчатой структуре ионит, помещенный в воду или водный раствор, поглощает большое количество воды (иногда до 50%). Поглощенная вода гидратирует ионогенные группы, вызывая их ионизацию.
По типу ионогенных групп иониты делят на катиониты и аниониты. Катиониты представляют собой нерастворимые многоосновные
полимерные кислоты, которые при ионизации образуют катионы Н+. Активными группами катионитов являются группы: -SO3H, -COOH и
др.
При адсорбции катионы водорода, входящие в состав катионита, обмениваются на катионы, находящиеся в растворе:
|
SO3H |
|
|
|
|
SO3 |
|
R |
+ Ca2+ |
|
|
|
|
R |
Ca + 2H+ |
|
|
|
|||||
|
|
|
|
||||
|
SO3H |
|
|
|
|
SO3 |
|
где R – матрица ионита.
Перед применением катиониты промывают кислотой, переводя их в Н+ форму, и после этого медленно пропускают раствор, из которого катионит адсорбирует катионы.
Аниониты - это нерастворимые многокислотные полимерные основания, способные к обмену анионов.
Перед применением аниониты промывают щелочью, переводя их в ОН- форму, и после этого используют для очистки водных системы от анионов. Для анионитов характерны функциональные группы –NH2, =NH, ≡N и др.. Механизм ионного обмена анионита R(OH), можно представить так:
R(OH)n + nCl- RCln + nOH-.
Амфотерные иониты содержат и катионные, и анионные обмениваемые группы. Это синтетические вещества типа H+SO3- - R-N+(CH3)3OH-
Иониты – химически стойкие и механически прочные адсорбенты с разнообразными кислотно-основными свойствами и большой обменной ѐмкостью, легко регенерируются.
Обменная ѐмкость ионита – это количество ионов (моль или ммоль), поглощенных 1 г сухого ионита из раствора в равновесных условиях.
Обменная ѐмкость ионитов определяется в основном числом ионогенных групп в ионите. Однако на практике поглощающая способность ионита зависит так же от условий проведения ионообменной адсорбции и от свойств и размеров адсорбируемых ионов.
Определить обменную ѐмкость ионита можно с помощью уравнения изотермы ионного обмена Б.П.Никольского, выведенного им на основе термодинамики:
х1/Z1 1 K a1/Z1 1 x1/Z2 2 a1/Z2 2
где xi – количество ионов, поглощенное ионитом;
ai – активность ионов в равновесном растворе; zi – заряд ионов 1 и 2.
Константа К пропорциональна константе равновесия ионного обмена.
При условии а1 = а2 = 1 константа К равна отношению количества поглощенных ионов. Константа ионного обмена является количественной характеристикой сродства обменивающихся ионов к иониту. При прочих равных условиях лучше сорбируется тот ион, у которого больше сродство с ионитом.
Иониты используются в фармации для: 1) деминерализации воды; 2) выделения из смеси анализируемого компонента и количественного его определения; 3) для удаления солей из растворов различных лекарственных препаратов (антибиотиков, витаминов, алкалоидов и др.); 4) для приготовления инъекционных растворов. Иониты применяют для удаления ионов Са2+ из крови перед ее консервацией, детоксикации организма при различных отравлениях. Ионообменными свойствами обладают ткани растений и животных. Катионообменные свойства биосубстратов определяются наличием карбоксильных и фосфатных групп, а анионообменные – аминогруппами белков.
Х.6. ХРОМАТОГРАФИЯ
Хроматография – это физико-химический метод разделения и анализа смесей веществ, основанный на разнице сорбционного сродства разделяемых веществ к подвижной и неподвижной фазам.
Сущность хроматографического разделения смеси веществ заключается во внесении разделяемой смеси веществ в хроматографическое устройство, содержащее подвижную и неподвижную фазы. В соответствии с законами термодинамики и сорбционного равновесия каждое вещество смеси будет распределяться между подвижной и неподвижной фазами соответственно сродству его к этим фазам.
Например, вещества Х, У, Z в смеси будут перемещаться с подвижной фазой вдоль неподвижной. Эти вещества будут перемещаться вдоль неподвижной фазы с разными скоростями (рис. Х.18).

Рис. Х.18. Схема хроматографического разделения смеси веществ.
Вещество Z с большим сродством к неподвижной фазе (↑↓) имеет меньше скорость движения с подвижной фазой, чем вещество Х (одинаковое сродство к подвижной и неподвижной фазам - ↓↑) и У, у которого больше сродство к подвижной фазе (↑↓). Эти различия в свойствах веществ с течением времени и обусловят их разделение и приведут к появлению на неподвижной фазе отдельных зон, содержащих практически чистые разделяемые вещества Х, Y, Z.
Если отдельные компоненты имеют различную окраску, то эти зоны легко отличить по цвету.
Хроматографическая методика разделения веществ состоит из следующих этапов: 1) выбор и подготовка используемых образцов подвижной и неподвижной фаз; 2) нанесение анализируемой смеси на неподвижную фазу и введение подвижной фазы; 3) собственно хроматографирование, т.е. разделение веществ при движении подвижной фазы относительно неподвижной; 4) детектирование веществ, т.е. обнаружение местонахождения разделенных веществ на неподвижной фазе или в подвижной фазе после прохождения еѐ через неподвижную фазу; 5) количественное определение содержания веществ в разделенных зонах.
Классификация хроматографических методов
В зависимости от рассматриваемого признака хроматографического процесса различают следующие виды хроматографии.
I.По цели проведения:
-аналитическая хроматография (используется для качественного и количественного анализа смеси веществ);
-препаративная хроматография предназначена для выделения из смеси чистых компонентов или для очистки вещества от примесей.
II.По агрегатному состоянию подвижной фазы различают:
-газовую
-жидкостную хроматографии.
Вгазовой хроматографии подвижной фазой является газ, который называют газ-носитель, а неподвижной фазой – твердый адсорбент или нелетучая жидкость, нанесенная на твердый носитель. Газовую хроматографию применяют для разделения летучих термически устойчивых веществ. Для проведения газовой хроматографии используют хроматограф (ознакомитесь на кафедре аналитической и токсикологической химии).
Вжидкостной хроматографии подвижной фазой является жидкость. Неподвижной фазой служит твердый гранулированный адсорбент или тонкий слой жидкости, нанесенный на твердый носитель или содержащийся в нем.
III.По технике выполнения жидкостная хроматография делится на:
-плоскостную (тонкослойную или бумажную),
-объемную (колоночную).
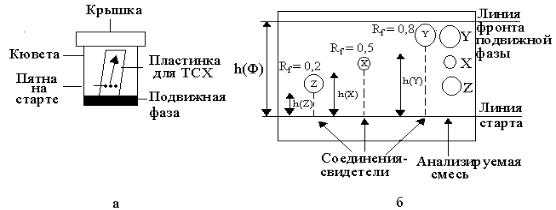
Втонкослойной хроматографии (ТСХ) в качестве твердой фазы используют силикагель, оксид алюминия, целлюлозу и др., которые наносятся тонким слоем на пластинку. На слой сорбента (линия старта) наносят анализируемую смесь (рис. Х.19, а). После высыхания пятна пластинку опускают в закрывающуюся камеру с подвижной фазой, которая поднимается по пластинке. Вещества в смеси передвигаются вместе с подвижной фазой с разными скоростями, которые зависят от их сорбционной способности. Когда подвижная фаза поднимется к верхнему краю пластинки, еѐ вынимают из камеры и высушивают.
На рисунке Х.19, б представлена тонкослойная хроматограмма, полученная при разделении смеси из трех веществ Х, У, Z.
Рис. Х.19. Схема тонкослойной хроматографии (а) и хроматограмма разделяемой смеси веществ (б).
Зоны разделения исследуют различными способами: опрыскивают хроматограмму окрашивающим реагентом; выдерживают в парах аммиака, брома, йода; изучают УФспектры поглощения, спектры флуоресценции и др.

Часто для идентификации веществ в анализируемой смеси используются соответствующие соединения – свидетели, которые наносятся при эксперименте на линию старта рядом с анализируемой смесью (рис. Х.19,
б).
Для идентификации веществ используется также величина Rf. Это отношение пути h(x), пройденного веществом «Х» к пути, пройденному подвижной фазой h(ф) от линии старта до линии фронта.
h(x) Rf(x) h(ф(
Величина Rf является качественной характеристикой данного вещества, поскольку величина Rf постоянна для данного соединения.
Бумажная хроматография по технике исполнения близка к ТСХ. Неподвижной фазой здесь служит фильтровальная или хроматографическая бумага.
В случае колоночной хроматографии сорбентом заполняется колонка, в верхнюю часть которой наносят анализируемую смесь и медленно пропускают подвижную фазу. Из-за разных сорбционных свойств каждый компонент смеси имеет свое время прохождения через колонку.
Широкое применение для анализа нелетучих веществ находит
высокоэффективная жидкостная хроматография (ВЭЖХ), которая осуществляется с помощью специального хроматографа. В отличие от газовой хроматографии в этом случае через колонку с неподвижной фазой под давлением пропускается жидкая подвижная фаза. В остальном ВЭЖХ подобна газовой хроматографии.
IV. По доминирующему механизму разделения веществ
хроматографию подразделяют на:
-адсорбционную,
-распределительную,
-ионообменную,
-молекулярно-ситовую (устаревшее название - гель-фильтрация).
Воснове адсорбционной хроматографии лежат различия в
адсорбции компонентов на поверхности адсорбента.
Враспределительной хроматографии разделение веществ происходит вследствие различия в коэффициентах распределения.
Вионообменной хроматографии разделение веществ основано на
различии их констант ионного обмена между раствором и ионитом.
Вмолекулярно-ситовой хроматографии разделение смеси веществ происходит вследствие различий в размерах их частиц. В качестве неподвижной фазы в этом случае используют пористые вещества – молекулярные сита, имеющие поры строго определенного размера R (декстрановые гели, полиакриламидные гели и др.). Хроматографическую колонку заполняют гранулами набухшего геля. В поры гранул могут проникать только частицы меньшего размера (R > r). При пропускании через колонку смеси веществ разделение происходит вследствие того, что частицы
