
физкал
.pdfIV.1. Введение
Из курса общей химии известно, что растворы бывают твердые, жидкие и газообразные. Число компонентов раствора может колебаться в широких пределах. Главным признаком растворов, находящихся в термодинамическом равновесии, является их гомогенность. Особый интерес всегда вызывали свойства жидких растворов, с которыми наиболее часто приходится сталкиваться человеку в своей практической деятельности.
По своей структуре жидкости занимают промежуточное положение между газами, в которых расположение частиц хаотичное, и кристаллами, в которых частицы упорядоченно располагаются в узлах кристаллической решетки. Образование раствора сопровождается появлением новых сил взаимодействия между частицами и нарушением структуры чистых жидкостей. Возникает новая структура с иным расположением частиц и иным взаимодействием между ними. Все это сильно влияет на процессы, протекающие в растворах.
Изучение взаимной растворимости жидкостей показало, что все жидкости в той или иной степени растворимы друг в друге. Однако эта растворимость настолько различна, что все жидкости можно разделить на три группы.
Кпервой группе относятся жидкости, смешивающиеся друг с другом в любых соотношениях (вода – этанол, бензол – толуол, этанол – метанол и др.).
Ко второй группе относятся жидкости, имеющие ограниченную растворимость друг в друге (вода – фенол, вода – анилин, вода – никотин, вода – диэтиламин и др.).
Ктретьей группе относятся жидкости, практически нерастворимые друг
вдруге (вода – ртуть, вода – бензол и др.).
В свою очередь жидкости первой группы можно разделить на три типа: а) идеальные жидкие растворы, подчиняющиеся закону Рауля; б) неограниченно растворимые жидкости с положительным отклонением от закона Рауля;
в) неограниченно растворимые жидкости с отрицательным отклонением от закона Рауля.
IV.2. Системы с неограниченной взаимной растворимостью компонентов
а. Идеальные растворы. Закон Рауля. Первый закон Коновалова. Простая и фракционная перегонки
Раствор, образованный веществами А и В, близкими по химическому составу и физическим свойствам, называется идеальным. В таком растворе силы взаимодействия между однородными и разнородными молекулами примерно одинаковы. Поэтому свойства идеального раствора зависят только
от его состава. Образование его не сопровождается изменением ни объема, ни энтальпии (dV = 0, dH = 0), ни степени диссоциации, ни степени ассоциации молекул, и при изменении состава такого раствора не происходит образования новой фазы (например, кристаллизации одного компонента). Идеальные растворы образуются близкими по природе жидкостями (бензолтолуол, метанол - этанол, н - гексан – н - гептан и др.), имеющими близкие значения дипольных моментов, поверхностного натяжения, диэлектрической проницаемости и др. Свойства этих растворов аддитивны.
Испарение каждой жидкости в идеальном растворе происходит независимо от присутствия другой жидкости без изменения энергии отрыва их молекул от поверхности. Но, поскольку, в единице объема такого раствора число молекул данной жидкости меньше, чем в единице объема чистой жидкости, то число молекул, перешедших в пар, уменьшится. Общее давление насыщенного пара над идеальным раствором будет равно сумме парциальных давлений насыщенных паров компонентов. Связь между содержанием компонента в растворе и парциальным давлением его насыщенного пара была установлена в 1848г. Ф. Раулем. Рассмотрим вывод закона Рауля.
Для чистого вещества в интервале температур от температуры плавления до температуры кипения в состоянии равновесия химический потенциал его в жидком состоянии равен химическому потенциалу в газообразном состоянии.
μж = μп
μoж+ RT∙ln xo= μoп+RT∙ln рo
где рo – давление насыщенного пара данного вещества; xo – молярная доля данного вещества в жидкости. Для чистого вещества xo = 1.
После добавления в систему второго вещества и наступления в образовавшемся растворе состояния равновесия химические потенциалы первого вещества в жидком и газообразном состояниях опять выравняются. При этом молярная доля его в растворе станет x, а давление его насыщенного
пара над раствором станет р.
μoж+ RT∙ln x = μoп+RT∙ln р
Вычтя из второго равенства первое, получим:
RT∙lnx – RT∙lnxo = RT∙lnр – RTlnрo,
а так как xo = 1, то ln x = ln р – ln рo или ln р = ln рo + ln x. Отсюда
р = рo∙х |
или в общем виде |
pi = pio∙xi |
(IV–1) |
где рio – давление |
насыщенного пара |
i-того компонента |
над чистой |
жидкостью; рi – давление насыщенного пара i-того компонента над раствором; xi – молярная доля данного компонента в растворе.
Исходя из уравнения (IV–1), закон Рауля гласит:
Парциальное давление насыщенного пара данного компонента над идеальным раствором при постоянной температуре равно произведению молярной доли этого компонента в растворе и давления его насыщенного пара над чистым компонентом.
Закон Рауля имеет ещѐ одну формулировку и математическое

выражение, которое может быть получено на основании следующих рассуждений. Предположим, что раствор состоит из двух летучих
компонентов А и В. Исходя из (IV – 1), можно записать, что рА = pAo∙хА, а так
как хA = 1 – хВ, получаем рА = pAo (1 – хВ) = рАo – рАo∙хВ рАo хВ = рАo – рА.
|
|
|
р |
р |
А |
|
р |
А |
|
х |
|
А |
|
|
(IV–2) |
||||
В |
|
р |
|
р |
|||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
А |
|
|
А |
|
|
Аналогичное выражение можно записать и для второго летучего компонента
В.
Если раствор состоит из летучего растворителя А и нелетучего компонента В, то в паровой фазе будет находиться только компонент А. Несмотря на это, из-за присутствия нелетучего компонента В испарение компонента А уменьшится и давление его насыщенного пара будет меньше, чем над чистым растворителем А. Влияние концентрации нелетучего компонента В на понижение давления насыщенного пара А также выражается уравнением (IV-2), но в этом случае рА = робщ, то есть давление пара растворителя А является общим давлением пара над раствором:
р |
|
рА |
робщ |
х |
|
(IV–2а) |
|
|
|
В |
|||
р |
р |
|
|
|||
А |
А |
|
|
|||
Для этого случая закон Рауля гласит:
относительное понижение давления насыщенного пара растворителя над идеальным раствором численно равно молярной доле нелетучего растворѐнного вещества.
Если раствор состоит из двух летучих компонентов А и В, то в паре над раствором будут находиться молекулы обоих компонентов и общее давление будет равно сумме парциальных
давлений компонентов А и В.
робщ. = рА + рВ = рАo ∙ хА + рВo ∙ хВ
Как видно из приведенных выражений, значения парциальных давлений компонентов и общего давления насыщенного пара над раствором является уравнением первой степени относительно молярной доли веществ. Поэтому при графическом выражении их на диаграммах (рис. IV–I) получают прямые линии. При этом содержание одного компонента по оси абсцисс в молярных долях убывает от 1 до 0 слева направо, а содержание другого компонента в этом направлении

возрастает от 0 до 1.
Из изотермы на диаграмме видно:
1)каждый из летучих компонентов имеет наибольшее давление насыщенного пара над чистой жидкостью;
2) общее давление насыщенного пара над раствором есть величина
аддитивная: робщ = рА + рВ; 3) понижение молярной доли компонента в растворе приводит к понижению
его парциального давления в паре, что равносильно понижению его содержания в паре;
4) увеличение содержания более летучего компонента В в растворе повышает общее давление над раствором и, следовательно, понижает температуру кипения раствора;
5) состав жидкого раствора не совпадает с составом пара над ним: в парах всегда содержится больше более летучего компонента.
В этих выводах заключена сущность первого закона Д. П. Коновалова:
Над бинарным жидким раствором пар относительно обогащен тем компонентом, прибавление которого к раствору повышает общее давление пара и уменьшает температуру кипения раствора при данном давлении.
Из-за несовпадения составов жидкой и парообразной фаз оказалась возможной перегонка идеальных растворов. Применяют простую и фракционную перегонки жидкостей.
При простой перегонке жидкость нагревают до кипения и образующийся при этом пар отводят и конденсируют. В полученном конденсате содержание более летучего компонента системы выше, чем в исходном растворе. На диаграмме кипения (рис. IV–II) простую перегонку можно проиллюстрировать следующим образом. Жидкость исходного состава Y1 закипает при Т1, при этом образуется пар состава X1.
Этот пар отводят и конденсируют. Обычно нагревание продолжают некоторое время, так как вследствие повышенного содержания в паре вещества В его количество в растворе уменьшается, что приводит к изменению состава жидкости до Y2 и повышению температуры кипения до Т2. Последние порции отобранного и
сконденсированного при этой температуре пара имеют состав X2. Общий состав раствора, полученного в результате конденсации паров, имеет среднее значение между X1 и X2. Как видно из диаграммы, полученный конденсат по сравнению с исходным раствором существенно обогащѐн компонентом В. Если нагрев жидкости не прекращать, то еѐ последние порции при Т→ТoА будут представлять почти чистый компонент А, в то время как выделить
практически чистый компонент В в процессе простой перегонки невозможно, поэтому простая перегонка применяется, если не требуется разделить раствор на чистые компоненты. Проведение еѐ целесообразно, если температуры кипения компонентов сильно отличаются.
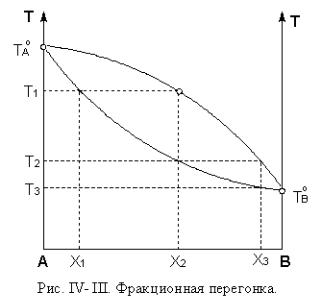
Фракционная перегонка заключается в многократном повторении простой перегонки. Допустим, что исходный раствор имеет состав Х1 (рис. IV-III). Отобранный при температуре кипения этого раствора Т1 пар состава Х2 был сконденсирован (фракция 1).
Этот конденсат отдельно нагревают, и он закипает при Т2, при этом состав сконденсированного пара будет Х3 (фракция 2). При нагревании второй фракции она закипит при Т3, при этом в пар переходит практически чистый компонент В. При дальнейшем нагревании исходного раствора, как и в случае простой перегонки, последние порции жидкости будут представлять собой практически чистый компонент А. На практике для получения больших количеств чистых компонентов различные конденсаты и остатки,
близкие по составу, перед повторным нагреванием объединяют. Таким образом, фракционная перегонка позволяет разделить жидкие растворы на составляющие компоненты.
На практике фракционную перегонку в описанном виде осуществлять неудобно, так как многостадийность процесса требует больших затрат времени и оборудования. Поэтому в лабораториях пользуются дефлегматором, а в промышленности используются ректификационные колонны, в которых происходит более полное разделение перегоняемых жидкостей. В ректификационных колоннах для более эффективного разделения смеси пары заставляют проходить сквозь тонкие слои конденсата, который собирается на поперечных перегородках (тарелках). Горячие пары, проходя сквозь слой жидкости на такой тарелке, несколько охлаждаются, и при этом преимущественно конденсируется высококипящий (менее летучий) компонент. Выделяющаяся при этом теплота конденсации идѐт на дополнительное испарение легколетучего компонента. Вследствие этого, пары обогащаются на каждой тарелке легколетучим компонентом. При последовательном прохождении нескольких тарелок пар практически полностью освобождается от менее летучего компонента. Жидкость, обогащѐнная высококипящим компонентом, по специальным переливным устройствам стекает с верхних тарелок на более низкие и попадает в конечном итоге в перегонный куб.
Ректификация находит применение для выделения практически чистого

этилового спирта из водного раствора, получаемого при производстве этанола методом брожения. Так же выделяют ацетон из водных растворов, получаемых в процессе сухой перегонки дерева. Применяется ректификация для разгонки эфирных масел, при получении полупродуктов в синтезе химиотерапевтических препаратов (при получении амидопирина, барбитуратов, лидола и др.).
б. Неидеальные растворы
Большинство реальных жидких растворов, состоящих из неограниченно смешивающихся жидкостей, имеют отклонения от закона Рауля. Отклонения от идеальности обусловлены как физическими, так и химическими причинами (различием в дипольных взаимодействиях, влиянием водородных связей, различием интенсивности ван-дер-ваальсовых сил, поляризации и вызываемых этими причинами различиях в ассоциации, диссоциации и сольватации молекул). Все эти взаимодействия тесным образом переплетены между собой. Однако, благодаря преобладанию одной из форм взаимодействия, можно произвести классификацию растворов по признаку отрицательного и положительного отклонений от закона Рауля.
Если силы взаимодействия между разнородными молекулами превосходят силы взаимодействия между одинаковыми молекулами компонентов, то разнородные молекулы стремятся объединиться и образовать ассоциаты. Образование таких растворов сопровождается выделением тепла ( Н 0)
и уменьшением общего объема системы по сравнению с суммой объѐмов смешиваемых жидкостей. Испарение жидкостей из такой смеси затрудняется, что приводит к понижению давления насыщенного пара как каждого компонента, так и общего давления (рис. IV–IV). В этом случае говорят об
отрицательном отклонении системы от закона Рауля. Примерами растворов такого типа являются системы: «хлороформ – ацетон», «хлороформ – бензол», «уксусная кислота – пиридин» и др.
Если силы взаимодействия разнородных молекул слабее сил взаимодействия между одинаковыми молекулами, то одноименные молекулы
стремятся к ассоциации. Образование таких растворов сопровождается поглощением тепла ( Н 0) и увеличением общего объѐма системы по сравнению с суммой объѐмов смешиваемых жидкостей. Выход молекул каждого компонента из раствора в пар облегчѐн по сравнению с чистыми жидкостями, поэтому давление пара оказывается большим, чем над

идеальным раствором, и наблюдается
положительное отклонение системы от закона Рауля (рис. IV–V). Примером таких систем являются «сероуглерод – ацетон», «вода
– пиридин» и др.
В реальных растворах пропорциональности между давлением пара и составом раствора соблюдаются лишь при малых (теоретически бесконечно малых) концентрациях компонентов.
Если отклонения от идеальности очень велики или давления насыщенных паров над чистыми жидкостями близки между собой, то на кривых «давление пара – состав» может появиться максимум при положительном отклонении от закона Рауля (рис. IV–VI) или минимум при отрицательном отклонении
(рис. IV–VII).
Растворы, отвечающие по составу экстремальным точкам, называются
азеотропными, нераздельно кипящими, постоянно кипящими или неразгонными. Свойства таких растворов обобщены вторым законом Д. П.
Коновалова:
В точках экстремума давления пара (или температуры кипения) составы жидкости и пара совпадают. Максимуму на кривой давления пара отвечает минимум на кривой температуры кипения, а минимуму на кривой давления пара отвечает максимум на кривой температуры кипения.
При кипении состав азеотропных растворов не меняется, и его температура кипения при заданном внешнем давлении остается постоянной, как у чистых веществ. Изменение внешнего давления приводит к изменению состава азеотропного раствора. Это указывает на то, что азеотропы не являются химическими соединениями.
Как видно из рисунков IV–VI и IV–VII, при наличии экстремальных точек полное разделение таких растворов на компоненты фракционной перегонкой невозможно. При фракционной перегонке систем, имеющих минимум на кривой температуры кипения, состав дистиллята последовательно приближается к составу азеотропа, а оставшаяся в перегонном аппарате жидкость обогащается компонентом, который в исходном растворе был в избытке относительно азеотропа.
В системах, имеющих максимум на кривых температуры кипения, дистиллят обогащается компонентом, содержащимся в избытке относительно азеотропа, а в перегонном аппарате накапливается раствор, по составу приближающийся к азеотропу.

Рис. IV-VI. Диаграммы «давление пара – состав» и «температура кипения – состав» при больших положительных отклонениях от закона Рауля.
Рис. IV-VII. Диаграммы «давление пара – состав» и «температура кипения – состав» при больших отрицательных отклонениях от закона Рауля.
Следовательно, для разделения азеотропных растворов необходимо применять иные методы (например, химическое связывание одного из компонентов азеотропа; добавление третьего компонента, изменяющего температуру кипения смеси) или вести процесс при давлении, когда азеотропия исчезает.
IV.3. Ограниченно смешивающиеся жидкости
Жидкости, относящиеся к данному типу, в определенной области температур только частично растворимы друг в друге, и величина растворимости в этой области является функцией температуры. Явление ограниченной растворимости было изучено в 1875 – 1886 гг. В.Ф. Алексеевым с помощью построения диаграмм растворимости в координатах «температура растворения – состав».
Для построения такой диаграммы готовят ряд смесей известного состава в широком интервале концентраций (состав обычно выражают в массовых процентах). Каждую смесь, находящуюся в запаянной пробирке, медленно нагревают и при постоянном встряхивании определяют температуру, при которой мутная смесь превращается в прозрачный гомогенный раствор. Найденные температуры растворения смесей наносят на

диаграмму и соединяют плавной кривой, выражающей зависимость температуры растворения от состава смеси. Полученная кривая называется кривой растворения или кривой расслоения. Любая точка области, ограниченной кривой расслоения, отвечает гетерогенной двухслойной системе, а любая точка вне этой области – гомогенной системе.
Системы из двух жидкостей с ограниченной растворимостью дают диаграммы нескольких типов, характеризующиеся определенным видом зависимости растворимости жидкостей от температуры. Наиболее распространенными являются системы, в которых взаимная растворимость
Т |
|
Т |
компонентов |
увеличивается |
с |
||||
|
|
|
ТК |
повышением |
|
температуры. |
|||
|
|
|
Примером такой бинарной системы |
||||||
|
|
|
|
||||||
|
|
|
|
может |
служить «вода |
– анилин» |
|||
|
|
|
|
(рис. IV–VIII). |
|
|
|
||
|
|
b |
Тb |
Если |
к |
определенному |
|||
|
|
|
количеству |
воды, |
например, |
при |
|||
|
b1 |
b2 |
|||||||
|
|
температуре Тb, при интенсивном |
|||||||
|
|
|
|
||||||
|
|
|
|
перемешивании |
|
прибавлять |
|||
Вода |
|
Анилин |
небольшими порциями анилин, то до |
||||||
Состав |
насыщения |
воды |
анилином |
будет |
|||||
|
|
|
|
||||||
Рис.IV-VIII. Диаграмма растворимости |
существовать гомогенный раствор. В |
||||||||
|
|
“вода - анилин” |
|
точке |
b1, лежащей |
на |
левой |
ветви |
|
кривой расслоения, водный слой достигает насыщения анилином. При дальнейшем добавлении анилина система расслаивается на два слоя вследствие образования нового слоя – насыщенного раствора воды в анилине, состав которого при данной температуре определяется точкой b2, лежащей на правой ветви кривой расслоения. В системе устанавливается двухфазное гетерогенное равновесие между водным слоем, представляющим собой насыщенный раствор анилина в воде, и анилиновым слоем – насыщенным раствором воды в анилине. Вначале количество анилинового слоя мало. По мере добавления в систему анилина количество анилинового слоя увеличивается, а количество водного слоя уменьшается. При постоянной температуре Тb составы этих слоев постоянны и соответствуют точкам b1 и b2; изменяются только количества (масса и объѐм) каждого слоя. Наконец, при определенном содержании анилина, соответствующем точке b2, водный слой исчезает и остается один гомогенный раствор воды в анилине.
Таким образом, смешение анилина и воды в любых соотношениях, отвечающих интервалу между концентрациями насыщенных растворов анилина в воде и воды в анилине (в области между точками b1 и b2), приводит к образованию двух равновесных жидких фаз с определенным и постоянным для данной температуры составом каждой из них. Такие равновесные насыщенные растворы называют сопряженными, а точки b1 и b2 – сопряженными точками. Прямая b1b2, соединяющая равновесные насыщенные при данной температуре растворы, называется коннодой.
Относительные количества сопряженных растворов определяются по
правилу рычага: отношение масс равновесных фаз равно отношению
противолежащих отрезков конноды, которые она образует с перпендикуляром, выражающим состав исходной смеси.
Например, если исходная смесь имеет состав, определяемый точкой b, то при температуре Тb по правилу рычага соотношение масс слоев составов b1 и b2 определяется соотношением отрезков конноды b2b и bb1:
масса слоя состава |
b1 |
|
b2b |
|
(IV – 3) |
|
масса слоя состава |
b2 |
bb1 |
||||
|
|
|||||
При повышении температуры взаимная растворимость анилина и воды возрастает, сопряженные точки сближаются и, наконец, сливаются в одну критическую точку. Соответствующая этой точке температура ТК называется
верхней критической температурой растворения. Выше этой температуры оба компонента растворяются друг в друге неограниченно.
Экспериментальное нахождение критической температуры растворения производится по правилу прямолинейного диаметра Алексеева и Ротмунда:
прямая, проведенная через середины коннод, пересекает кривую расслоения в точке, соответствующей критической температуре растворения.
Кроме рассмотренного типа систем с верхней критической температурой растворения существуют еще три типа бинарных систем с ограниченной растворимостью компонентов.
Системы, например, «вода – триэтиламин», «γ–коллидин – вода», «вода
– этилпиперидин» и некоторые другие имеют кривые взаимной растворимости с минимумом, соответствующим нижней критической температуре растворения. Для таких систем по мере понижения температуры характерно увеличение взаимной растворимости компонентов. Точки, отвечающие концентрациям сопряженных растворов, сближаются с понижением температуры и сливаются в одну критическую точку. При дальнейшем понижении температуры компоненты неограниченно взаимно растворимы.
В определенных условиях возможно существование бинарных систем,
обладающих и нижней, и верхней критическими температурами растворения. Примером таких систем являются: «никотин – вода», «глицерин – μ-толуидин», «глицерин – гваякол» и др.
Наконец, существуют системы, для которых не удается достигнуть ни нижней, ни верхней критических температур растворения. Например, в системе «этиловый эфир – вода» при температуре – 269,35К слой, состоящий из насыщенного раствора эфира в воде, замерзает, и ниже этой температуры существует только раствор, содержащий ~ 1% (масс) воды в эфире. Поэтому достигнуть нижней критической температуры не удается. С другой стороны, при 293,15К эфирный слой, содержащий ~ 2% (масс) воды, достигает критической температуры, выше которой в виде жидкости существует только водный раствор эфира. В интервале между указанными температурами существуют сопряженные растворы, состав которых зависит от температуры.
