
- •Кафедра биологической химии, клинической лабораторной диагностики,
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •Модуль і: Введение в метаболизм Практическое занятие №2 Тема «Физико-химические свойства ферментов их биологическое и медицинское значение: Кинетика ферментативных реакций»
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Заполнить таблицу «Влияние факторов среды на скорость ферментативной реакции»:
- •7. Установите соответствие. Класс ферментов:
- •Лабораторная работа: «Влияние различных факторов на активность фермента каталазы»
- •Модуль I: Введение в метаболизм Практическое занятие №3
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •1. Выберите правильный ответ. Конкурентные ингибиторы:
- •Модуль I: Введение в метаболизм
- •Практическое занятие №4
- •Тема «Физико-химические свойства ферментов
- •Их биологическое и медицинское значение: Использование ферментов в медицине»
- •1. Выберите правильные ответы. Энзимодиагностика основана на:
- •2. Установите соответствие. Используется для диагностики заболеваний:
- •3. Выполните «цепное» задание:
- •4. Выполните «цепное» задание:
- •Модуль і: Введение в метаболизм Практическое занятие №5 Тема «Биологическое окисление: Цикл Кребса»
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Решить задачу:
- •3. Заполнить таблицу «Пируватдегидрогеназный комплекс»
- •4. Перенести в тетрадь схему цикла Кребса. На схеме отметить
- •5. Оформить лабораторную работу.
- •Лабораторная работа «Качественная реакция на витамин в2 (рибофлавин)»
- •Модуль і: Введение в метаболизм
- •Практическое занятие №6
- •Тема «Биологическое окисление:
- •Реакции взаимосвязи цтк с окислительным фосфорилированием»
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •1. Пользуясь схемой «Митохондриальная дыхательная цепь», выполните следующие задания:
- •Модуль і: Введение в метаболизм Практическое занятие №7 Тема «Биологическое окисление: Внемитохондриальное окисление»
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Заполнить таблицу «Механизм обезвреживания активных форм кислорода»
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •Задания для контроля уровня сформированности компетенций в учебное время.
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Заполнить таблицу «Переваривание углеводов»
- •Тесты для самоконтроля подготовки к практическому занятию.
- •1. Выберите процессы, происходящие при пищеварении.
- •Модуль II Метаболизм углеводов Практическое занятие №10 Тема «Катаболизм углеводов в тканях: Анаэробный и аэробный гликолиз»
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •Модуль II Метаболизм углеводов
- •Практическое занятие №11
- •Тема «Катаболизм углеводов в тканях:
- •Катаболизм глюкозы по механизму пентозофосфатного пути»
- •Задания для самостоятельной подготовки к практическому занятию:
- •Модуль II Метаболизм углеводов Практическое занятие №12 Тема: Анаболизм углеводов в тканях и механизмы регуляции уровня глюкозы в крови: Глюконеогенез. Обмен гликогена
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •1. Выполните «цепное» задание.
- •Модуль II Метаболизм углеводов Практическое занятие №13
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Оформить лабораторную работу.
- •1. Выполните «цепное» задание:
- •2. Выполните «цепное» задание:
- •Модуль II Метаболизм углеводов Практическое занятие №14
- •Задания для самостоятельной подготовки к практическому занятию:
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •Лабораторная работа №1. «Изучение углеводного обмена методом нагрузок»
- •Работа №2 Количественное определение глюкозы в моче с помощью глюкотеста (экспресс-метод)
- •Модуль III: Метаболизм липидов Практическое занятие №15
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. . Оформить лабораторную работу
- •3. Заполнить таблицу «Липиды мембран».
- •Лабораторная работа: Количественное определение липопротеинов низкой плотности
- •Модуль III: Метаболизм липидов Практическое занятие №16 Тема: Пути обмена жирных кислот, значение каждого пути.
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Оформить лабораторную работу
- •Работа №1. Определение кетоновых тел в моче экспресс-методом
- •2. В моче больного с выраженной кислой реакцией определили содержание -гидроксибутирата. Из какого предшественника он может образоваться?
- •3. У экспериментального животного, не получавшего с пищей некоторые витамины, обнаружено нарушение распада вжк в печени. При отсутствии какого витамина в пище может нарушиться этот процесс ?
- •Модуль III: Метаболизм липидов Практическое занятие №17 Тема: Обмен липидов в тканях
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Для расчета индивидуального имт определить свой рост и массу тела
- •1. Выберите правильный ответ: При мобилизации жиров:
- •2. Установите соответствие
- •3. Установите соответствие
- •Модуль III: Метаболизм липидов Практическое занятие №18 Тема: Обмен холестерина
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Написать в тетрадях реакции биосинтеза холестерина до стадии образования мевалоновой кислоты и письменно ответить на следующие вопросы:
- •3. Оформить лабораторную работу
- •Работа №1. Определение общего холестерина крови ферментативным методом
- •Работа №2.
- •1. Перечень контрольных вопросов для самоконтроля знаний.
- •2. Подготовиться к контрольной работе по модулю ш согласно содержанию теоретических вопросов в методических указания для студентов №№15-19
- •3. Подготовить доклады к конференции по следующим вопросам
2. Заполнить таблицу «Влияние факторов среды на скорость ферментативной реакции»:
|
Фактор |
График зависимости |
Механизм влияния |
Применение эффекта в медицине и фармации |
|
рН |
|
|
|
|
t◦ |
|
|
|
|
[S] |
|
|
|
|
[F] |
|
|
|
3. Оформить лабораторную работу.
Задания для самоконтроля подготовки к практическому занятию (тесты):
1. Выберите правильные ответы. Ферменты:
A. Являются белками
Б. Снижают скорость ферментативных реакций
B. Обладают специфичностью действия Г. Являются простыми белками Д. Способны к регуляции
2. Выберите правильные ответы. Константа Михаэлиса (Кm):
A. Является характеристикой субстратной специфичности фермента Б. Численно равна концентрации субстрата, при которой наблюдается половина Vmax
B. Характеризует сродство фермента к субстрату
Г. Характеризует насыщенность активного центра фермента субстратом Д. Является кинетической характеристикой фермента
3. Выберите правильные ответы. Кофермент ПФ функционирует с ферментами классов:
A. Оксидоредуктаз Б. Трансфераз
B. Гидролаз Г. Лиаз Д. Изомераз
4. Установите соответствие. Тип реакции, в которой участвует кофермент:
А. Карбоксилирование Б. Окисление-восстановление
В. Трансаминирование Г. Ацилирование Д. Ацетилирование
Кофермент:
1. Биотин
2. Пиридоксальфосфат
3. NAD+
5. Установите соответствие. Фермент катализирует:
A. Только необратимые реакции
Б. Однотипные реакции с небольшим числом (группой) структурно сходных субстратов
B. Превращение только одного из существующих стереоизомеров субстрата
Г. Реакции в присутствии коферментов
Д. Превращение только одного субстрата
Субстратная специфичность:
1. Абсолютная
2. Групповая
3. Стереоспецифичность
6. Выполните «цепное» задание:
а) окислительно-восстановительные реакции катализируют ферменты класса:
A. Трансферазы
Б. Оксидоредуктазы
B. Лигазы
б) ферменты, относящиеся к подклассу этого класса, осуществляют реакции
отщепления атомов водорода от субстрата:
A. Оксидазы
Б. Гидроксилазы
B. Дегидрогеназы
в) коферментом для этих ферментов является:
A. Биотин
Б. Кофермент А
B. NAD+
г) кофермент построен на основе витамина:
A. Никотиновая кислота
Б. Биотин
B. Витамин В2
д) недостаток этого витамина приводит к заболеванию:
A. Цинга
Б. Пеллагра
B. Макроцитарная анемия
7. Установите соответствие. Класс ферментов:
A. Оксидоредуктаза
Б. Гидролаза
B. Лигаза
Г. Лиаза
Д. Трансфераза
Фермент:
1. Сукцинатдегидрогеназа
2. Пируваткарбоксилаза.
3. ДНКаза.
Ориентировочная основа действия для проведения самостоятельной работы студентов в учебное время.
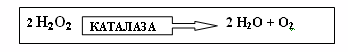
Лабораторная работа: «Влияние различных факторов на активность фермента каталазы»
Принцип методаКаталаза- это фермент, который встречается в организме человека преимущественно в печени и эритроцитах. Он разлагает перекись водорода, токсический побочный продукт клеточного дыхания, на воду и кислород.
Подготовка эксперимента
Положить печень цыпленка в ступку, пестиком измельчить ткань печени до однородного состояния, постепенно добавить воду (общий объем воды 10 мл). Полученный сок профильтровать через сито.
1 мл полученного « печеночного сока» налить в пенициллиновый флакон и поместить в водяную баню на 5 минут.
1 мл полученного « печеночного сока» налить в пенициллиновый флакон и поместить в поддон со льдом до проведения эксперимента.
Эксперимент № 1 «Изучение ферментативной активности каталазы»:
Порядок выполнения
1.Налить 10 мл 3% раствора перекиси водорода в цилиндр объемом 100 мл и добавить 50 мл дистиллированной воды.
2. Вылить получившийся раствор в колбу Эрленмейера, положить в нее брусок для магнитной мешалки, поставить колбу на магнитную мешалку, зафиксировать горловину зажимом (как показано на рисунке).
3. Добавить 1 мл « печеночного сока» и немедленно закрыть колбу пробкой ( предварительно смазанной глицерином).
4. Немедленно начать измерения (время работы 120 сек).
5. Включить магнитную мешалку.
6. Зарисовать в тетрадь полученный график.
Наблюдения и результаты:
В колбе наблюдается отчетливое выделение пузырьков с кислородом. Кривая давления резко возрастает, но затем вертикально падает, из-за того, что резиновую пробку выбило давлением с колбы.
Эксперимент №2 «Влияние щелочной среды на активность фермента»:
1.Налить 10 мл 3% раствора перекиси водорода в цилиндр объемом 100 мл и добавить 50 мл дистиллированной воды.
2. Добавить 10 мл 1 молярного раствора NaOH.
3. Вылить получившийся раствор в колбу Эрленмейера, положить в нее брусок для магнитной мешалки, поставить колбу на магнитную мешалку, зафиксировать горловину зажимом (как показано на рисунке).
4. Добавить 1 мл « печеночного сока» и немедленно закрыть колбу пробкой ( предварительно смазанной глицерином).
5. Немедленно начать измерения (время работы 120 сек).
6. Включить магнитную мешалку.
7. Зарисовать в тетрадь полученный график.
Наблюдения и результаты:
Визуально реакция протекает слабее. Кривая давления возрастает гораздо менее резко, чем при нормальных условиях, что говорит о снижении активности фермента при сдвиге рН в щелочную сторону.
Эксперимент №3: «Влияние кислой среды на активность фермента»:
1.Налить 10 мл 3% раствора перекиси водорода в цилиндр объемом 100 мл и добавить 50 мл дистиллированной воды.
2. Добавить 10 мл 1 молярного раствора HCI.
3. Вылить получившийся раствор в колбу Эрленмейера, положить в нее брусок для магнитной мешалки, поставить колбу на магнитную мешалку, зафиксировать горловину зажимом (как показано на рисунке).
4. Добавить 1 мл « печеночного сока» и немедленно закрыть колбу пробкой
( предварительно смазанной глицерином).
5. Немедленно начать измерения (время работы 60 сек).
6. Включить магнитную мешалку.
7. Зарисовать в тетрадь полученный график.
Наблюдения и результаты:
Выделение пузырьков кислорода не наблюдается, давление в колбе остается постоянным. Кривая давления не возрастает, что говорит об отсутствии активности каталазы в кислой среде.
Эксперимент №4 «Влияние высокой температуры на активность фермента»:
1.Налить 10 мл 3% раствора перекиси водорода в цилиндр объемом 100 мл и добавить 50 мл дистиллированной воды.
2. Вылить получившийся раствор в колбу Эрленмейера, положить в нее брусок для магнитной мешалки, поставить колбу на магнитную мешалку, зафиксировать горловину зажимом (как показано на рисунке).
3. Добавить 1 мл « печеночного сока», предварительно прогретого на водяной банеи немедленно закрыть колбу пробкой (смазанной глицерином).
4. Немедленно начать измерения (время работы 60 сек).
5. Включить магнитную мешалку.
6. Зарисовать в тетрадь полученный график.
Наблюдения и результаты:
Выделение пузырьков кислорода не наблюдается. Кривая давления не возрастает, что говорит о потере ферментом своей активности при нагревании, вследствие денатурации.
Эксперимент №5 «Влияние низкой температуры на активность фермента»:
1.Налить 10 мл 3% раствора перекиси водорода в цилиндр объемом 100 мл и добавить 50 мл дистиллированной воды.
2. Вылить получившийся раствор в колбу Эрленмейера, положить в нее брусок для магнитной мешалки, поставить колбу на магнитную мешалку, зафиксировать горловину зажимом (как показано на рисунке).
3. Добавить 1 мл охлажденного« печеночного сока» и немедленно закрыть колбу пробкой (смазанной глицерином).
4. Немедленно начать измерения (время работы 120 сек).
5. Включить магнитную мешалку.
6. Зарисовать в тетрадь полученный график.
Наблюдения и результаты:
В колбе наблюдается отчетливое выделение пузырьков с кислородом. Кривая давления резко возрастает, но затем вертикально падает, из-за того, что резиновую пробку выбило давлением с колбы. Резкое охлаждение, в отличие от нагревания, деактивирует каталазу лишь временно. Когда температура повышается, фермент снова начинает нормально работать.
Клинико-диагностическое значение:
Антисептические и противомикробные свойства перекиси водорода: водный раствор перекиси водорода часто используют для очищения ран и гнойников. Основным принципом действия препарата является обильное освобождение кислорода под действием каталазы крови, что приводит к механическому очищению, дезинфекции поверхности.
На пероксидазном действии крови основаны качественные реакции (например, реакция Грегерсена) обнаружения кровив моче, кале, желудочном соке, рвотных массах и других средах, а также на различных предметах, инструментарии и т.п.
Знания о термолабильности ферментовучитывается в практической медицине в следующих случаях:
● Гипертермия используется для как метод лечения некоторых патологических процессов, например в онкологии. Температурная деструкция белков применяется в хирургии (коагуляторы), при обеззараживании медицинских инструментов и средств ухода;
● гипотермия используется для снижение интенсивности метаболических процессов при выполнении тяжелых хирургических манипуляций с целью уменьшения осложнений (кардиохирургия); криоконсервация позволяет сохранять жизнеспособность органов и тканей при трансплантации, консервировать стволовые, половые клетки, пуповинную кровь, эмбрионы.
4. Ферменты обычно наиболее активны в пределах узкой зоны рН. рН крови человека колеблется в пределах от 7,37 до 7,43, а изменение этих значений всегда критично для витальных функций организма. Сдвиг рН в кислую сторону называетсяАЦИДОЗ, в щелочную – АЛКАЛОЗ. Оба этих патологических состояния требуют немедленного оказания медицинской помощи.
Задания для контроля уровня сформированности компетенций в учебное время.
Вопросы:
Перечислите факторы, влияющие на скорость ферментативной реакции.
Что такое температурный оптимум ферментов?
Чему равен температурный оптимум для большинства ферментов человеческого организма?
Что такое оптимум рН фермента? Какой оптимум рН: а) амилазы слюны, б) пепсина, в) химотрипсина?
Что такое константа Михаэлиса? Какие свойства фермента характеризуются константой Михаэлиса?
Этапы проведения занятия:
1) Вводная беседа – 5 мин
2) Выполнение лабораторной работы – 45 мин.
3) Обсуждение теоретических вопросов - 35 мин
4) Подведение итогов занятия - 5 мин
Оценивание уровня сформированности компетенций обучающихся проводится по балльно – рейтинговой системе
