
- •1. Молекулалық жүйенің статистикалық және термодинамикалық зерттеу әдістері,
- •4.Идеал газ молекулаларының орташа кинетикалық энергиясы.
- •6. Қысымның газдың тығыздығымен байланысын дәлелдеңіз және қысым мен тығыздықарқылы газдыњ молекулаларының орташа квадраттық жылдамдығын анықтаңыз.
- •7. Температура түсініктемесі. Температуралық шкала, реперлік нүктелер, температураны
- •8. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық
- •9. Менделеев-Клапейрон теңдеуін молекула-кинетикалық теорияның негізгі теңдеуінен
- •11. Молекулалық жүйедегі кездейсоқ оқиғалар мен кездейсоқ шамалар. Броундық
- •13. Изотермдік жағдайда ауаның қысымының Жердің бетінен биіктікке тәуелділігі. Барометрлік формула (қорытыңыз). Барометрлік формула
- •14.Үлестірілу функциясы туралы түсінік
- •15. Молекуланың жылдамдығына тәуелді функцияның (скалярлық, векторлық немесе
- •16. Максвеллдің үлестірілу функциясының жылдамдықтың х –компоненті үшін түрі,
- •17.Молекулалардың жылдамдықтар модулі бойынша үлестірілуі. Максвел заңы f(||)-ның V-қа тәуелділігін сипаттайтын графикті сызып, талдаңыз.
- •18. Әр түрлі температурада молекулалардың жылдамдықтар бойынша үлестірілу
- •20. Орташа арифметикалық жылдамдық, орташа квадраттық жылдамдығық және ең ықтимал жылдамдықтарды анықтайтын өрнектерді салыстырып байланыстарын талдаңыз
- •21. Максвеллдің формуласының өлшемсіз түрі. Салыстырмалы жылдамдық. F(u)
- •22. Ыдыстың қабырғасының бірлік ауданымен бірлік уақытта молекулалардың соқтығысу
- •23. Газдардың қасиеттерінің идеалдықтан ауытқуы. Идеал және нақты газдың
- •24. Эндрюстің эксперименттік изотермдері. Нақты газдар изотермдерін талдау.Критикалық немесе сындық изотерм, критикалық температура тк, критикалық қысым
- •26. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - қатты сфералар.
- •27. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - жұмсақ сфералар
- •28. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - Леннард-Джонс
- •31. Заттың критикалық күйі. Заттың p-V- күй диаграммасындағы критикалық күйін
- •38. Газдың көлемі өзгергендегі жұмыс. P f V тәуелділік бойынша жұмыстың
- •39.Идеал газдың жылусыйымдылығы. Меншікті жылусыйымдылық, мольдік
- •40. Изобарлық процестегі жылусыйымдылық.
- •41.Еркіндік дәрежелер саны. Газдардың жылусыйымдылығы арасындағы қатынастар
- •44. Термодинамиканың бірінші бастамасы мен идеал газ күйінің теңдеуін изотермдік
- •45. Термодинамиканың бірінші бастамасының дифференциалдық және толық
- •49. Жылудың механикалық жұмысқа айналуы. Циклдік процестер. Цикл жұмысы.
- •50. Карно циклі. Карно циклінің пайдалы әсер коэффициенті
- •Термодинамиканың дифференциалдық теңдеулерін қолданып, ішкі энергияның көлемге тәуелділігін анықтайық. Ішкі энергияның толық дифференциалы былай жазылады:
31. Заттың критикалық күйі. Заттың p-V- күй диаграммасындағы критикалық күйін
белгілейтін
нүктені анықтайтын шарттар
Ван-дер-Ваальс изотермдерінің
5.12-суреттегі біреуі ерекше назар
аудартады. Бұл изотерм толқын тәріздес
иіліс бөлігі бар изотермдер аймағын,
жоғары жағында орналасқан түрлері
үздіксіз бірсарынды гипербола сияқты
изотермдер аймағынан бөледі. Температура
өскенде қаныққан будың қысымы артып,
оның тығыздығы өседі, олай болса газдың
көлемі азаяды. Температура өскен сайын
b нүктесі
(5.12 сурет) жоғары көтеріліп, солға қарай
ығысады, сұйықтың көлемі ұлғайып, f
нүктесі
жоғары көтеріледі де, оң жаққа ығысады.
Температура артқан сайын b
және f нүктелері
бір-біріне қарсы жылжып, bf
кесіндісінің ұзындығы қысқарады. Тап
осы бір зат үшін белгілі температурада,
b
және f
нүктелері
ТК
нүктесінде қосылады. Осы изотермнің
ирең нүктесі
бар, сол
нүктеде

, . (5.27)
Осы (5.27)-ші өрнектер заттың күй диаграммасындағы критикалық күйін белгілейтін нүктені анықтайтын шарттар. Критикалық күйде заттың екі термодинамикалық тепе-теңдіктегі фазалары өздерінің қасиеттері бойынша теңбе-теңдікте болады.
b нүктесі газ тәріздес күйге, ал f – сұйыққа сай (5.12-сурет). Белгі-лі температурада олардың қосылуы, сұйық пен оның қаныққан буы-ның арасындағы ерекшеліктің жойылуын көрсетеді. Сұйық пен оның қаныққан буының арасындағы өзгешелігі жойылатын температура критикалық деп аталатынын жоғарыда айтып кеткенбіз.
Критикалық нүктеде екіфазалық тепе-теңдік сызығы (оны бинодаль дейді) және термодинамикалық орнықтылығының шекарасын белгілей-тін сызығы, оны спинодаль деп атайды, бір-бірімен түйіседі (5.15-сурет). Сондықтан, критикалық нүкте (5.27)-ші шарттарға саяды. Бинодальдің ішінде зат екі агрегаттық күйде болады: сұйық және өзінің қаныққан буымен тепе-теңдікті күйде.
Айта
кету керек, бар-лық қазақ тіліндегі
оқу-лықтарда критикалық
де-ген атау кризистік
делін-ген.
(Гректің kritike
–
талғау шеберлігі, пікір айту; сөздің
ауыспалы
мағынасы шұғыл
өзгеріс.
Гректің krisis–ше-шім,
нәтиже ауыспалы мағы-насы –
бір нәрсенің дамуы-ның жаңа кезеңі).
«Критика-лық» деген термин – халық-аралық
термин, сондықтан «кризистік» деген
атауды біз қолданбаймыз.
Критикалық
күйдегі зат-тың критикалық көлемі
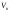 ,
критикалық қысымы
,
критикалық қысымы ,
критикалық темпера-турасы
,
критикалық темпера-турасы
 -ның
мәндері өзара молекулалық әрекеттесу
күштері және молеку-ланың құрылысы
арқылы анықталады. Осы айтылғандарға
байланыс-ты заттың критикалық параметрлері
физиканың іргелі (фундаментал-ді)
тұрақтыларының қатарына кіреді.
Критикалық параметрлерді қолданып
заттың көптеген қасиеттерін (мысалы,
балқу темпера-турасын, қайнау
температурасын, фазалық өтудың жылуын
және т.б.) есепттеуге болады. Заттың
критикалық параметрлері арқылы
Ван-дер-Ваальс теңдеуіндегі
-ның
мәндері өзара молекулалық әрекеттесу
күштері және молеку-ланың құрылысы
арқылы анықталады. Осы айтылғандарға
байланыс-ты заттың критикалық параметрлері
физиканың іргелі (фундаментал-ді)
тұрақтыларының қатарына кіреді.
Критикалық параметрлерді қолданып
заттың көптеген қасиеттерін (мысалы,
балқу темпера-турасын, қайнау
температурасын, фазалық өтудың жылуын
және т.б.) есепттеуге болады. Заттың
критикалық параметрлері арқылы
Ван-дер-Ваальс теңдеуіндегі және
және тұрақтылары анықталады.
тұрақтылары анықталады.
5.15-сурет
Критикалықтан жоғарғы температураларда нақты газ изотерм-дерінде ерекшеліктер болмайды және температура неғұрлым өссе, соғұрлым олар идеал газдың изотермдеріне жақындайды.
Критикалық күйде сұйық пен оның қаныққан буының арасындағы айырмашылықтың жойылуы себебінен сұйықтың булану жылуы нөлге тең болады. Сұйықтың беттік керілу коэффициенті де нөлге тең. Молекулалардың сандық тығыздығы орташа мәндерінен елеулі шама-ға өздігінен ауытқиды. Бұл өзгерістер сандық тығыздыққа тәуелді физикалық параметрлердің өзгеруін талап етеді. Мысалы, заттың сыну көрсеткішінің өзгеруі салдарынан критикалық күйдегі зат оптикалық күңгірт болып, түсі ағарыңқы, сүт тәрізденіп буылдыр тартады да, аса құнды опал (жылтыртас) деген минералдың түсі сияқты болады. Осы құбылысты критикалық опалесценция деп атайды.
Критикалық құбылысты 1861 жылы орыс ғалымы Д.И.Менделеев ашқан, ол критикалық температураны сұйықтың абсолютті қайнау температурасы деп атаған.
Заттың
 ,
, және
және критикалық параметрлерінің Ван-дер-Ваальс
теңдеуіндегі
критикалық параметрлерінің Ван-дер-Ваальс
теңдеуіндегі және
және тұрақтыларымен байланысын табайық.
(5.25)-ші теңдеуТ=ТК
және
тұрақтыларымен байланысын табайық.
(5.25)-ші теңдеуТ=ТК
және
 болса, мына
түрде жазылады:
болса, мына
түрде жазылады:

 (5.28)
(5.28)
(5.28)-ші
теңдеуде
 -нің
бірдей дәрежелерінің алдындағы екі
жағындағы коэффициенттері тең болуы
керек, осыдан үш теңдеу шығады:
-нің
бірдей дәрежелерінің алдындағы екі
жағындағы коэффициенттері тең болуы
керек, осыдан үш теңдеу шығады:
 ,
,
 ,
, .
(5.29)
.
(5.29)
Осы теңдеулер жүйесін шешіп, a және b тұрақтылармен байланысты критикалық параметрлерді анықтаймыз:
 ,
, ,
, .
(5.30)
.
(5.30)
Бұл нәтижелерді (5.26)-шы теңдеуді дифференциалдап және (5.27)-ші шарттарды қолданып табуға болады.
Критикалық нүктеде заттың сығылғыштығы шексіздікке тең. Шынында сығылғыштық коэффициенті былай анықталады:
 .
.
Критикалық
нүктеде
 ,
онда
,
онда ,
сондықтан сығыл-ғыштық коэффициенті
,
сондықтан сығыл-ғыштық коэффициенті тең болады
тең болады шексіздікке.
шексіздікке.
32. Заттың критикалық күйі.Критикалық температура. Бинодаль сызығы белгілейтін заттың күйі. Спинодаль сызығы белгілейтін заттың күйінің шекарасы. Ван-дер-Ваальс изотермдерін сызып түсіндіріңіз.Ван-дер-Ваальс изотермдерінің 5.12-суреттегі біреуі ерекше назар аудартады. Бұл изотерм толқын тәріздес иіліс бөлігі бар изотермдер аймағын, жоғары жағында орналасқан түрлері үздіксіз бірсарынды гипербола сияқты изотермдер аймағынан бөледі. Температура өскенде қаныққан будың қысымы артып, оның тығыздығы өседі, олай болса газдың көлемі азаяды. Температура өскен сайын b нүктесі (5.12 сурет) жоғары көтеріліп, солға қарай ығысады, сұйықтың көлемі ұлғайып, f нүктесі жоғары көтеріледі де, оң жаққа ығысады. Температура артқан сайын b және f нүктелері бір-біріне қарсы жылжып, bf кесіндісінің ұзындығы қысқарады. Тап осы бір зат үшін белгілі температурада, b және f нүктелері ТК нүктесінде қосылады. Осы изотермнің ирең нүктесі бар, сол нүктеде
 ,
,
 .
Осы (5.27)-ші өрнектер заттың күй
диаграммасындағы критикалық күйін
белгілейтін нүктені анықтайтын шарттар.
Критикалық
күйде
заттың екі термодинамикалық тепе-теңдіктегі
фазалары өздерінің қасиеттері бойынша
теңбе-теңдікте болады.
.
Осы (5.27)-ші өрнектер заттың күй
диаграммасындағы критикалық күйін
белгілейтін нүктені анықтайтын шарттар.
Критикалық
күйде
заттың екі термодинамикалық тепе-теңдіктегі
фазалары өздерінің қасиеттері бойынша
теңбе-теңдікте болады.
b нүктесі газ тәріздес күйге, ал f – сұйыққа сай (5.12-сурет). Белгі-лі температурада олардың қосылуы, сұйық пен оның қаныққан буы-ның арасындағы ерекшеліктің жойылуын көрсетеді. Сұйық пен оның қаныққан буының арасындағы өзгешелігі жойылатын температура критикалық деп аталатынын жоғарыда айтып кеткенбіз. Критикалық нүктеде екіфазалық тепе-теңдік сызығы (оны бинодаль дейді) және термодинамикалық орнықтылығының шекарасын белгілей-тін сызығы, оны спинодаль деп атайды, бір-бірімен түйіседі (5.15-сурет). Сондықтан, критикалық нүкте (5.27)-ші шарттарға саяды. Бинодальдің ішінде зат екі агрегаттық күйде болады: сұйық және өзінің қаныққан буымен тепе-теңдікті күйде.
Айта
кету керек, бар-лық қазақ тіліндегі
оқу-лықтарда критикалық
де-ген атау кризистік
делін-ген.
(Гректің kritike
–
талғау шеберлігі, пікір айту; сөздің
ауыспалы
мағынасы шұғыл
өзгеріс.
Гректің krisis–ше-шім,
нәтиже ауыспалы мағы-насы –
бір нәрсенің дамуы-ның жаңа кезеңі).
«Критика-лық» деген термин – халық-аралық
термин, сондықтан «кризистік» деген
атауды біз қолданбаймыз.Критикалық
күйдегі зат-тың критикалық көлемі
 ,
критикалық қысымы
,
критикалық қысымы ,
критикалық темпера-турасы
,
критикалық темпера-турасы
 -ның
мәндері өзара молекулалық әрекеттесу
күштері және молеку-ланың құрылысы
арқылы анықталады. Осы айтылғандарға
байланыс-ты заттың критикалық параметрлері
физиканың іргелі (фундаментал-ді)
тұрақтыларының қатарына кіреді.
Критикалық параметрлерді қолданып
заттың көптеген қасиеттерін (мысалы,
балқу темпера-турасын, қайнау
температурасын, фазалық өтудың жылуын
және т.б.) есепттеуге болады. Заттың
критикалық параметрлері арқылы
Ван-дер-Ваальс теңдеуіндегі
-ның
мәндері өзара молекулалық әрекеттесу
күштері және молеку-ланың құрылысы
арқылы анықталады. Осы айтылғандарға
байланыс-ты заттың критикалық параметрлері
физиканың іргелі (фундаментал-ді)
тұрақтыларының қатарына кіреді.
Критикалық параметрлерді қолданып
заттың көптеген қасиеттерін (мысалы,
балқу темпера-турасын, қайнау
температурасын, фазалық өтудың жылуын
және т.б.) есепттеуге болады. Заттың
критикалық параметрлері арқылы
Ван-дер-Ваальс теңдеуіндегі және
және тұрақтылары анықталады.
тұрақтылары анықталады.
Критикалықтан жоғарғы температураларда нақты газ изотерм-дерінде ерекшеліктер болмайды және температура неғұрлым өссе, соғұрлым олар идеал газдың изотермдеріне жақындайды.Критикалық күйде сұйық пен оның қаныққан буының арасындағы айырмашылықтың жойылуы себебінен сұйықтың булану жылуы нөлге тең болады. Сұйықтың беттік керілу коэффициенті де нөлге тең. Молекулалардың сандық тығыздығы орташа мәндерінен елеулі шама-ға өздігінен ауытқиды. Бұл өзгерістер сандық тығыздыққа тәуелді физикалық параметрлердің өзгеруін талап етеді. Мысалы, заттың сыну көрсеткішінің өзгеруі салдарынан критикалық күйдегі зат оптикалық күңгірт болып, түсі ағарыңқы, сүт тәрізденіп буылдыр тартады да, аса құнды опал (жылтыртас) деген минералдың түсі сияқты болады. Осы құбылысты критикалық опалесценция деп атайды.
Критикалық құбылысты 1861 жылы орыс ғалымы Д.И.Менделеев ашқан, ол критикалық температураны сұйықтың абсолютті қайнау температурасы деп атаған.
33.
Заттың критикалық парамерлерин а және
в Ван-дер-Ваальс тұрақтылары арқылы
анықтау.Заттың
 ,
, және
және критикалық параметрлерінің Ван-дер-Ваальс
теңдеуіндегі
критикалық параметрлерінің Ван-дер-Ваальс
теңдеуіндегі және
және тұрақтыларымен байланысын табайық.
(5.25)-ші теңдеуТ=ТК
және
тұрақтыларымен байланысын табайық.
(5.25)-ші теңдеуТ=ТК
және
 болса,
мына түрде жазылады:
болса,
мына түрде жазылады:
 (5.28)-ші
теңдеуде
(5.28)-ші
теңдеуде
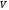 -нің
бірдей дәрежелерінің алдындағы екі
жағындағы коэффициенттері тең болуы
керек, осыдан үш теңдеу шығады:
-нің
бірдей дәрежелерінің алдындағы екі
жағындағы коэффициенттері тең болуы
керек, осыдан үш теңдеу шығады:
 ,
, ,
, .Осы
теңдеулер жүйесін шешіп,
a
және
b
тұрақтылармен байланысты критикалық
параметрлерді анықтаймыз:
.Осы
теңдеулер жүйесін шешіп,
a
және
b
тұрақтылармен байланысты критикалық
параметрлерді анықтаймыз: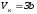 ,
, ,
, Бұл
нәтижелерді (5.26)-шы теңдеуді дифференциалдап
және (5.27)-ші шарттарды қолданып табуға
болады.Критикалық нүктеде заттың
сығылғыштығы шексіздікке тең. Шынында
сығылғыштық коэффициенті былай
анықталады:
Бұл
нәтижелерді (5.26)-шы теңдеуді дифференциалдап
және (5.27)-ші шарттарды қолданып табуға
болады.Критикалық нүктеде заттың
сығылғыштығы шексіздікке тең. Шынында
сығылғыштық коэффициенті былай
анықталады: .Критикалық
нүктеде
.Критикалық
нүктеде ,
онда
,
онда ,
сондықтан сығыл-ғыштық коэффициенті
,
сондықтан сығыл-ғыштық коэффициенті тең болады
тең болады шексіздікке.
шексіздікке.
34.
Сәйкестік күйлер заңы. Ван-дер-Ваальстің
келтірілген теңдеуі.
Жеке заттың өзіне тән қасиеттері
Ван-дер-Ваальстің теңдеуіне a
және
b
тұрақтылары мен
 ,
, ,
, критикалық параметрлері арқылы кіреді.
Сондықтан, мысалы, әр түрлі газдардың
изотермдерін бірдей тұрақты температурада
келтірсек, олардың түрлері әр түрлі
болады. Идеал газдың изотермдерінің
барлық газдар үшін айырмашылығы жоқ,
себебі газдың қасиеттеріне тәуелсіз.
критикалық параметрлері арқылы кіреді.
Сондықтан, мысалы, әр түрлі газдардың
изотермдерін бірдей тұрақты температурада
келтірсек, олардың түрлері әр түрлі
болады. Идеал газдың изотермдерінің
барлық газдар үшін айырмашылығы жоқ,
себебі газдың қасиеттеріне тәуелсіз.
Жан-жақты
(универсалды) заттың табиғатына тәуелсіз
нақты газдың күй теңдеуін Ван-дер
Ваальстің теңдеуі бойынша табуға болады.
Ол үшін p,
V, T
күй параметрлерінің сәйкес критикалық
 ,
, ,
, шамаларға қатысын қолданады, демек:
шамаларға қатысын қолданады, демек: ,
, ,
, ,(5.31)мұндағы
,(5.31)мұндағы
 –
келтірілген параметрлер деп аталады.
Бұл өлшемсіз шамалар сәйкес критикалық
параметрлерінің үлесі ретінде анықталған
нақты газ параметрлерінің
мәндері.Ван-дер-Ваальстің теңдеуіндегі
–
келтірілген параметрлер деп аталады.
Бұл өлшемсіз шамалар сәйкес критикалық
параметрлерінің үлесі ретінде анықталған
нақты газ параметрлерінің
мәндері.Ван-дер-Ваальстің теңдеуіндегі
 p,
V, T-ның
орнына
p,
V, T-ның
орнына
 -ны
қойып
және a
мен
b тұрақ-тыларын
(5.30)-шы формула бойынша
-ны
қойып
және a
мен
b тұрақ-тыларын
(5.30)-шы формула бойынша
 ,
, ,
, көмегімен
түрлендіріп, келесі теңдеуді аламыз:
көмегімен
түрлендіріп, келесі теңдеуді аламыз:
 немесе
немесе
 .
(5.32)Бұл
формула кез келген заттың келтірілген
параметрлерін байла-ныстырады, жеке
заттың қасиеттерін сипаттайтын тұрақтылар
кірмей-ді, сондықтан (5.32)-ші теңдеу
универсалды, барлық заттарға
бірдей.(5.32)-ші теңдеу Ван-дер-Ваальстің
келтірілген
күй теңдеуі
деп аталады.
.
(5.32)Бұл
формула кез келген заттың келтірілген
параметрлерін байла-ныстырады, жеке
заттың қасиеттерін сипаттайтын тұрақтылар
кірмей-ді, сондықтан (5.32)-ші теңдеу
универсалды, барлық заттарға
бірдей.(5.32)-ші теңдеу Ван-дер-Ваальстің
келтірілген
күй теңдеуі
деп аталады.
 шамалардың әр түрлі заттарға бірдей
мәндерінің жиынтығысәйкестік
күйлерін
анықтайды. Егер үш келтірілген
параметрлердің екеуі
әр
түрлі
заттарда
бірдей болса, онда үшінші параметріде
осы заттарда бірдей. Осы заң сәйкестік
күйлер заңы деп
аталады.
шамалардың әр түрлі заттарға бірдей
мәндерінің жиынтығысәйкестік
күйлерін
анықтайды. Егер үш келтірілген
параметрлердің екеуі
әр
түрлі
заттарда
бірдей болса, онда үшінші параметріде
осы заттарда бірдей. Осы заң сәйкестік
күйлер заңы деп
аталады.
Ван-дер-Ваальс теңдеуіне күйлері бағынатын заттар, сәйкестік күйлер заңын қанағаттандырады (қамтамасыз етеді), сондықтан термодинамикалық ұқсас болады. Термодинамикалық ұқсас заттар үшін мына қатыс орындалады:
 (5.33)Осыдан
барлық заттар үшін бұл қатынастың мәні
бірдей болуға тиіс, ал дұрысында нақты,
тығыз әр түрлі газдар үшін қатынастың
осы мәнінен ауытқулар байқалады.
(5.33)Осыдан
барлық заттар үшін бұл қатынастың мәні
бірдей болуға тиіс, ал дұрысында нақты,
тығыз әр түрлі газдар үшін қатынастың
осы мәнінен ауытқулар байқалады.
Сөйтіп, сәйкестік күйлер заңының орындалуының шарты термо-динамикалық ұқсас заттар үшін
 ,(5.34)демек
осы комплекс бірдей болуы қажет.
,(5.34)демек
осы комплекс бірдей болуы қажет.
35. Термодинамиканың нөлдік бастамасы (заңы).Температура деген ұғым кез келген термодинамикалық жүйе-нің өзіне тән қасиеті (2.5 бөлім), ол термодинамикада нолдік заңы (бастамасы) бойынша анықта-лады. Егер екі А және В денелері бір-біріне тәуелсіз бөлек үшінші С денемен жылулық тепе-теңдік күйде болса, онда олардың үшеуі де бір-бірімен өзара жылулық тепе-теңдікте болады. Онда жүйе-нің жылулық тепе-теңдігі темпе-ратура деген күй функциясының барлық нүктелеріндегі теңдігімен сипатталады (6.2-сурет). Мұнда А, В және С денелердің температурасы бірдей болады деп есептеледі.
Осыдан тепе-теңдіктегі жүйенің күйі оның ішкі жағдайын сипаттайтын температура деген Т параметр бойынша анықталады. Т параметрдің мәні әр түрлі тепе-теңдік жүйелердің жылулық түйісуінде (контакт) энергиямен алмасу нәтижесінде теңеледі және олардың барлығында бірдей болады. Тепе-теңдік жүйенің күйін сипаттайтын, ерекше күй функциясы – температураны кіргізетін жоғарыдағы ереже, термодинамиканың нолдік заңы (бастамасы) деп аталады.бірінші бастамасы үйреншікті және соның өзінде ғажайып абстракты энергия ұғымын енгізеді. Жалпы айтқанда, бұл ұғым кез келген дененің жұмыс істеу қабілетін бейнелеп түсін-діреді, демек күш салуымен байланысты. Термодинамиканың негізін-де көптеген тәжірибелік деректердің жинағын жалпылау арқылы жылудың механикалық жұмысқа айналу мүмкіндігі көрсетіледі. XIX ғасырдың ортасында жылу мен жұмыстың эквиваленттілігі тағайын-далды. Сонымен, энергияның білінуінің түрлері анықталды. Осы тәжірибелік нәтижелерін Майер (1842 ж.) және Гельмгольц (1847 ж.) жалпылап, былай тұжырымдады: барлық макроскоптық жүйелер тұрақты энергия мөлшеріне ие болады және энергияның бір түрден екінші түрге өтуі мүмкін. Жүйенің энергиясының мөлшері тек оның сыртқы ортаға берілу немесе одан алыну нәтижесінде өзгереді. Осы тұжырым термодинамикада оның бірінші заңының негізгі мағынасын белгілейді.
«Энергия
деген не?” –
сұраққа жауап беру оңай емес. Біз
энергия-ның тек өзара ауысуы кезіндегі
білінуін сеземіз. Сондықтан, біз тек
энергияның айырымын өлшей аламыз және
осы энергияның айыры-мының физикалық
мағынасы бар. Макроскоптық көзқарас
бойынша әр дене белгілі энергия мөлшерімен
байланысты болады. Бұл энергия үш түрге
бөлінеді: потенциалдық
энергия, кмнетикалық энергия және
ішкі энергия. Олай
болса,
жүйенің
толық энергиясы былай анықта-лады
 Алдыңғы
екі энергия түрлерімен механика бөлімінде
таныстық. Әдетте, термодинамикалық
жүйелерді зерттегенде потенциалдық
энергияның өзгерісі толық энергияға
әсер етпейтін және кинетикалық энергия
өзгерісі нолге жуық жағдайлар
қарастырылады. Бұл жағдай-ларда жүйенің
Алдыңғы
екі энергия түрлерімен механика бөлімінде
таныстық. Әдетте, термодинамикалық
жүйелерді зерттегенде потенциалдық
энергияның өзгерісі толық энергияға
әсер етпейтін және кинетикалық энергия
өзгерісі нолге жуық жағдайлар
қарастырылады. Бұл жағдай-ларда жүйенің толық
энергиясының өзгерісі
толық
энергиясының өзгерісі ішкі энергия-сының өзгерісіне тең
болады, демек
ішкі энергия-сының өзгерісіне тең
болады, демек
Бұл бөлімде идеал газдың күйінің өзгеру процесінің энергиялық жағын қарастырамыз. Ең алдымен газдың температурасы өзгергендегі, оның күйінің өзгеру процесіне көңіл аударайық.
36. Идеал газдың ішкі энергиясы. Ішкі энергияның жүйенің күйіне тәуелділігі, демек күй функциясы болуы. Идеал газдың молекуласының орташа энергиясы (2.5 бап) былай анықталады:
 ,
(2.47) мұндағы
,
(2.47) мұндағы
 –
Больцман тұрақтысы,
–
Больцман тұрақтысы,
 –
газдың температурасы,
–
газдың температурасы,
 –молекула
массасы,
–молекула
массасы,
 –
молекуланың орташа квадраттық
жылдамдығы.Бұл
теңдеу молекулалары материялық нүктелер
және олар тек ілгерілемелі қозғалыста
деп есептелетін идеал біратомды газ
үшін жазылған. Егер газдың молекулалары
бірден көп атомдардан құралған болса,
мұндай көпатомды молекула айналмалы
және тербелмелі қозға-лыста болуы
мүмкін, онда бұл қозғалыстармен байланысты
энергияны ескеру қажет.Біз
алдымен біратомды газды қарастырамыз
және оның белгілі массасындағы заттың
барлық молекулаларының энергиясын
анықтай-тын өрнекті табамыз. Егер газ
–
молекуланың орташа квадраттық
жылдамдығы.Бұл
теңдеу молекулалары материялық нүктелер
және олар тек ілгерілемелі қозғалыста
деп есептелетін идеал біратомды газ
үшін жазылған. Егер газдың молекулалары
бірден көп атомдардан құралған болса,
мұндай көпатомды молекула айналмалы
және тербелмелі қозға-лыста болуы
мүмкін, онда бұл қозғалыстармен байланысты
энергияны ескеру қажет.Біз
алдымен біратомды газды қарастырамыз
және оның белгілі массасындағы заттың
барлық молекулаларының энергиясын
анықтай-тын өрнекті табамыз. Егер газ
 молекуладан құралса, онда олардың жалпы
молекуладан құралса, онда олардың жалпы энергиясы мынаған тең болады:
энергиясы мынаған тең болады: .
(6.2)
.
(6.2)
Бір
моль газ үшін (6.2)-ші өрнектің түрі былай
жазылады:
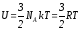 ,
(6.3)
,
(6.3)
мұндағы
 –
универсал газ тұрақтысы,
–
универсал газ тұрақтысы,
 –
Авогадро саны.
–
Авогадро саны.
Осы (6.3) өрнекпен анықталатын энергияны идеал газдың (бір молі үшін) ішкі энергиясы деп атайды.
Жалпы жағдайда дененің ішкі энергиясы деп, оның құрамындағы молекулаларына қатысты “көзге көрінбейтін” энергиясын айтады. Сондықтан дененің немесе денелер жүйесінің ішкі энергиясы заттың құрамындағы барлық қозғалыстағы молекулаларының кинетикалық энергиясы, молекуланың атомдарының қозғалысының кинетикалық энергиясы (молекула көпатомды болса) мен ондағы молекулалардың өзара әрекеттесуінің потенциалдық энергиясы және атомның құрамы-на кіретін микробөлшектердің кинетикалық және потенциалдық энергиясы да ескерілуі мүмкін. Бірақ, бұған газдың тұтас дене ретіндегі қозғалысының кинетикалық энергиясы және сыртқы күштер өрісінде орналасқандағы потенциалдық энергиясы қосылмайды.
Идеал газдың белгілі массасының ішкі энергиясы (6.2) және (6.3) өрнектер бойынша тек температураға тәуелді, газдың қысымы мен көлеміне тәуелді емес. Нақты газдар үшін бұл айтылғандар орындал-майды.
Идеал газдың температурасын өзгерту үшін, оның ішкі энергиясын өзгерту керек екендігі, осы (6.2) және (6.3)-ші формуладан көрінеді. Ал механикадан белгілі, энергияның өзгеруі жұмыс істеумен байла-нысты: дененің энергиясы өзгереді, егер дене жұмыс істесе немесе дененің үстінен жұмыс істелсе, онда осы энергия өзгерісі істелген жұмысқа тең болады. Олай болса, газдың немесе кез келген дененің температурасының өзгеруі тек механикалық жұмыс істелгенде байқа-лады деп ойлауға болады. Мәселен, денені қыздыру үшін оның үсті-нен жұмыс істелуі қажет, ал суыту үшін дене өзі жұмыс істеуі керек. Дененің температурасын өзгертуге болады, егер қажетті механикалық жұмысты жұмсаса. Мысалы, бір-бірімен үйкелетін денелер қызатыны көне заманнан белгілі.
37.
Жылу мөлшері. Жылу мөлшерінің процеске
қатысты анықталуы, демек процестіңфункциясы
болуы.
жылу
алмасу кезінде берілген (немесе алынған)
энергия мөлшерін жылу
мөлшері деп
аталады. . Ол
 (ку) – латын әрпімен белгіленеді
(ку) – латын әрпімен белгіленеді Кез
келген денені жұмыс атқармай-ақ қыздыруға
немесе суытуға болатыны тәжірибеден
белгілі. Мұндай қыздыру немесе суыту
тәсілі температурасы әр түрлі денелер
бір-бірімен түйіскенде (контакт бол-ғанда)
немесе сәулелену кезінде жүзеге
асырылады. Температуралары әр түрлі
денелер кандай-да бір ортамен бөлінген
болса, олардың да арасында осындай жылу
алмасу процесі байқалуы мүмкін.
Кез
келген денені жұмыс атқармай-ақ қыздыруға
немесе суытуға болатыны тәжірибеден
белгілі. Мұндай қыздыру немесе суыту
тәсілі температурасы әр түрлі денелер
бір-бірімен түйіскенде (контакт бол-ғанда)
немесе сәулелену кезінде жүзеге
асырылады. Температуралары әр түрлі
денелер кандай-да бір ортамен бөлінген
болса, олардың да арасында осындай жылу
алмасу процесі байқалуы мүмкін.
(6.2)-ші формула бойынша газдың температурасының өзгеруі, оның энергиясының өзгеруімен байланысты. Олай болса, денелер түйіскенде энергия қандай да бір себеппен беріледі (қыздыру) немесе денеден энергия алынады (суыту).
Энергияның
бұл алмасу тәсілі түйіскен денелердің
микробөлшек-тері өзара соқтығысу кезінде
энергияларын алмастырып алуымен
байланысты. Қыздырылған дененің
бөлшектері суығырақ дененің бөл-шектеріне
энергиясын беру нәтижесінде, жоғалтады,
демек бір дене-нің хаосты қозғалыстағы
бөлшектері екінші дененің микробөлшек-теріне
энергиясын ауыстырады. Бұл жағдайда
энергияның өзгеруі жұмыс істелуімен
байланысты болмайды. Осы жылу алмасу
кезінде берілген (немесе алынған) энергия
мөлшерін жылу
мөлшері деп
атап кеткен. Ол
 (ку) – латын әрпімен белгіленеді. Дененің
температура-сы өзгерсе (қызса немесе
суыса) басқа денемен түйіскенде немесе
сәулелену арқылы, онда денеге қандай-да
жылу мөлшеріберілді
немесе
алынды
деп айтады.
(ку) – латын әрпімен белгіленеді. Дененің
температура-сы өзгерсе (қызса немесе
суыса) басқа денемен түйіскенде немесе
сәулелену арқылы, онда денеге қандай-да
жылу мөлшеріберілді
немесе
алынды
деп айтады.
Шынында, жылу алмасу кезінде жұмыс істеледі, бірақ бұл жұмыс-ты ретті қозғалыстағы макроскоптық денелер істемейді, олардың құрамындағы хаосты қозғалыстағы микробөлшектер істейді.
Осы
айтылғаннан, жүйенің энергиясы тек қана
жылу алмасу кезінде өзгерсе, онда
 ,
яғни
,
яғни жылу мөлшері жүйенің жылу алмасу
кезіндегіэнергияның
өзгерісінің өлшеуіші
болады.
жылу мөлшері жүйенің жылу алмасу
кезіндегіэнергияның
өзгерісінің өлшеуіші
болады.
Жылудың механикалық эквиваленті. Жылу мен жұмыс энер-гияның берілу (алыну), демек энергияның өзгеру түрлері екені анық-талды. Сондықтан олардың өлшем бірліктері де бірдей, СИ жүйесінде джоуль (Дж). 18 ғасырдың 50-ші жылдарында көптеген тәжірибелер нәтижесінде жылу мен энергия эквивалентті екендігін Д.Джоуль дәлелдеген. Ол бір килокалория жылу мөлшерінің қыздыру қабілеті – тура сондай белгілі мөлшерде жұмыстың істелуін талап ететінін дәлелдеді. Содан бұл жұмыс мынаған тең болып шықты:
1 ккал=4186,8 Дж.
Бір килограмм суды атмосфералық қысымда бір кельвинге қыздыру (немесе суыту) үшін берілетін (немесе алынатын) жылу мөлшерін бір килокалория (ккал) деп атайды.
Механикалық
жұмыстың өлшемінің бірлігінің жылу
бірлігіне қатысын анықтайтын санды
жылудың
механикалық эквиваленті
деп атайды, ол мыныған тең:
 Дж/ккал
= 4,1868 Дж/кал.Осыған
кері шаманы механикалық
жұмыстың жылулық эквиваленті
дейді:
Дж/ккал
= 4,1868 Дж/кал.Осыған
кері шаманы механикалық
жұмыстың жылулық эквиваленті
дейді: ккал/Дж=0,239
кал/Дж.Сонымен, жылу мөлшерінің, жұмыстың
және энергияның өлшем бірлігі бірдей.
ккал/Дж=0,239
кал/Дж.Сонымен, жылу мөлшерінің, жұмыстың
және энергияның өлшем бірлігі бірдей.
