- •1. Молекулалық жүйенің статистикалық және термодинамикалық зерттеу әдістері,
- •4.Идеал газ молекулаларының орташа кинетикалық энергиясы.
- •6. Қысымның газдың тығыздығымен байланысын дәлелдеңіз және қысым мен тығыздықарқылы газдыњ молекулаларының орташа квадраттық жылдамдығын анықтаңыз.
- •7. Температура түсініктемесі. Температуралық шкала, реперлік нүктелер, температураны
- •8. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық
- •9. Менделеев-Клапейрон теңдеуін молекула-кинетикалық теорияның негізгі теңдеуінен
- •11. Молекулалық жүйедегі кездейсоқ оқиғалар мен кездейсоқ шамалар. Броундық
- •13. Изотермдік жағдайда ауаның қысымының Жердің бетінен биіктікке тәуелділігі. Барометрлік формула (қорытыңыз). Барометрлік формула
- •14.Үлестірілу функциясы туралы түсінік
- •15. Молекуланың жылдамдығына тәуелді функцияның (скалярлық, векторлық немесе
- •16. Максвеллдің үлестірілу функциясының жылдамдықтың х –компоненті үшін түрі,
- •17.Молекулалардың жылдамдықтар модулі бойынша үлестірілуі. Максвел заңы f(||)-ның V-қа тәуелділігін сипаттайтын графикті сызып, талдаңыз.
- •18. Әр түрлі температурада молекулалардың жылдамдықтар бойынша үлестірілу
- •20. Орташа арифметикалық жылдамдық, орташа квадраттық жылдамдығық және ең ықтимал жылдамдықтарды анықтайтын өрнектерді салыстырып байланыстарын талдаңыз
- •21. Максвеллдің формуласының өлшемсіз түрі. Салыстырмалы жылдамдық. F(u)
- •22. Ыдыстың қабырғасының бірлік ауданымен бірлік уақытта молекулалардың соқтығысу
- •23. Газдардың қасиеттерінің идеалдықтан ауытқуы. Идеал және нақты газдың
- •24. Эндрюстің эксперименттік изотермдері. Нақты газдар изотермдерін талдау.Критикалық немесе сындық изотерм, критикалық температура тк, критикалық қысым
- •26. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - қатты сфералар.
- •27. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - жұмсақ сфералар
- •28. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - Леннард-Джонс
- •31. Заттың критикалық күйі. Заттың p-V- күй диаграммасындағы критикалық күйін
- •38. Газдың көлемі өзгергендегі жұмыс. P f V тәуелділік бойынша жұмыстың
- •39.Идеал газдың жылусыйымдылығы. Меншікті жылусыйымдылық, мольдік
- •40. Изобарлық процестегі жылусыйымдылық.
- •41.Еркіндік дәрежелер саны. Газдардың жылусыйымдылығы арасындағы қатынастар
- •44. Термодинамиканың бірінші бастамасы мен идеал газ күйінің теңдеуін изотермдік
- •45. Термодинамиканың бірінші бастамасының дифференциалдық және толық
- •49. Жылудың механикалық жұмысқа айналуы. Циклдік процестер. Цикл жұмысы.
- •50. Карно циклі. Карно циклінің пайдалы әсер коэффициенті
- •Термодинамиканың дифференциалдық теңдеулерін қолданып, ішкі энергияның көлемге тәуелділігін анықтайық. Ішкі энергияның толық дифференциалы былай жазылады:
26. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - қатты сфералар.
Потенциалдың
графикалық бейнеленген түрі және
математикалық кескіні.
Заттың қасиеттерін экспериментте
зерттегенде әр түрлі шамаларды есептеу
үшін молекулааралық өзара әрекеттесу
потенциалын қолдану қажет болады. Газ
бен сұйықтардың қасиеттерін зерттеу
үшін молеку-лалық
физикада бірнеше эмпирикалық потенциалдар
қолданады. Бұл потенциал моделі (үлгісі)
бойынша молекулалар диаметрлері
 қатты өткізбейтін сфералар деп
қарастырылады. Өте қарапайым, тебу
күштері туралы мәліметтер береді, себебі
молекуланың өздік көлемі бар. Потенциалдың
графикалық түрі 5.6-суретте
бейнеленген, ал математикалық кескіні:
қатты өткізбейтін сфералар деп
қарастырылады. Өте қарапайым, тебу
күштері туралы мәліметтер береді, себебі
молекуланың өздік көлемі бар. Потенциалдың
графикалық түрі 5.6-суретте
бейнеленген, ал математикалық кескіні: ,
егер
,
егер
 ,
,
 ,
егер
,
егер
 .
(5.10)
.
(5.10)
5.6-сурет

27. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - жұмсақ сфералар
(тебудің нүктелік центрі). Потенциалдың графикалық бейнеленген түрі және
математикалық
кескіні.
Заттың қасиеттерін экспериментте
зерттегенде әр түрлі шамаларды есептеу
үшін молекулааралық өзара әрекеттесу
потенциалын қолдану қажет болады. Газ
бен сұйықтардың қасиеттерін зерттеу
үшін молеку-лалық
физикада бірнеше
эмпирикалықпотенциалдарқолданады.Қатты
сфералар моделінің модификациясы
болады.Жоғарғытемпературадағыгаздарды
жақсы сипаттайды. Потенциалдың
графикалықтүрібейнеленген, ал
математикалық кескіні
 ,
мұндағы
,
мұндағы
 –
тебу
көрсеткіші, мәні 9 және
15
аралығында жатады; егер
–
тебу
көрсеткіші, мәні 9 және
15
аралығында жатады; егер
 ,
онда мұндай
молекулалар максвеллдік
д.а
,
онда мұндай
молекулалар максвеллдік
д.а
28. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - Леннард-Джонс
потенциалы.
Потенциалдың графикалық бейнеленген
түрі және математикалық кескіні
Бұл потенциал тартылыс күштері
молекулааралық қашық-тықтың
әр түрлі дәрежесіне кері пропорционал
өзгеретін диаметрлері
 қатты сфералық молекулаларды сипаттайды
(5.9-сурет).
Қолдануда қарапайым, нақты модель.
Математикалық кескіні:
қатты сфералық молекулаларды сипаттайды
(5.9-сурет).
Қолдануда қарапайым, нақты модель.
Математикалық кескіні: ,
егер
,
егер
 ,
, ,
егер
,
егер .
(5.13)
.
(5.13)


5.9-сурет
5.10-сурет
Әр
түрлі кинетикалық теорияның мәселелерін
шешу үшін кең қолданатын потенциал,
тартылыс және тебу күштерін ескереді
(5.10 сурет). Математикалық кескіні:
 ,
(5.14)
,
(5.14)
мұндағы
 –
тебу күштеріне, ал
–
тебу күштеріне, ал
 –
тартылыс
күштеріне қатысты қосындылар;
–
тартылыс
күштеріне қатысты қосындылар;
 –
қашықтықта
потенциалдық функция таң-басын
өзгертеді;
–
қашықтықта
потенциалдық функция таң-басын
өзгертеді;
 –
потенциалдың
–
потенциалдың
 қашықтағы ең кіші (минимал) мәні.
қашықтағы ең кіші (минимал) мәні.
29. Ван-дер-Ваальс теңдеуі. Молекулалар арасындағы тебу және тартылыс күштерін
ескеру.
Нақты газ күйінің теңдеуін, яғни күй
параметрлері көлем, қысым және
температураны функционалды тәуелділікпен
байланыстыратын теңдеуді қорытып
шығаратын бірнеше тәсіл бар. Нақты газ
күйінің теңдеуін көбінесе идеал газ
күйінің теңдеуіне түзетулер ендіру
арқылы шығарады. Менделеев-Клапейрон
теңдеуі
 (5.16)
(5.16)
молекулалардың көлемі мен молекулалар арасындағы әсер күштерін ескермейді. Шынында бұл теңдеу бойынша өте жоғары қысымда газдың көлемі тым кіші болуы мүмкін, яғни газдың шексіз сығылуына кедергі болатын себептерді жоқ деп есептеуге болады. Бірақ нақты газда олай емес, себебі газ молекулаларының кішкене болса да белгілі көлемі бар.
Молекулалар
арасындағы тебу күштерін ескеру.
(5.16) форму-ладағы
 газ орналасқан ыдыстың көлемі. Осы
көлемде идеал газ молекулалары бір-біріне
бөгет жасамай қозғалады (материялық
нүкте ретінде қарастырылатын идеал газ
молекулалары бір-бірімен соқты-ғыспайды),
демек
газ орналасқан ыдыстың көлемі. Осы
көлемде идеал газ молекулалары бір-біріне
бөгет жасамай қозғалады (материялық
нүкте ретінде қарастырылатын идеал газ
молекулалары бір-бірімен соқты-ғыспайды),
демек көлемді молекула еркін шарлайды. Егерде
осы ыдыста нақты газ болса, онда
молекулалардың өздерінің өлшеміболуы
салдарынан, олар ыдыстың ішінде еркін
қозғала алмайды. Себебі, нақты газ
молекулалары маңына бара алмайтын
әлдеқандай көлем болуы қажет. Осы көлем
(5.1 бап, (5.4) формула))
көлемді молекула еркін шарлайды. Егерде
осы ыдыста нақты газ болса, онда
молекулалардың өздерінің өлшеміболуы
салдарынан, олар ыдыстың ішінде еркін
қозғала алмайды. Себебі, нақты газ
молекулалары маңына бара алмайтын
әлдеқандай көлем болуы қажет. Осы көлем
(5.1 бап, (5.4) формула))
 деп белгіленген. Нақты газ молекулалары
еркін қозғалатын көлем ыдыстың барлық
деп белгіленген. Нақты газ молекулалары
еркін қозғалатын көлем ыдыстың барлық көлемінен
көлемінен шамаға кіші болады. Сондықтан (5.16) идеал
газ күйінің теңдеуіндегі
шамаға кіші болады. Сондықтан (5.16) идеал
газ күйінің теңдеуіндегі көлемнің орнына
көлемнің орнына шаманы алу керек, яғни
шаманы алу керек, яғни . (5.17)теңдеуде
. (5.17)теңдеуде
 -ны
есептегенде өзара әрекеттесетін
N
молекула-лардың арасында тек қос
соқтығысу болады деп болжайды. Бұл
-ны
есептегенде өзара әрекеттесетін
N
молекула-лардың арасында тек қос
соқтығысу болады деп болжайды. Бұл
 түзеткіш қысым шексіз өскенде газ
орналасқан шекті көлемге тең болады.
Шынында (5.17)-ші теңдеуді мына түрде
жазсақ:
түзеткіш қысым шексіз өскенде газ
орналасқан шекті көлемге тең болады.
Шынында (5.17)-ші теңдеуді мына түрде
жазсақ: ,
(5.18) онда
,
(5.18) онда ,
егер
,
егер болса.Молекулалардың өзіндік көлемінің
ықпалын ескерген ((5.17)-ші теңдеу), олардың
әсерлесуіндегі тебу күштерін ескеру
болады. Моле-кулалар арасында тебу
күштері байқалатын қашықтық (5.3 және
5.4-ші баптар)
болса.Молекулалардың өзіндік көлемінің
ықпалын ескерген ((5.17)-ші теңдеу), олардың
әсерлесуіндегі тебу күштерін ескеру
болады. Моле-кулалар арасында тебу
күштері байқалатын қашықтық (5.3 және
5.4-ші баптар) болғанымен, жақындасу қашықтығы нолге
тең бола алмайды. Сондықтан молекулалар
өлшемін ескеру, тебу күштерінің сипаты
ретінде қарастырылады. Молекулаларды
қатты серпімді шар-лар деп болжайды.
Шарлар соқтыққанда деформациялануы
мүмкін, онда сыртқы пішіні (немесе
көлемі) күштің әсерінен өзгереді.
Соқты-ғысқан шарлардың кинетикалық
энергиясы серпімді деформация күш-теріне
қарсы істелетін жұмысқа жұмсалады және
деформацияланған дененің потенциалдық
энергиясына айналады. Сонан соң босаған
потенциалдық энергия соқтығысқаннан
кейін жан-жаққа ұшқан моле-кулалардың
кинетикалық энергиясына айналады.
болғанымен, жақындасу қашықтығы нолге
тең бола алмайды. Сондықтан молекулалар
өлшемін ескеру, тебу күштерінің сипаты
ретінде қарастырылады. Молекулаларды
қатты серпімді шар-лар деп болжайды.
Шарлар соқтыққанда деформациялануы
мүмкін, онда сыртқы пішіні (немесе
көлемі) күштің әсерінен өзгереді.
Соқты-ғысқан шарлардың кинетикалық
энергиясы серпімді деформация күш-теріне
қарсы істелетін жұмысқа жұмсалады және
деформацияланған дененің потенциалдық
энергиясына айналады. Сонан соң босаған
потенциалдық энергия соқтығысқаннан
кейін жан-жаққа ұшқан моле-кулалардың
кинетикалық энергиясына айналады.
 түзетудің
анықтау жолын 5.1-де талқыладық. Диаметрі
түзетудің
анықтау жолын 5.1-де талқыладық. Диаметрі
 шар тәріздес екі молекула бір-бірінің
беттерімен жанасты делік. Мысалы, В
молекуланың центрі
шар тәріздес екі молекула бір-бірінің
беттерімен жанасты делік. Мысалы, В
молекуланың центрі молекуланың ортасын айналдыра сызған
радиусы
молекуланың ортасын айналдыра сызған
радиусы өріске кіре алмайды (5.11-сурет). Сондай-ақ
өріске кіре алмайды (5.11-сурет). Сондай-ақ молекула-ның центрі В молекуланың
центрін айналдыра сызған радиусы
молекула-ның центрі В молекуланың
центрін айналдыра сызған радиусы өріске кірмейді (5.11-сурет).
өріске кірмейді (5.11-сурет).
Сондықтан
бір молекуланың көлемінен 8 есе артық
көлемді екі молекула, ал 5 есе артық
көлемді бір молекула кесіп өте алмайды.
Бір моль газ үшін
 ,(5.19) мұндағы
,(5.19) мұндағы –
молекуланың өзіндік көлемі. Осыдан
–
молекуланың өзіндік көлемі. Осыдан
 түзеткіш молекулалардың төрт еселенген
өзіндік көлеміне тең екендігі көрінеді.
түзеткіш молекулалардың төрт еселенген
өзіндік көлеміне тең екендігі көрінеді. тұрақтының өлшем бірлігі м3/моль.
тұрақтының өлшем бірлігі м3/моль.
Молекулалар
арасындағы тартылыс күштерін ескеру.
Моле-кулалар арасындағы тартылыс
күштері газдың ыдыстың қабырғала-рына
түсірген қысымына ықпалын тигізеді.
Ыдыс қабырғасына жақын орналасқан және
соған қарай бара жатқан кез келген
 молекуласына көршілес молекулалар
жағынан қорытқы күш әсер етеді. Бұл күш
газдың ішіне қарай бағытталады. Осының
нәтижесінде
молекуласына көршілес молекулалар
жағынан қорытқы күш әсер етеді. Бұл күш
газдың ішіне қарай бағытталады. Осының
нәтижесінде молекуласы ыдыстың қабырғасына әлсіреген
күшпен соқтығысады. Сол себептен бірдей
жағдайларда нақты газдың қысымы идеал
газдың
p
қысымынан
молекуласы ыдыстың қабырғасына әлсіреген
күшпен соқтығысады. Сол себептен бірдей
жағдайларда нақты газдың қысымы идеал
газдың
p
қысымынан
 шамаға кіші болады.
шамаға кіші болады. қысым газдың ішіне қарай бағытталған,
сондықтан оны газдың ішкі қысымы деп
те атауға болады Олай болса (5.16)-дағы
идеал газдың қысымы орнына
қысым газдың ішіне қарай бағытталған,
сондықтан оны газдың ішкі қысымы деп
те атауға болады Олай болса (5.16)-дағы
идеал газдың қысымы орнына қосындысын қоюы-мыз керек:
қосындысын қоюы-мыз керек: немесе
немесе .(5.20)
.(5.20)
Тартылыс күштері молекулалар-ды жақындатуға тырысады. Сыртқы күштер де тура осылай әсер етеді.
 қосымша
қысымның пайда болуының себепшісі –
молекулалар-дың өзара бір-біріне
тартылысы. Сондықтан ыдыстың бетіне
газ тарапынан түсірілген қысым, осы
қабаттың бірлік бетіндегі барлық
молекулаларға әсер ететін күшке тең
болады.Бұл әрекет етуші күштердің
нәти-желік мәні газдың ішіне қарай
бағыт-талған. Сол
себептен бұл күш моле-кулалардың n
сандық тығыздығына пропорционал. Екінші
жағынан, осы беттік қабаттағы тартылыс
күші әсер ететін молекулалар саны да
қосымша
қысымның пайда болуының себепшісі –
молекулалар-дың өзара бір-біріне
тартылысы. Сондықтан ыдыстың бетіне
газ тарапынан түсірілген қысым, осы
қабаттың бірлік бетіндегі барлық
молекулаларға әсер ететін күшке тең
болады.Бұл әрекет етуші күштердің
нәти-желік мәні газдың ішіне қарай
бағыт-талған. Сол
себептен бұл күш моле-кулалардың n
сандық тығыздығына пропорционал. Екінші
жағынан, осы беттік қабаттағы тартылыс
күші әсер ететін молекулалар саны да
 тығыздыққа пропорционал. Сондықтан
қосымша қысым
тығыздыққа пропорционал. Сондықтан
қосымша қысым .
. (5.21)
(5.21)
Молекулалардың
сандық тығыздығы
 мольдік көлемге кері про-порционал,
демек
мольдік көлемге кері про-порционал,
демек .Сөйтіп
.Сөйтіп ,
демек
,
демек ,
(5.22)
,
(5.22)
мұндағы а – пропорциналдық коэффициент, сандық мәні молекула-лардың арасындағы тартылыс күшіне тәуелді.
Сонымен,
 -нің
(5.22) бойынша анықталған мәнін (5.20)-шы
формулаға қойсақ, нақты газ күйінің
теңдеуін мына түрде жазуға болады:
-нің
(5.22) бойынша анықталған мәнін (5.20)-шы
формулаға қойсақ, нақты газ күйінің
теңдеуін мына түрде жазуға болады:
 .
(5.23)Бұл
өрнек нақты газдың қысымын, көлемін
және температурасын байланыстырады
және бір молі үшін анықталған, сондықтан
нақты
газ күйінің теңдеуі деп
аталады. Бұл теңдеуді Ван-дер-Ваальс
теңдеуі деп те атайды, ондағы
.
(5.23)Бұл
өрнек нақты газдың қысымын, көлемін
және температурасын байланыстырады
және бір молі үшін анықталған, сондықтан
нақты
газ күйінің теңдеуі деп
аталады. Бұл теңдеуді Ван-дер-Ваальс
теңдеуі деп те атайды, ондағы
 және
және тұрақты коэффициенттерВан-дер-Ваальс
тұрақтылары
делінеді. Ван-дер-Ваальс теңдеуінде
тартылыс күштері (
тұрақты коэффициенттерВан-дер-Ваальс
тұрақтылары
делінеді. Ван-дер-Ваальс теңдеуінде
тартылыс күштері ( –
түзетуші мүше) және тебу күштері (
–
түзетуші мүше) және тебу күштері ( –
түзеткіш) ескерілген. Осы теңдеуде
молекула-кинетикалық көзқарастарына
сүйеніп, нақты газдың негізгі қасиеттері
ескеріліп, алғашқы рет тұжырымдалған.
–
түзеткіш) ескерілген. Осы теңдеуде
молекула-кинетикалық көзқарастарына
сүйеніп, нақты газдың негізгі қасиеттері
ескеріліп, алғашқы рет тұжырымдалған.
 тұрақтысының өлшем бірлігі көлеммен
сәйкес, яғни м3/моль,
ал
тұрақтысының өлшем бірлігі көлеммен
сәйкес, яғни м3/моль,
ал
 -ның
өлшем бірлігі қысымның бірлігіне сәйкес
болады, сондықтан СИ жүйесіндеПа·м6·м-2,
демек
-ның
өлшем бірлігі қысымның бірлігіне сәйкес
болады, сондықтан СИ жүйесіндеПа·м6·м-2,
демек
 .
Әр түрлі газдар үшін
.
Әр түрлі газдар үшін және
және тұрақтыларының
мәндері әр түрлі болады.(5.23)-ші теңдеу
бір моль газға қатысты жазылған. Кез
келген газдың массасы үшін ол былай
жазылады:
тұрақтыларының
мәндері әр түрлі болады.(5.23)-ші теңдеу
бір моль газға қатысты жазылған. Кез
келген газдың массасы үшін ол былай
жазылады: ,(5.24)
,(5.24)
мұндағы m – газдың массасы, М – мольдік масса, V – газдың көлемі.
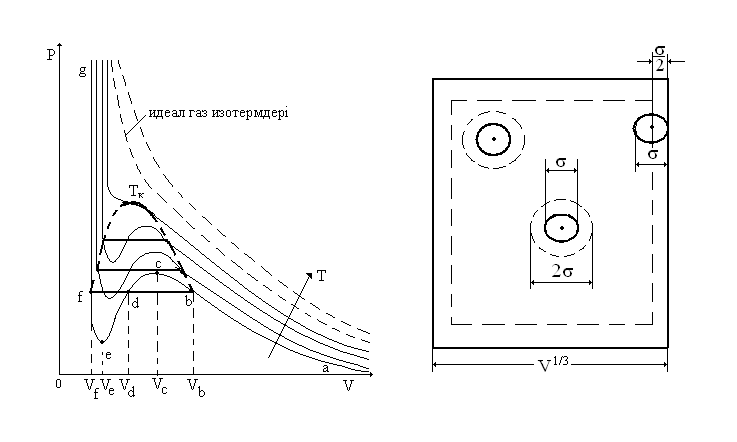
30. Ван-дер-Ваальс изотермдері және олардың талдауы. Критикалық температура. K T T
болғанда, изотермдердің түрі. K T T болғанда, изотермдердің түрі. Орнықсыз (стабильді
емес),
метастабильді күйлер. Аса қаныққан бу,
асыра қыздырылған сұйық
Ван-дер-Ваальстың
(5.23)-ші
теңдеуін жақшаларын ашып, қара-пайым
түрлендіруден кейін мына түрге келтіруге
болады:
 .Екі
жағын
.Екі
жағын -ға
бөліп, бұл теңдеуді былай жазамыз:
-ға
бөліп, бұл теңдеуді былай жазамыз:
 көлемге
қатысты осы теңдеу үшінші дәрежелі,
сондықтан оның үш түбірі болады: үш
нақты немесе бір нақты, екі жорамал
түбірі бар. Демек, белгілі қысымдар
аралығында бір қысымның мәніне көлемнің
әр түрлі үш мәні сәйкес келеді. Осы
қысымдар аралығынан тыс жағдайларда
қысымның бір мәніне көлемнің белгілі
бір мәні сәйкес болады. Ван-дер-Ваальс
теңдеуінің түбірлерінің мағынасын ашу
үшін, (5.23) бойынша изотермдерін, яғни
тұрақты температурада қысымның көлемге
қатысты тәуелділігін талдау қажет. Онда
(5.23)-ті мына түрде жазу қолайлы:
көлемге
қатысты осы теңдеу үшінші дәрежелі,
сондықтан оның үш түбірі болады: үш
нақты немесе бір нақты, екі жорамал
түбірі бар. Демек, белгілі қысымдар
аралығында бір қысымның мәніне көлемнің
әр түрлі үш мәні сәйкес келеді. Осы
қысымдар аралығынан тыс жағдайларда
қысымның бір мәніне көлемнің белгілі
бір мәні сәйкес болады. Ван-дер-Ваальс
теңдеуінің түбірлерінің мағынасын ашу
үшін, (5.23) бойынша изотермдерін, яғни
тұрақты температурада қысымның көлемге
қатысты тәуелділігін талдау қажет. Онда
(5.23)-ті мына түрде жазу қолайлы:
 сы
теңдеу бойынша теориялық изотермнің
мини-мумы, максимумдары бар,
сы
теңдеу бойынша теориялық изотермнің
мини-мумы, максимумдары бар,
 болғанда,
болғанда, еке-нін байқаймыз. Сондықтан
еке-нін байқаймыз. Сондықтан көлемb-дан
кем болуы мүмкін емес, олай болса газ
орналасқан ыдыстың көлемі барлық
молекулалардың төрт еселенген көлемінен
кіші болуы мүмкін емес.
Критикалық
температура- сұйық
пен оның қаныққан буының арасындағы
өзгешелігі жойылатын температура.
Критикалық температура нүктесімен
сипатталатын изотермді критикалық
изотерм
дейді. Ван-дер-Ваальс теңдеуі көлемге
қатысты 3-дәрежелі теңдеу болғандықтан
оның 3 түбірінің 1-еуі нақты және 2-уі
жорамал н/е төменгі темп. 3 нақты түбірлері
болады. Темп. Т>
көлемb-дан
кем болуы мүмкін емес, олай болса газ
орналасқан ыдыстың көлемі барлық
молекулалардың төрт еселенген көлемінен
кіші болуы мүмкін емес.
Критикалық
температура- сұйық
пен оның қаныққан буының арасындағы
өзгешелігі жойылатын температура.
Критикалық температура нүктесімен
сипатталатын изотермді критикалық
изотерм
дейді. Ван-дер-Ваальс теңдеуі көлемге
қатысты 3-дәрежелі теңдеу болғандықтан
оның 3 түбірінің 1-еуі нақты және 2-уі
жорамал н/е төменгі темп. 3 нақты түбірлері
болады. Темп. Т> критикалықтан жоғары изотермдер –
үзіліссіз, бірсарынды өзгеретін қисықтар
, түрлері гипербола, сияқты идеал
газдікіндей болады. Темп. Т<
критикалықтан жоғары изотермдер –
үзіліссіз, бірсарынды өзгеретін қисықтар
, түрлері гипербола, сияқты идеал
газдікіндей болады. Темп. Т< кристикалықтан төменгі изотермдердің
орта бөлімдеріерекше
толқын тәріздес иіліс болады.
Бірақ осы изотермдерде негізгі
ерекшеліктері бар: ол эксперименттік
изотерміндегі baf
және
теориялық изотермдегі cde
бөлімдерімен байланысты cde
нүктелеріне
сәйкес күйлер табиғатта болмайды. Себебі
көлемнің қысымға тәуелділігі әдеттен
тыс, онда қысым өскенде көлем кішіреймейді,
ол да ұлғаяды. Тіпті осындай ғажайып
қасиетке ие заттар болса да, олардың
күйлері өте орнықсыз болуы керек. Осы
cde
бөліміне
сәйкес күйлерді орнықсыз
кристикалықтан төменгі изотермдердің
орта бөлімдеріерекше
толқын тәріздес иіліс болады.
Бірақ осы изотермдерде негізгі
ерекшеліктері бар: ол эксперименттік
изотерміндегі baf
және
теориялық изотермдегі cde
бөлімдерімен байланысты cde
нүктелеріне
сәйкес күйлер табиғатта болмайды. Себебі
көлемнің қысымға тәуелділігі әдеттен
тыс, онда қысым өскенде көлем кішіреймейді,
ол да ұлғаяды. Тіпті осындай ғажайып
қасиетке ие заттар болса да, олардың
күйлері өте орнықсыз болуы керек. Осы
cde
бөліміне
сәйкес күйлерді орнықсыз деп
аталады. Осы с мен е аралығындағы кез
келген күйлер орнықсыз стабильді емес
болады. bc және ef аралығындағы күйлер
метастабильді
деп аталады. Олар заттың біртекті
тұрақсыздау
күйлерін анықтайды. Ван-дер-Ваальс
изотермдегі be және ef бөліктері орнықсыз
болғанымен, cde
бөлігіндегі
күйлермен салыстырсақ, олар ерекше
жағдайларда тәжірибеде байқалуы мүмкін
заттың be
бөлігіне
сәйкес күйлері газ тәріздес, демек
табиғилыққа қарсы келеді. Заттың мұндай
ерекшк күйі жабық ыдыстағы ылғал ауаны
өте тез суытқанда байқалады. Мұндай
күйді аса
қаныққан бу д.а.
fe
бөлігіндегі
сұйықтың қысымы қаныққан будың қысымынан
кіші болады. Бұл күй де метастабильді,
орнықсыз. Булану орталығы пайда болысымен
, сұйық қатты қайнайды, сұйық үстіндегі
будың қысымы көбейеді де изотермнің fe
бөлігіндегі
нүктелер fd
бөлігіндегі
күйлерге көшеді. Қысымы қаныққан бу
қысымынан төмен сұйықты аса
қыздырылған сұйық
д.а.
деп
аталады. Осы с мен е аралығындағы кез
келген күйлер орнықсыз стабильді емес
болады. bc және ef аралығындағы күйлер
метастабильді
деп аталады. Олар заттың біртекті
тұрақсыздау
күйлерін анықтайды. Ван-дер-Ваальс
изотермдегі be және ef бөліктері орнықсыз
болғанымен, cde
бөлігіндегі
күйлермен салыстырсақ, олар ерекше
жағдайларда тәжірибеде байқалуы мүмкін
заттың be
бөлігіне
сәйкес күйлері газ тәріздес, демек
табиғилыққа қарсы келеді. Заттың мұндай
ерекшк күйі жабық ыдыстағы ылғал ауаны
өте тез суытқанда байқалады. Мұндай
күйді аса
қаныққан бу д.а.
fe
бөлігіндегі
сұйықтың қысымы қаныққан будың қысымынан
кіші болады. Бұл күй де метастабильді,
орнықсыз. Булану орталығы пайда болысымен
, сұйық қатты қайнайды, сұйық үстіндегі
будың қысымы көбейеді де изотермнің fe
бөлігіндегі
нүктелер fd
бөлігіндегі
күйлерге көшеді. Қысымы қаныққан бу
қысымынан төмен сұйықты аса
қыздырылған сұйық
д.а.