
molekulyarny (4)
.docx
{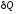 ,
dU және
,
dU және
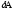 }
шамалары процеске және күй функциясына
жатады:
}
шамалары процеске және күй функциясына
жатады:
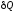 ,
,
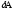 -
процесс; dU – күй
функциясы;
-
процесс; dU – күй
функциясы;
*{Ең ықтимал, орташа квадраттық және орташа арифметикалық } жылдамдықтардыңың дұрыс формулаалары:
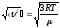 ;
;
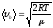 ;
;
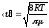 .
.
*{Жылу мөлшері, жұмыс және ішкі энергия} шамаларының дұрыс анықтамалары:
жылу мөлшері – процесс; жұмыс – процесс; ішкі энергия- күй функциясы
*{Изотермдік, изобаралық және адиабаталық} процестерге берілген жылудың жұмсалуы:
термодинамикалық жүйеге берілген жылу тек жұмыс жасауға жұмсалады;
термодинамикалық жүйеге берілген жылу ішкі энергияны арттыруға және жұмыс жасауға жұмсалады; термодинамикалық жүйе ішкі энергияның кемуі арқылы жұмыс жасайды.
*{Изотермдік, изобаралық және изохоралық} процестерге берілген жылудың жұмсалуы:
термодинамикалық жүйеге берілген жылу тек жұмыс жасауға жұмсалады;
термодинамикалық жүйеге берілген жылу ішкі энергияны арттыруға және жұмыс жасауға жұмсалады; термодинамикалық жүйеге берілген жылу тек жүйенің ішкі энергиясын арттыруға жұмсалады
*{Изохоралық, избаралық және адиабаталық} процестер үшін жылусиымдылықтың дұрыс мәндері:
V = const, C
= CV, p = const, C = CP,
 ,
C = 0
,
C = 0
*{Изохоралық, избаралық және адиабаталық} процестер үшін политропа көрсеткіштері:
V = const, C =
CV,
 ,
,
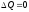 ,
C = 0,
,
C = 0,
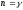 ,
p = const, C = CP, n =0.
,
p = const, C = CP, n =0.
*{Изохоралық, избаралық және адиабаталық} процестердің ішкі энергиясының өзгерісі:
V = const, C =
CV,
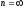 ;
;
 ,
C = 0,
,
C = 0,
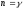 ;
p
= const, C = CP, n =0.
;
p
= const, C = CP, n =0.
*{Изохоралық, избаралық және адиабаталық} процестердің ішкі энергиясының өзгерісі :
dU= -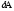 ;
dU =
;
dU =
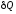 ;
dU= - pdV +
;
dU= - pdV +
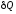 .
.
*{Изохоралық, избаралық және изотермдік} процестер үшін жылусиымдылықтың дұрыс мәндері:
V = const, C = CV, p = const, C = CP, T = const, C = ¥.
*{Изохоралық, избаралық және изотермдік} процестер үшін политропа көрсеткіштері:
T= const: n =
1;
P=const: n = 0;
V=const: n =
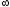
*{Изохоралық, избаралық және изотермдік} процестердің ішкі энергиясының өзгерісі:
dU =
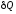 ;
dU = 0;
dU
=
;
dU = 0;
dU
=
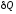 –
–
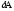
*{Фик, Фурье, Ньютон} заңдарының математикалық жазылуы:
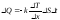 ,
,
 ,
,
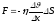
4 моль көмір қышқыл газы (CO2) тұрақты қысымда 100 К температураға дейін қыздырылған. Осы газдың ұлғаю жұмысын, ішкі энергиясының өзгерісін және газға берілген жылу мөлшерін табыңыз?:
3,324 кДж, 9,972 кДж, 13,296 кДж.
*А оқиғасының P(A) ықтималдылығының өзгеру шектері
:0 £ P(A) £ 1,
0% ³ P(A)³100%,
А оқиғасының P(A) ықтималдылығы 0 -ден 1-ге дейінгі шекте өзгереді
*Авагадро NA.тұрақтысының дұрыс сандық мәні:
NA = 6,02×1023 моль-1, NA = 6,02×1026 кмоль-1, NA = 6,02×1023 1/моль.
*Адиабатада
(суретті қараңыз) жүйенің 1-ші күйден
2-ші күйге өту процесі кескінделген, осы
суретте температураның өзгерісі, ішкі
энергия, жылу берілген немесе алынған
және жұмыстың таңбасы дұрыс берілген
 :
:
dT < 0, dU < 0, dQ.= 0, dA > 0;
dU < 0, dT < 0, dQ.= 0, dA > 0;
dA > 0, dT < 0, dU < 0, dQ.= 0;
Адиабаталық процесс деп айтамыз:
қоршаған ортамен жылу алмаспайтын процесс,
бұл процесс жылулық оқшауланған жүйеде өтеді ,
бұл процесс қоршаған ортамен жылу алмаспайды.
Адиабаталық процесс үшін жылусиымдылықтың дұрыс мәні:
dQ = 0, C =0, адиабата, C =0, dS = 0, C =0.
Адиабаталық процестегі энтропия өзгерісіне арналған дұрыс формулалар (бір моль идеал газға арналған):
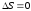 ;
;
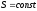 ;
;
энтропия - қайтымды адиабаталық процесте өзгеріссіз қалатын күй функциясы
Адиабатаның теңдеулері:
P×Vg = const, P1-g×T g = const, T×V(g-1) = const.
Адиабаттық процесс үшін жылусиымдылықтың дұрыс мәні:
dQ = 0, C =0, адиабата, C =0, dS = 0, C =0.
Барометрлік
формуланың дұрыс өрнегі (m – ауа
молекуласының массасы, M – ауаның
молярлық массасы):
 ,
,
 ,
,
 .
.
Бастапқы температурасы 300 К, 20 г сутегі (H 2) изобаралық жағадайда көлемін екі есе ұлғаю кезіндегі: газдың ұлғаю жұмысын, ішкі энергиясының өзгерісі және газға берілген жылу мөлшері:
24,932 кДж; 62,325 кДж; 87,255 кДж.
Беттік керілу s коэффициентінің дұрыс анықтамасы …:
сұйықтың бірлік бетінің қайтымды изотермдік жұмыс арқылы құрылуы,
сұйықтағы бетке жанама бағытталған контурдың бірлік ұзындығына сәйкес контурға перпендикуляр әсер ететін күш,
сұйықтағы беттік қабаттағы бірлік бетке сәйкес еркін энергия
Бір моль { ,
,
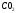 ,
,
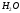 }
массасы:
}
массасы:
32 г, 44 г, 18 г..
Бір моль Ван-дер-Ваальс газы үшін дұрыс формуланың түрлері:
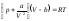 ,
,

, .
.
Бір моль Ван-дер-Ваальс газының ішкі энергиясына арналған дұрыс формула:
U(V,T)=CvT - a/V;
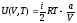 ,
,
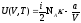
Бір моль идеал газ үшін {изотермдік, изобаралық және изохоралық} процестерге арналған энтропия өзгерісінің дұрыс формулалары:
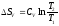 ,
,
 ,
,
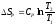 .
.
Бір моль идеал газ үшін изотермдік процестегі жұмыстың дұрыс формуласы:
 ,
,
 ,
,

Бір моль идеал газға арналған дұрыс күй формулалары (m – газ массасы, M – молярлық масса):
 ,
,
 ,
,
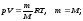
Бір моль идеал газдың адиабаталық процестегі жасайтын жұмысына арналып жазылған дұрыс формуласы:
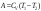 ,
,
 ,
,
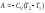 .
.
Бір моль идеал газдың ішкі энергиясына арналған дұрыс формуласы:
 ,
,
 ,
,
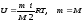 .
.
Бір моль идеал газдың температурасы {изобаралық изохоралық және адиабаталық}процестерде е = 2,7 есе артқандағы энтропияның өзгерісі:
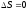 ;
;
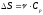 ;
;
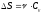 .
.
Бір моль идеал газдың температурасы {изобаралық изохоралық және изотермдік}процестерде е = 2,7 есе артқандағы энтропияның өзгерісі:
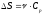 ,
,
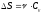 ,
,
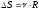 .
.
Больцман үлестіріміне арналған дұрыс формула (Еп – сыртқы күш өрісіндегі бір молекуланың потенциальдық энергиясы):
 ,
,
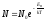 ,
,
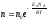 .
.
Больцман формуласының дұрыс түрлері:
S = k ln W,
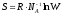 ;
;
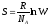
Ван-дер-Ваальс газы үшін критикалық{көлем, қысым, температураның} өрнектелінуі:
Vc =3b, Pc = a/27b2, Tc = 8a/27bR.
Ван-дер-Ваальс газының көлемі мен температурасы осы шамалардың критикалық мәндерінен екі есе үлкен болса, газдың қысымы мен критикалық қысымның қатынасының сан мәні:
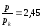 ,
,
 ,
,
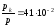
Газ V1
көлемнен V2 көлемге бір рет изотермдік,
ал екінші рет изобаралық және үшінші
рет адиабаталық ұлғайады. Осы процестердің
дұрыс өрнектелген түрі
 = 0, адиабата
1 – 2;
= 0, адиабата
1 – 2;
 = 0, адиабата
1 – 211;
= 0, адиабата
1 – 211;
p = const, изобара 1- 21
Газдардағы D - диффузия коэффициентінің дұрыс формуласы:
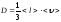 ,
,
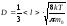 ,
,
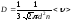 .
.
Газдардағы T = const кезіндегі {h , l және D} коэффициенттерінің қысымға р тәуелділігінің дұрыс түрлері:
h қысымға тәуелді емес;
l қысымға тәуелді емес;
D~
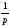
Газдардағы l жылуөткізгіштік коэффициенті және h тұтқырлық коэффициентін өзара байланыстыратын дұрыс формула:
l
= h×cv;
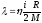 ;
;
 .
.
Газдардағы {изотермдік, изохоралық және адиабаталық} процестерге арналып жазылған термодинамиканың бірінші заңы:
dQ
=
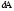 =
=
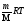 ln
ln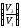 ,
,
dQ
= dU =
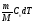 ,
,
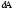 =
= -
dU =
-
dU =
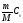 dT.
dT.
Газдардағы {изотермдік, изохоралық және изобаралық} процестерге арналып жазылған термодинамиканың бірінші заңы:
dQ
=
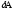 =
=
 ln
ln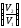 ,
,
dQ
= dU =
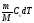 ,
,
dQ
=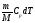 .
.
Газдардағы D диффузия коэффициенті және l жылуөткізгіштікті өзара байланыстратын дұрыс формулалар:
l = D×r×cv,
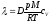 ,
,
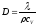
Газдардағы D диффузия коэффициенті және h тұтқырлық коэффициентін өзара байланыстыратын дұрыс формула:
h = D×r;
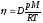 ;
;

Газдардағы G физикалық қасиеттің жалпы тасымалдау теңдеуіндегі дұрыс формуласы:
d(NG)=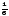 (n1<
(n1< 1>G1
- n2<
1>G1
- n2< 2>G2)×dS×dt;
2>G2)×dS×dt;
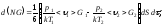
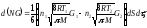
Газдардағы Р=const кезіндегі {h , l және D} коэффициенттерінің Т температураға тәуелділігінің дұрыс түрлері:
D ~
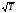 ;
;
h~ ;
;
l~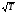
Газдардағы тұтқырлық h және жылу сиымдылық l коэффициенттерінің өзара байланыстыратын дұрыс формулалар:
l = h×r,
l = h×cv,
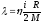 .
.
Газдардың l жылуөткізгіштігіне арналған дұрыс формула:
 ,
,
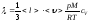 ,
,
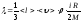
Газдардың h тұтқырлығына арналған дұрыс формулалар:
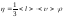 ;
;
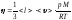 ;
;
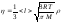
Газдардың диффузия коэффициенті D үшін жазылған дұрыс формула:
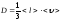 ,
,
 ,
,
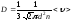 .
.
Газдардың диффузия коэффициентінің D температураға P тәуелділігінің ұрыс формуласы T = const:
D~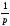 ,
,
 ,
,
D ~p-1.
Газдардың диффузия коэффициентінің D температураға T тәуелділігініңдұрыс формуласы қысым p = const:
D ~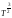 ,
D ~
,
D ~ ,
D ~
,
D ~ .
.
Газдардың молекула-кинетикалық теориясының негізгі теңдеуінің түрлері:
 ,
,
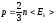 ,
,
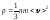 .
.
Газдардың тұтқырлығы үшін жазылған дұрыс формула:
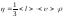 ,
,
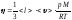 ,
,
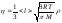 .
.
Гелийдің
күй диаграммасындағы гелийдің әртүрлі
күйлері дұрыс көрсетілген :
:
1 - қатты Не, 2 - Не-2, 3 - Не-1, 4 – газ;
3 - Не-1, 4 – газ, 1 - твердый Не,
2 - Не-2; 2 - Не-2, 1 - қатты Не, 3 - Не-1, 4 – газ.
Графиктегі
молекулааралық өзара әрекеттесу
күштерінің дұрыс түрлері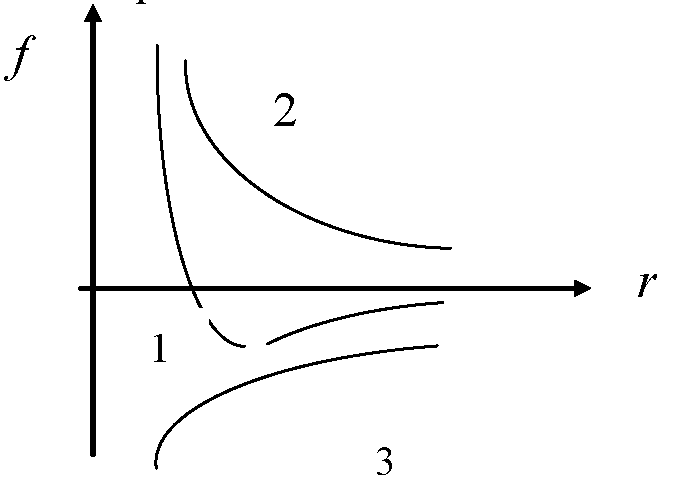 :
:
1 - fрез , 2 - fотт , 3 – fпри;
3 - fприт, 1 - fрез , 2 – fотт;
2 - fотт, 1 - fрез , 3 – fприт.
Графиктегі
молекулааралық өзара әрекеттесу
потенциалының дұрыс түрлері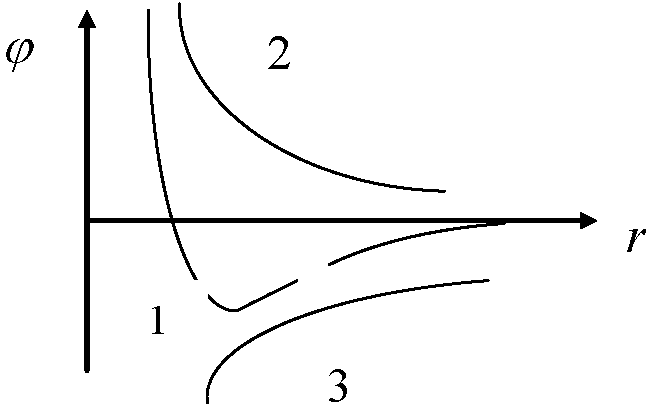 :
:
1 - jрез , 2 - jотт , 3 - jприт;
2 - jотт , 1 - jрез , 3 - jприт;
3 - jприт,1 - jрез , 2 - jотт.
Графиктегі
бейнеленген процестердің дұрыс реті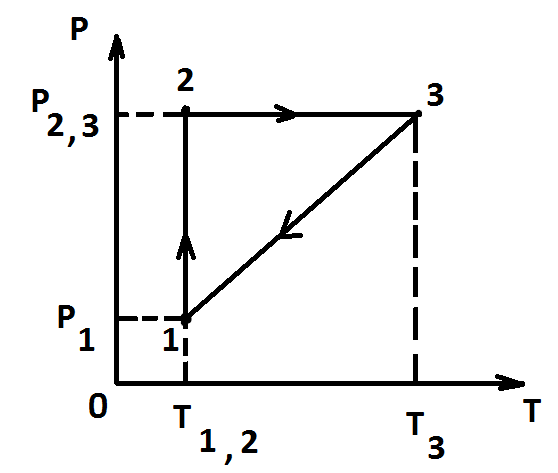
p = const, изобаралық ұлғаю 2- 3;
T = const, изотермдік сығылу 1-2;
V = const, изохоралық ұлғаю 3-1
Дене {ұзындығының, көлемінің және тығыздығының} қыздыру кезіндегі температураға тәуелділігі:
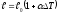 ,
,
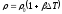 ,
,
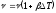 .
.
Джоуль-Томсон құбылысы байқалады:
идеал газдарда құбылыс байқалмайды;
нақты газдарда газ қызады;
нақты газдарда газ суйды.
Диффузия D және тұтқырлық h коэффициенттерінің өзара байланыстыратын дұрыс формулалар:
h
= D×r,
 ,
,
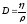 .
.
Диффузиялық ағынның тууындау себебтері :
қоспа компоненттері концентрацияларының біртексіз үлестірілуі,
қоспа компоненттерінің градиенттерінің нөлге тең емес,
қоспа компоненттерінің градиенттерінің нөлден ауытқуы
Дөңгелек капиллярдағы толық жұғу кезіндегі сұйық h деңгейін анықтайтын дұрыс формуласы (s – беттік керілу коэффициенті, r - капилляр радиусы, r – сұйықтың тығыздығы):
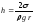 ,
,
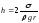 ,
,
 .
.
Дұрыс жазылған формула:
 ,
жұмыс - процестің функциясы, яғни
,
жұмыс - процестің функциясы, яғни
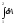 жүйенің
бір күйден екінші күйге өтуі,
жүйенің
бір күйден екінші күйге өтуі,
 .
.
Дұрыс жазылған формула:
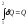 ,
Жылу - процесс болғандықтан
,
Жылу - процесс болғандықтан
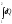 интеграл
жүйенің 1-ші күйден 2 -ші күйге өтуі
кезіндегі жылу мөлшері; Әртүрлі
процестердегі жүйемен алынған және
берілген
интеграл
жүйенің 1-ші күйден 2 -ші күйге өтуі
кезіндегі жылу мөлшері; Әртүрлі
процестердегі жүйемен алынған және
берілген
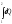 жүйенің
1-ші күйден 2 -ші күйге өтуі кезіндегі
жылу мөлшері
жүйенің
1-ші күйден 2 -ші күйге өтуі кезіндегі
жылу мөлшері
Дұрыс формулалар (g - адиабата теңдеуіндегі дәреже көрсеткіші, i - молекулалардың еркіндік дәрежесінің саны) тізбегі:
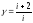 ,
,
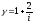 ,
,

Дұрыс формулаларды анықтаңыз
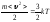 ;
;
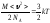 ;
;
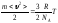
Екі атомды газдың меншікті жылусиымдылығы
сp = 14,7 kДж/(кг×К): 2×10-3 кг/моль; 2×г/моль; 0,002 кг/моль.
Екінші Карно теоремасының дұрыс жазылған түрі (Т1 – қыздырғыштың температурасы, Т2 – мұздатқыштың температурасы):
 ,
,
 ,
,
 .
.
Ең ықтимал
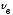 .жылдамдықтың
дұрыс формуласы:
.жылдамдықтың
дұрыс формуласы:
 ,
,
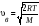 ,
,
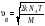
Әртүрлі изопроцестер жылусиымдылықтың дұрыс мәні:
адиабата, С = 0, изохора, С = CV, изотерма, С = ± ¥.
Жүйе 1-ші
күйден 2-ші күйге көшкенде газдың {V мен
P} өзгері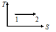
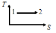
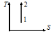
артады ; кемиді ; кемиді.
Жүйедегі флуктацияның рөлі туралы тұжырым:
қарастырылатын аймақ кіші болған сайын флуктуацияның рөлі артады,
флуктуациялардың салыстырмалы рөлі, олар қарастырылатын аймақтардың кемуіне байланысты өседі,
флуктуациялар қарастырылатын аймақ үлкен болған сайын, жүйедегі флуктуацияның рөлі өте аз.
Жылдамдық векторына арналған Максвелл үлестірім заңының дұрыс формуласы:
 ;
;
 ;
;
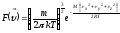
Жылу ағынының туындау себебтері:
температураның біртексіз үлестірілімі,
ортадағы температура градиенті нөлге тең емес,
ортадағы температура градиенті теңсіздігінің нөлге теі еместігі
Жылу машинасы цикл бойынша қыздырғыштан 100 Дж жылу мөлшерін алады, ал мұздатқышқа осы жылудың 75 % пайызын беретін болса, машинаның ПӘК-і h:
h
= 25 % , h
= 0, 25,
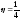 .
.
Жылу машинасының пайдалы әсер коэффициентінің дұрыс формуласы:
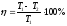 ,
,
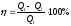 ,
,
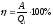 .
.
Жылу мөлшеріне арналған дұрыс формулалар:
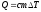 ,
,
 ,
,
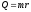
Жылуөткізгіштік, диффузия және тұтқырлық процестеріне арналған заңдардың дұрыс түрлері:
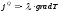 ,
,
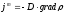 ,
,
 .
.
