
- •1. Молекулалық жүйенің статистикалық және термодинамикалық зерттеу әдістері,
- •4.Идеал газ молекулаларының орташа кинетикалық энергиясы.
- •6. Қысымның газдың тығыздығымен байланысын дәлелдеңіз және қысым мен тығыздықарқылы газдыњ молекулаларының орташа квадраттық жылдамдығын анықтаңыз.
- •7. Температура түсініктемесі. Температуралық шкала, реперлік нүктелер, температураны
- •8. Идеал газ күйінің теңдеуі, оның жалпы анықталмаған түрі. Қысымның газдың сандық
- •9. Менделеев-Клапейрон теңдеуін молекула-кинетикалық теорияның негізгі теңдеуінен
- •11. Молекулалық жүйедегі кездейсоқ оқиғалар мен кездейсоқ шамалар. Броундық
- •13. Изотермдік жағдайда ауаның қысымының Жердің бетінен биіктікке тәуелділігі. Барометрлік формула (қорытыңыз). Барометрлік формула
- •14.Үлестірілу функциясы туралы түсінік
- •15. Молекуланың жылдамдығына тәуелді функцияның (скалярлық, векторлық немесе
- •16. Максвеллдің үлестірілу функциясының жылдамдықтың х –компоненті үшін түрі,
- •17.Молекулалардың жылдамдықтар модулі бойынша үлестірілуі. Максвел заңы f(||)-ның V-қа тәуелділігін сипаттайтын графикті сызып, талдаңыз.
- •18. Әр түрлі температурада молекулалардың жылдамдықтар бойынша үлестірілу
- •20. Орташа арифметикалық жылдамдық, орташа квадраттық жылдамдығық және ең ықтимал жылдамдықтарды анықтайтын өрнектерді салыстырып байланыстарын талдаңыз
- •21. Максвеллдің формуласының өлшемсіз түрі. Салыстырмалы жылдамдық. F(u)
- •22. Ыдыстың қабырғасының бірлік ауданымен бірлік уақытта молекулалардың соқтығысу
- •23. Газдардың қасиеттерінің идеалдықтан ауытқуы. Идеал және нақты газдың
- •24. Эндрюстің эксперименттік изотермдері. Нақты газдар изотермдерін талдау.Критикалық немесе сындық изотерм, критикалық температура тк, критикалық қысым
- •26. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - қатты сфералар.
- •27. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - жұмсақ сфералар
- •28. Молекулааралық өзара әрекеттесуінің эмпирикалық потенциалы - Леннард-Джонс
- •31. Заттың критикалық күйі. Заттың p-V- күй диаграммасындағы критикалық күйін
- •38. Газдың көлемі өзгергендегі жұмыс. P f V тәуелділік бойынша жұмыстың
- •39.Идеал газдың жылусыйымдылығы. Меншікті жылусыйымдылық, мольдік
- •40. Изобарлық процестегі жылусыйымдылық.
- •41.Еркіндік дәрежелер саны. Газдардың жылусыйымдылығы арасындағы қатынастар
- •44. Термодинамиканың бірінші бастамасы мен идеал газ күйінің теңдеуін изотермдік
- •45. Термодинамиканың бірінші бастамасының дифференциалдық және толық
- •49. Жылудың механикалық жұмысқа айналуы. Циклдік процестер. Цикл жұмысы.
- •50. Карно циклі. Карно циклінің пайдалы әсер коэффициенті
- •Термодинамиканың дифференциалдық теңдеулерін қолданып, ішкі энергияның көлемге тәуелділігін анықтайық. Ішкі энергияның толық дифференциалы былай жазылады:
1. Молекулалық жүйенің статистикалық және термодинамикалық зерттеу әдістері,
олардың құндылығы мен тапшылығы. Статистикалық және термодинамиалық
заңдылықтар. Табиғатты зерттеудегі макроскоптыќ тәсіл микроскоптыќ тєсілден бұрын дамыѓан. Бұл макроскоптық єдістіњ мақсаты – заттың наќты жағдайда байќалатын және сезуге болатын ќасиеттерін түсіндіру болатын.Макроскоптыќ жүйелердіњ күйлерін зерттеу үшін физикада термодинамикалыќ жєне статистикалық деген єдістерді ќолданады.Термодинамикалыќ әдіс заттыњ атомдыќ-молекулалыќ ќұрылымы туралы ешќандай модельді көзќарастарға сүйенбейді жєне µзініњ мєні бойынша феноменологтыќ (гректің phanomenon – көрінетін, білінетін) болады. Термодинамикалыќ әдістің міндеті – тікелей тәжірибеде баќылайтын шамалардың (ќысым, температура, көлем, концентрация жєне т.б.) арасындаѓы байланысты таѓайындау. Кез келген физикалыќ мєселелерді шешу кезінде термодинамикалыќ әдісті ќолданѓанда, онда заттың атомдыќ-молекулалыќ ќұрылымымен байланысты ешќандай шамалар (атом мен молекула өлшемдері, олардың массасы жєне т.б.) ќарастырылмайды.Термодинамикалыќ әдістіњ күші, оның әр түрлі заттыњ тікелей байќалатын ќасиеттерініњ арасындаѓы ќатынастарды, олардыњ ішкі ќұрылымы туралы ештеңе білмей-аќ таѓайындауда білінеді. Орасан зор сан молекулалардан ќұралѓан күрделі жүйелер туралы мєліметті, тек ќана тµрттен артыќ емес, негізгі термодинамикалыќ зањдар мен бірнеше айнымалы шамаларѓа сүйеніп алуѓа болады. Термодина-миканыњ таѓы да бір артыќшылыѓы, оныњ ќорытындылары ќарас-тырып отырѓан жүйеніњ өзгешелігіне тєуелді емес. Мысалы, біз тастың температурасы деп, немесе жєндіктіњ, немесе адамныњ ќолыныњ температурасы жайында пікір айта аламыз. Тас, жєндіктіњ денесі, адамның ќолы жылулыќ тепе-тењдікте болатын ќасиетке ие. Заттыњ арнайы табиѓи ерекшелігі теорияда бірнеше параметрлер арќылы белгіленеді, мысалы жылусыйымдылыќ, мольдік кµлем деген сияќты. Осы єдіс негізінде екі єр түрлі күйдегі жүйелердің ќасиеттері туралы мєліметтер алуѓа мүмкіндік шыѓады. Тепе-теңдік термодинамикасы жүйені тыныштыќ күйінде бейне-лейді, оны көрнекі түрде былай сипаттауѓа болады осында жєне ќәзір, ол жүйенің бқрынѓы жайтын жєне алѓашќы күйден соњѓы күйге µту жолын ескермейді.Статистикалыќ әдіс термодинамикалыќ әдіске ќарама-ќарсы, ол бастан макроскоптыќ жүйелердің ќасиеттерін зерттегенде модельдік атомдыќ-молекулалыќ көзќарастарѓа негізделген. Статистикалыќ әдістің маќсатын былай тұжырымдауѓа болады: заттың макроскоптыќ мөлше-рінің ќасиеттерінің өзгерісі заңын таѓайындау үшін, оныњ ќұрамындаѓы бөлшектердің (молекула, атом, ион жєне т.б.) ќозѓалыс заңдарын білу ќажет. Сондыќтан статистикалыќ физика термодинамика заңдарының теориялыќ дәлелдеуін атомдыќ-молекулалыќ тұрѓыдан көрсетеді.
|
әдіс |
Ќұндылыѓы |
Тапшылығы |
|
термодина-микалыќ
статистика-лыќ |
жалпылыќты, ќарапайым, заттыњ ќұрылымындаѓы атомдар мен молекулалар туралы мєліметтерді талап етпейді;
термодинамика шењберінде шешілмейтін күй теңдеулерін ќорыту, жылусыйымдылыќ теориясын ќөру жєне т.б., зањдардыњ ќолдану шегін аныќтау сияќты мєселелерді шешуге мүмкіндік тудырады. |
ќұбылыстардыњ ішкі механизмі ашылмайды;
ќорытындылары ќолданѓан атомдыќ-молекулалыќ модель шењберінде ѓана дұрыс орындалады. |
Осы айтылѓандардан физикалыќ ќұбылыстарды зерттеуде термо-динамикалыќ және статистикалыќ әдістердің ќұндылыѓы мен тапшылыѓы (1.1-кесте) көрінеді.
Жалпы жаѓдайда осы екі єдіс бір-біріне ұштасып, бірлестірілген статистикалыќ термодинамика әдісін ќұрастырады.
2.
Тығыздық. Меншікті қасиеттер. Бірлік
көлемдегі молекула саны. Массалықтығыздықтың
сандық тығыздықпен байланысы. Толық
масса.
Термодинамикалық жүйенің
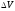 көлеміндегі қасиетінің мөлше-рін
көлеміндегі қасиетінің мөлше-рін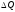 деп белгілейік.
деп белгілейік. көлемдегі қасиеттіңq
тығыздығын
көлемдегі қасиеттіңq
тығыздығын
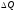 мөлшерін осы көлемнің
мөлшерін осы көлемнің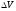 шамасына қатынасы түрінде анықтайды:
шамасына қатынасы түрінде анықтайды: ,
,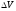 жүйенің толық
жүйенің толық көлемінің бөлігі, сондықтан
көлемінің бөлігі, сондықтан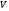 -дағы
қасиеттің мөлшерін (2.2) өрнекті интегралдау
арқылы табамыз:
-дағы
қасиеттің мөлшерін (2.2) өрнекті интегралдау
арқылы табамыз: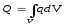 мұндағыdV
–
жүйенің шексіз кішкене бөлігінің
көлемі.
мұндағыdV
–
жүйенің шексіз кішкене бөлігінің
көлемі.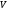 көлемдегі газ массасы
көлемдегі газ массасы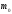 біркелкі молекуладан құралған делік.
Молекулалар саны
біркелкі молекуладан құралған делік.
Молекулалар саны .
Онда газдың
.
Онда газдың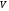 көлеміндегі массасын былай табамыз:
көлеміндегі массасын былай табамыз: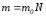 .Бірлік
көлемдегі газдың массасының тығыздығын
.Бірлік
көлемдегі газдың массасының тығыздығын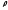 деп белгі-лейді. Онда (2.2) және (2.4)
өрнектерге сүйеніп,
деп белгі-лейді. Онда (2.2) және (2.4)
өрнектерге сүйеніп,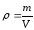 ,
кг/м3
(2.5) деп жаза аламыз.
,
кг/м3
(2.5) деп жаза аламыз.
Бірлік
көлемдегі молекулалар саны немесе
сандық тығыздығы (2.2) бойынша мынаған
тең болады:
 , 1/м
(2.6)
, 1/м
(2.6)
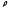 және
және
 байланысты, оны (2.4) және (2.5) өрнектерін
ескеріп, анықтаймыз:
байланысты, оны (2.4) және (2.5) өрнектерін
ескеріп, анықтаймыз:
 .
(2.7)Осыдан, массалық тығыздық бір молекула
массасын сандық тығыздыққа көбейту
арқылы анықталады және ол бірлік
көлемдегі молекулалар санына тура
пропорционал болады. Егер заттың
.
(2.7)Осыдан, массалық тығыздық бір молекула
массасын сандық тығыздыққа көбейту
арқылы анықталады және ол бірлік
көлемдегі молекулалар санына тура
пропорционал болады. Егер заттың
 тығыздығы белгілі болса, онда (2.3) формула
бойынша барлық
тығыздығы белгілі болса, онда (2.3) формула
бойынша барлық көлемдегі оның толық массасы (2.8)
болатындығы анық.
көлемдегі оның толық массасы (2.8)
болатындығы анық.
Егер
заттың қасиеті оның бірлік массасына
қатысты анықталса, онда оны меншікті
қасиет деп атайды. Мысалы, меншікті
көлем
 төмендегі өрнек арқылы табылады:
төмендегі өрнек арқылы табылады: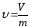 мұндағы
мұндағы –
газдың көлемі,
–
газдың көлемі,
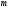 –
газдың
массасы.(2.5) ескерсек, онда меншікті
көлем
–
газдың
массасы.(2.5) ескерсек, онда меншікті
көлем
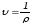 тығыздыққа кері
тығыздыққа кері
пропорционал
болады.Заттың бір моліндегі қасиеті
мольдік
деп аталады. Мысалы, мольдік масса немесе
мольдік көлем. Температурасы мен қысымы
бірдей идеал газдардың мольдік көлемдері
бірдей болады. Мысалы, қалыпты жағдайда,
температура 0оС
және
қысымы 760
мм сын.бағ.
болғанда, бір моль идеал газдың көлемі
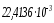 м3
болады.
м3
болады.
3.Концентрация.Көлемдік,салыстырмалымольдік, салыстырмалы массалық концентрация. Парциал қысым және оның қоспадағы мольдік үлесімен байланысы.Дальтон заңы. Қоспа (ерітінді, қорытпа) құрамындағы затты компонент (латын-ның componens – құраушысы) деп атайды. Қоспаның қосылыс сандық құрамын әр түрлі тәсілдер арқылы анықтайды. Қоспаның бірлік массасындағы немесе бірлік көлеміндегі зат компоненттерінің мөлше-рін концентрация деп атайды. Концентрация әдетте, қоспаның компо-ненттерінің салыстырмалы мөлшерін сипаттайтын шама болады. Сондықтан, ол % процентпен немесе компоненттің массалық немесе мольдік үлесімен анықталуы мүмкін.
Қоспадағы заттың физикалық қасиеттері компоненттердің қасиет-терімен тығыз байланысты. Сол себептен қоспадағы заттың концен-трациясын білуіміз өте қажет.Молекулалық физикада концентрацияның бірнеше түрлеріқолда-нылады.Осы
айтылғандардан,
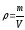 (2.5) және
(2.5) және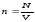 (2.6) өрнегімен анықталған масса-лық және
сандық тығыздықтар көлемдік концентрация
қатарынажатады.
Мұндай концентрациялардың өлшем
бірліктері болады. Мыса-лы,
(2.6) өрнегімен анықталған масса-лық және
сандық тығыздықтар көлемдік концентрация
қатарынажатады.
Мұндай концентрациялардың өлшем
бірліктері болады. Мыса-лы,
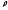 массалық тығыздықтың бірлігікг/м3,
ал
массалық тығыздықтың бірлігікг/м3,
ал
 –
сандық тығыздықтың – 1/м3
болады.
–
сандық тығыздықтың – 1/м3
болады.
Көптеген физикалық мәселелерді қарастырғанда өлшемсіз концен-трацияны қолдану ыңғайлы.
Қоспадағы
i
–
компоненттің мольдік үлесі немесе
салыстырмалы мольдік концентрациясы
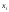 деп, осы компоненттің
деп, осы компоненттің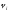 мольдер санының барлық қоспаның
компоненттерінің мольдер санына
мольдер санының барлық қоспаның
компоненттерінің мольдер санына
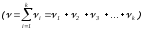 қатысы
арқылы анықталатын шаманы айтады, демек
қатысы
арқылы анықталатын шаманы айтады, демек
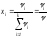 ,
, ,мұндағы
,мұндағы – компоненттің бөлшектер саны,
– компоненттің бөлшектер саны,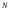 –
жалпы моле-кулалар саны,
–
жалпы моле-кулалар саны, -
компоненттер саны.Идеал газдар қоспасы
үшін мольдік үлесі компоненттердің
парциал қысымдары
-
компоненттер саны.Идеал газдар қоспасы
үшін мольдік үлесі компоненттердің
парциал қысымдары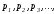 және қоспаның жалпы қысымы
және қоспаның жалпы қысымы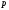 арқылы анықталуы мүмкін:
арқылы анықталуы мүмкін: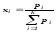 .
.
Қоспаға
кіретін заттың қайсыбір компонентінің
дәл сол қоспа-дағыдай мөлшерде ыдыста
жалғыз өзі қалған кездегі
 қысымы, газ қоспасының сол компонентініңпарциал
қысымы
деп аталады. Онда, газ қоспасының жалпы
қысымы, газ қоспасының сол компонентініңпарциал
қысымы
деп аталады. Онда, газ қоспасының жалпы
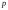 қысымы қоспаның компоненттерінің
пар-циал қысымдарының қосындысына тең
болады:
қысымы қоспаның компоненттерінің
пар-циал қысымдарының қосындысына тең
болады: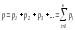 .
Сөйтіп, идеал газ қоспасының жалпы
қысымы (2.12)-ші формула-мен анықталады,
оныДальтон
заңы
дейді.Идеал газдың қоспалары да кәдімгі
идеал газ болып келеді.Осы айтылғаннан,
идеал газ қоспасының кез келген
компонентінің парциал қысымы, оның
қоспадағы мольдік үлесінің қоспаның
жалпы қысымының көбейтіндісінетеңболады:Салыстырмалы
мольдік концентрацияны бірлік көлемдегі
.
Сөйтіп, идеал газ қоспасының жалпы
қысымы (2.12)-ші формула-мен анықталады,
оныДальтон
заңы
дейді.Идеал газдың қоспалары да кәдімгі
идеал газ болып келеді.Осы айтылғаннан,
идеал газ қоспасының кез келген
компонентінің парциал қысымы, оның
қоспадағы мольдік үлесінің қоспаның
жалпы қысымының көбейтіндісінетеңболады:Салыстырмалы
мольдік концентрацияны бірлік көлемдегі
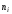 молекулалар саны арқылы есептеуге
болады:
молекулалар саны арқылы есептеуге
болады: ,
,
мұндағы
 .Кең
тараған
.Кең
тараған –
компоненттің массалық үлесі немесе
салыстыр-малымассалық концентрациясы
былай анықталады:
–
компоненттің массалық үлесі немесе
салыстыр-малымассалық концентрациясы
былай анықталады:
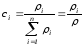 ,
(2.15)
,
(2.15)
мұндағы
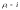 – компоненттің тығыздығы,
– компоненттің тығыздығы,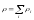 – қоспаның тығыздығы.Қоспаның салыстырмалы
концентрациясының қосындысы бірге тең
болады, демек
– қоспаның тығыздығы.Қоспаның салыстырмалы
концентрациясының қосындысы бірге тең
болады, демек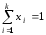 немесе
немесе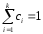 Қоспалардның
қасиеттерін қарастырғанда әр түрлі
араласу ережелерін қолданады.
Қоспалардның
қасиеттерін қарастырғанда әр түрлі
араласу ережелерін қолданады.
Мысалы,
қоспаның құрамында екі компонент бар
делік, онда
 қоспаның тығыздығын таза компоненттердің
қоспаның тығыздығын таза компоненттердің және
және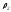 тығыздықтары арқылы былай анықтауға
болады
тығыздықтары арқылы былай анықтауға
болады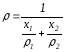 . Қоспадағы
. Қоспадағы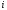 компоненттің мольдік көлемдік
концентрациясы мына түрде анықталады:
компоненттің мольдік көлемдік
концентрациясы мына түрде анықталады: ,
моль/м3
,
моль/м3
мұндағы,
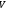 –
газдың көлемі,
–
газдың көлемі,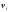 –
мольдер саныi
–
компоненттің.Идеал газдың қоспалары
үшін заттың көлемдік және салыстыр-малы
мольдік концентрациялары дәл келеді.
–
мольдер саныi
–
компоненттің.Идеал газдың қоспалары
үшін заттың көлемдік және салыстыр-малы
мольдік концентрациялары дәл келеді.
Газдағы
молекулалар қозғалысын толық сипаттау
үшін, олардың өзі орналасқан ыдыстың
қабырғасымен соқтығысу мәселесін шешу
қажет. Газдағы молекулалар арақашықтығы
олардың өлшемдерінен (молекула диаметрі)
әлдеқайда үлкен. Бір ізділік соқтығысу
аралы-ғында молекулалар қозғалысы ешбір
әсерсіз өтеді. Сондықтан, әрбір молекула
ізінше соқтығысу аралығында еркін жол
жүреді.Біз идеал
газды қарастырамыз. Онда молекулалық
күштер ескеріл-мейді, газдың молекулалары
материялық нүктелер деп есептеледі.
Мұндай молекулалар уақытының басым
көпшілігін еркін қозғалыста өткізеді,
тек кейде бір-біріне немесе өзі орналасқан
ыдыстың қабырға-ларына серпімді
соқтығысады. Газ тепе-теңдік күйде, онда
барлық
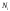 -молекулалар
жылдамдығы бірдей және декарт координнаттар
жүйе-сінің үш осьтері бойымен 1/6 бөлігі
оң бағытта, ал 1/6 бөлігі кері бағытта
қозғалады, Қозғалыс бағыттарының
ықтималдығы бірдей. Ыдыстың қабырғасына
молекула абсолютті серпімді соққан
кезде, ол оған сан мәні өз импульсінің
өзгерісіне тең импульс береді. Бұл
соққылар саны өте көп және ыдыс
қабырғаларының беттерінде бірыңғай
таралады. Сондықтан қабырғаға әсер
ететін үздіксіз күшті ұдайы өндіреді.
Өйткені, механикадан білетініміздей,
Ньютонның екінші заңы бойынша, импульстің
уақытқа байланысты өзгерісі қабырға
бетінің
-молекулалар
жылдамдығы бірдей және декарт координнаттар
жүйе-сінің үш осьтері бойымен 1/6 бөлігі
оң бағытта, ал 1/6 бөлігі кері бағытта
қозғалады, Қозғалыс бағыттарының
ықтималдығы бірдей. Ыдыстың қабырғасына
молекула абсолютті серпімді соққан
кезде, ол оған сан мәні өз импульсінің
өзгерісіне тең импульс береді. Бұл
соққылар саны өте көп және ыдыс
қабырғаларының беттерінде бірыңғай
таралады. Сондықтан қабырғаға әсер
ететін үздіксіз күшті ұдайы өндіреді.
Өйткені, механикадан білетініміздей,
Ньютонның екінші заңы бойынша, импульстің
уақытқа байланысты өзгерісі қабырға
бетінің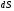 элементіне әсер ететін күшті береді.
Бұл күштің бағыты және шамасы молекулалар
соққылары есебінен қабырғаға импульстің
берілу жылдамдығына тең.Жалпы анықтамасы
бойынша, қысым
элементіне әсер ететін күшті береді.
Бұл күштің бағыты және шамасы молекулалар
соққылары есебінен қабырғаға импульстің
берілу жылдамдығына тең.Жалпы анықтамасы
бойынша, қысым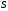 бетке әсер ететін күштіңнормаль
құраушысының
бетке әсер ететін күштіңнормаль
құраушысының
 -ке
қатынасы арқылы анықталады, демек
-ке
қатынасы арқылы анықталады, демек
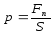 .
Кез келген бетке түсірілген күштің
нормаль компоненті оң таңбалы болады.
Ыдыстың қабырғасының беті газ
молекулаларына қарама-қарсы және тең
күшпен әсер етеді.
.
Кез келген бетке түсірілген күштің
нормаль компоненті оң таңбалы болады.
Ыдыстың қабырғасының беті газ
молекулаларына қарама-қарсы және тең
күшпен әсер етеді.
Ыдыстың қабырғаларына газдың түсіретін қысымы – газдың негізгі қасиеттеріне жатады. Газ осы қысымы арқылы өзінің ыдыстың ішінде болуын байқатады.
Ыдыстың қабырғаларына газдың түсіретін қысымын, XVIII ғ. Д.Бернулли молекулалардың қабырғаға соқтығысып, одан шағылған-дағы берілген уақыт бойынша орташаланған импульсі деп қарастыр-ған. Механика заңдары газдың барлық молекулаларының әсерінен туындаған орташа күшті табуға мүмкіндік береді, демек осы көз-қарасқа сүйеніп газдың қысымын есептеуге болады.
Сонымен,
осы айтылғандарды ескеріп, мысалы
ОХ-осіне
перпен-дикуляр ыдыстың
 қабырғасына түсірілген қысымды анықтайық
(2.3-сурет). Ыдыстағы газ қоспасы
қабырғасына түсірілген қысымды анықтайық
(2.3-сурет). Ыдыстағы газ қоспасы компоненттен құрал-ған, оның толық
массасы
компоненттен құрал-ған, оның толық
массасы және ыдыс көлемінің бірлігіндегі
молекулалар саны
және ыдыс көлемінің бірлігіндегі
молекулалар саны мына түрде анықталады:
мына түрде анықталады:

мұндағы
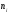 – бірлік көлемдегі
– бірлік көлемдегі компоненттің сандық тығыздығы,
компоненттің сандық тығыздығы, – компоненттің массасы.
– компоненттің массасы.
Әр
 –
компоненттердің молекулаларының
жылдамдығы әр түрлі.
–
компоненттердің молекулаларының
жылдамдығы әр түрлі.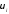 -ох
осі бағытындағы
-ох
осі бағытындағы
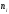 молекулалардың орташа жылдамдығы.
Ыдыстың
молекулалардың орташа жылдамдығы.
Ыдыстың қабырғасыох
осіне
перпендикуляр (2.3-сурет).
қабырғасыох
осіне
перпендикуляр (2.3-сурет).
 –ох
осіне
–ох
осіне
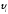 жылдамдық проекциясы (2.4 а-сурет). Мұндағы
жылдамдық проекциясы (2.4 а-сурет). Мұндағы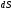 аудан
аудан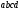 қабырғаның элементі. Қабырғаға соқтыққанға
дейінгі
қабырғаның элементі. Қабырғаға соқтыққанға
дейінгі –молекуланың импульсі
–молекуланың импульсі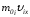 ,
,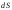 ауданға соқтыққаннан кейін моле-куланың
импульс таңбасы өзгереді, оның себебі
ауданға соқтыққаннан кейін моле-куланың
импульс таңбасы өзгереді, оның себебі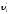 бағыты
бағыты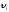 жылдамдық бағытына кері. 2.4 б-суреттеdNi
молекулалар орналасқан цилиндр
көрсетілген, ондағы молекулалар dS
бетті
d
уақытта
қиып өтеді. Бұл цилиндрдің ұзындығы
жылдамдық бағытына кері. 2.4 б-суреттеdNi
молекулалар орналасқан цилиндр
көрсетілген, ондағы молекулалар dS
бетті
d
уақытта
қиып өтеді. Бұл цилиндрдің ұзындығы
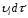 ,
көлемі
,
көлемі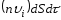 .
. - сыртқы бірлік нормаль (вектор)dS
бетке түсірілген. Соқтығысу серпімді,
сондықтан
- сыртқы бірлік нормаль (вектор)dS
бетке түсірілген. Соқтығысу серпімді,
сондықтан
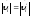 .
Сөйтіп, молекула импульсінің өзгерісі
мынаған тең болады:
.
Сөйтіп, молекула импульсінің өзгерісі
мынаған тең болады: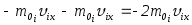 демек
демек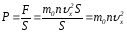 .
.
қолданылады.
Осыған орай (2.28) формулаға кіретін
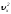 жылдамдық құраушысы оның орташа мәнімен
жылдамдық құраушысы оның орташа мәнімен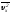 ауыстырылады.Осыған орай,ОХ
бағытында перпендикуляр
ауыстырылады.Осыған орай,ОХ
бағытында перпендикуляр
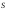 бетке газдың түсір-генp
қысымы (2.9 өрнек) былай анықталады:
бетке газдың түсір-генp
қысымы (2.9 өрнек) былай анықталады:
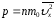 (2.30)Әр молекуланың
(2.30)Әр молекуланың жылдамдығы оның координаттар осьтеріне
қатысты құраушылары арқылы былай
жазылады:
жылдамдығы оның координаттар осьтеріне
қатысты құраушылары арқылы былай
жазылады: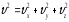 ,сондықтан
,сондықтан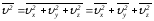 (2.31)Молекулалық қозғалыс хаосты, сол
себептен жылдамдықтардың белгілі
бағыттары анықталуы мүмкін емес,
сондықтан олардың проекцияларының
квадраттарының орташасы бір-біріне тең
болады, демек
(2.31)Молекулалық қозғалыс хаосты, сол
себептен жылдамдықтардың белгілі
бағыттары анықталуы мүмкін емес,
сондықтан олардың проекцияларының
квадраттарының орташасы бір-біріне тең
болады, демек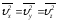 .
Осы айтылғандарды ескеріп, жылдамдықтыңх
құраушысының орташа мәні былай анықталады:
.
Осы айтылғандарды ескеріп, жылдамдықтыңх
құраушысының орташа мәні былай анықталады:
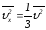 .
(2.32) (2.31)-ші формула бойынша анықталған
.
(2.32) (2.31)-ші формула бойынша анықталған мәнін (2.30)-шы өрнекте алмастырып, өте
маңызды формуланы аламыз:
мәнін (2.30)-шы өрнекте алмастырып, өте
маңызды формуланы аламыз: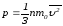 (2.33)Осы (2.33) теңдеу элементармолекула-кинетикалық
теорияның негізгі теңдеуі
деп аталады.(2.33)-тің оң жағын екіге
көбейтіп және бөліп, былай жазамыз:
(2.33)Осы (2.33) теңдеу элементармолекула-кинетикалық
теорияның негізгі теңдеуі
деп аталады.(2.33)-тің оң жағын екіге
көбейтіп және бөліп, былай жазамыз:
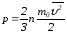 ,
(2.34)мұндағы
,
(2.34)мұндағы
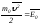 – бір молекуланың орташаланған
кинетикалық энергиясы болады. Онда
қысымды анықтайтын (2.34) өрнек мына түрде
жазылады:
– бір молекуланың орташаланған
кинетикалық энергиясы болады. Онда
қысымды анықтайтын (2.34) өрнек мына түрде
жазылады: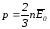 . (2.35)
. (2.35)
Осы (2.35)-ші өрнекті Бернулли теңдеуі деп атайды.
