
- •Введение
- •Лекция 1. Нулевое начало термодинамики
- •1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
- •1.1. Основные определения химической термодинамики
- •1.2. Нулевое начало термодинамики
- •Лекция 2. Первое начало термодинамики. Термохимия.
- •2.1. Внутренняя энергия, теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Применение первого начала термодинамики к химическим реакциям
- •2.4. Термохимия. Закон Гесса
- •2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Лекция 3. Второе начало термодинамики. Энтропия.
- •3.1. Второе начало термодинамики. 3.2. Необратимые процессы. Изменение энтропии в разных процессах. 3.3. Энергии Гиббса и Гельмгольца.
- •3.1. Второе начало термодинамики
- •3.2. Необратимые процессы. Изменение энтропии в разных процессах
- •3.3. Энергии Гиббса и Гельмгольца
- •Лекция 4. Третье начало термодинамики.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
- •4.2. Энтропия и термодинамическая вероятность
- •Лекция 5. Дисперсность и классификация коллоидных систем
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов. 5.2. Дисперсность коллоидных систем. 5.3. Классификация коллоидных систем.
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов
- •5.2. Дисперсность коллоидных систем
- •5.3. Классификация коллоидных систем
- •Лекция 6. Адсорбция
- •6.1. Основные определения. Изотерма адсорбции. 6.2. Уравнение Гиббса. 6.3. Поверхностно-активные вещества. 6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •6.1. Основные определения. Изотерма адсорбции
- •6.2. Уравнение Гиббса
- •6.3. Поверхностно-активные вещества
- •6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •Лекция 7. Электрокинетические свойства коллоидных систем
- •7.1. Виды электрокинетических явлений. 7.2. Двойной электрический слой и ζ-потенциал.
- •7.1. Виды электрокинетических явлений
- •7.2. Двойной электрический слой и ζ-потенциал
- •Литература
- •Содержание
3.2. Необратимые процессы. Изменение энтропии в разных процессах
Получим математическую формулировку второго начала термодинамики для необратимых процессов. Пусть из состояния (1) в состояние (2) система может перейти как посредством необратимого процесса (а), так и обратимого (б) (рис. 3.1). Согласно первому началу термодинамики для необратимого процесса получаем:
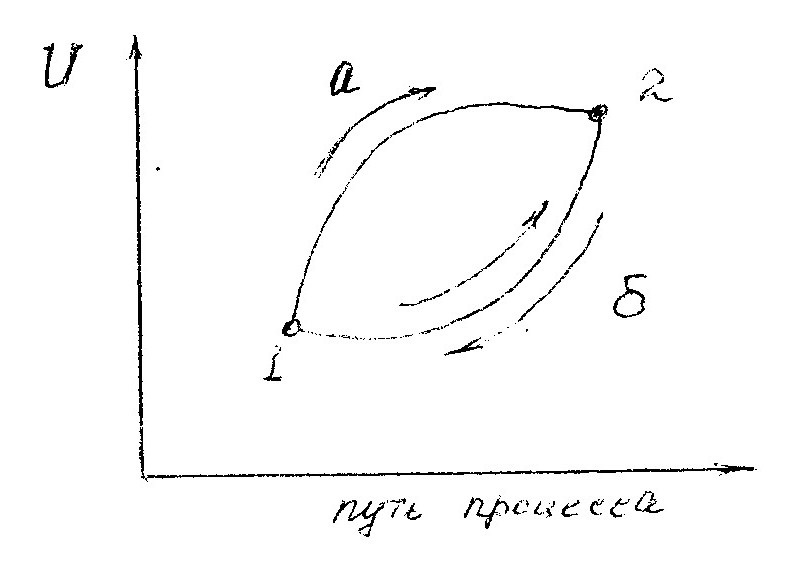
Рис. 3.1
![]() (3.6)
(3.6)
а для обратимого
![]() (3.7)
(3.7)
Вычитая из (3.6) уравнение (3.7), получим для кругового процесса:
![]() (3.8)
(3.8)
Выражение (3.8) может быть равно нулю, больше нуля или меньше нуля. Если оба процесса (прямой и обратный) обратимы, то уравнение (3.8) равно нулю, т.к. после проведения обратимого процесса в прямом и обратном направлениях никаких изменений ни в сомой системе, ни в окружающей среде не происходит.
Если обе части уравнения (3.8) больше нуля, то это означает, что единственным результатом кругового процесса будет поглощение теплоты из окружающей среды и совершение системой эквивалентного количества работы, т.е. полное превращение теплоты в работу, что противоречит второму началу термодинамики (формулировка Томсона). Если обе разности в уравнении (3.8) меньше нуля, то это не противоречит второму началу, потому что единственным результатом будет полное превращение работы в теплоту. Таким образом, непосредственным следствием второго начала являются два неравенства:
![]() или
или
![]()
![]() или
или
![]()
Т.е. работа любого необратимого процесса всегда меньше работы обратимого процесса между теми же начальным и конечным состояниями системы. Поэтому работу в обратимых процессах называют максимальной работой. Чем меньше работа по сравнению с максимальной, тем более необратимый процесс. Процессы, которые происходят без совершения работы, называются полностью необратимыми.
Так как Q в необратимом процессе меньше, чем в обратимом, из уравнения (3.2) получим:
![]() или
или
![]() (3.9)
(3.9)
или
![]() (3.10)
(3.10)
Для необратимых
самопроизвольных процессов в изолированной
системе
![]() и
из (3.9) получаем:
и
из (3.9) получаем:
![]() и
и
![]() (3.11)
(3.11)
Для изотермических необратимых процессов (Т=const)
![]() и
и
![]() (3.12)
(3.12)
Неравенства (3.9) – (3.12) представляют собой выражения второго начала термодинамики для необратимых процессов.
Для необратимых процессов второе начало термодинамики - это закон существования и возрастания энтропии. При протекании необратимого процесса в изолированной системе энтропия возрастает.
Для общего случая обратимых и необратимых процессов можно объединить уравнения (3.2) и (3.9) соотношением:
![]() (3.13)
(3.13)
или
![]()
По данным для необратимых процессов энтропию нельзя вычислить. Но изменение энтропии в обратимом и необратимом процессах одинаково, так как энтропия является функцией состояния. Следовательно, чтобы вычислить изменение энтропии в данном реальном необратимом процессе, нужно этот процесс (мысленно) разбить на стадии, которые проводятся обратимо, и вычислить для них изменения энтропии по уравнениям для обратимых процессов. Просуммировав изменения энтропии всех стадий, получим изменение энтропии в необратимом процессе.
Вычислим изменение энтропии для разных процессов.
1. Для изотермического процесса (Т=const) с любым веществом. Проведем мысленно данный изотермический процесс обратимо и рассчитаем изменение энтропии по уравнению (3.1). Например, для фазового перехода
![]()
где ΔНф.п. – теплота фазового перехода; Т – абсолютная температура фазового перехода. В общем случае обратимого процесса при V=const или P=const:
![]() (V=const
)
(V=const
)
![]() P=const
(3.14)
P=const
(3.14)
2. При нагревании любого вещества от Т1 до Т2 при V=const. В этом случае теплота процесса приобретает свойства функции состояния и определяется изменением внутренней энергии системы, тогда получаем:
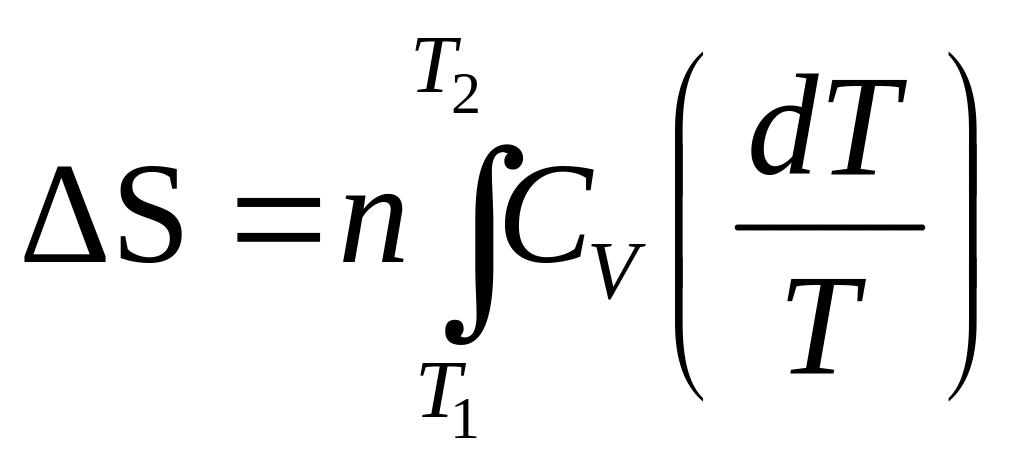
Если принять СV=const, то
![]() (3.15)
(3.15)
3. При нагревании любого вещества при р=const:
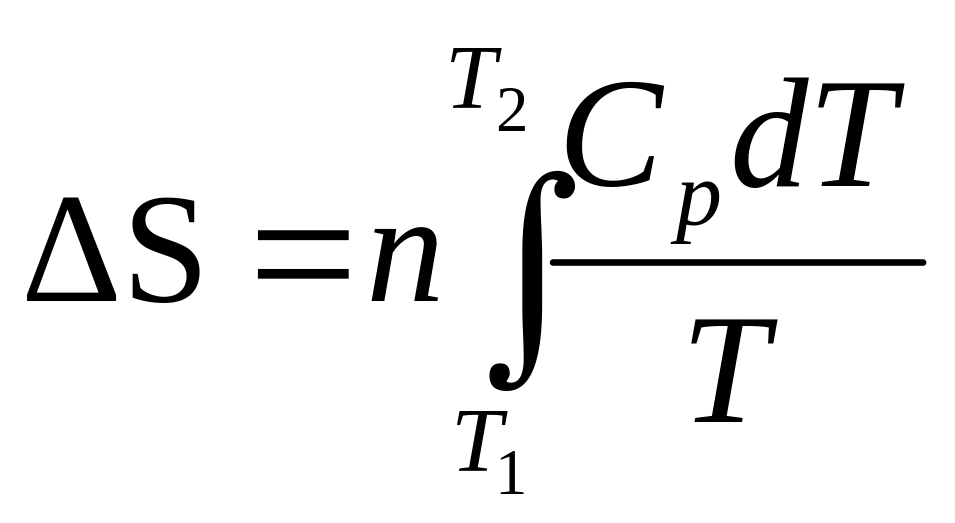
при Ср=const:
![]() (3.16)
(3.16)
При расчетах общего изменения энтропии ΔS сложной изолированной системы (процесс, например, происходит в аппарате, находящемся в контакте с окружающей средой) надо учитывать следующие обстоятельства:
1. Обще изменение энтропии ΔS изолированной системы складывается из двух величин: изменения энтропии в результате происходящего процесса (химической реакции, плавления, испарения, возгонки, перекристаллизации и т.д.) ΔSпр. и изменения энтропии окружающей среды, т.е. теплового источника и приемника теплоты ΔSср.. Таким образом, ΔS = ΔSпр. + ΔSср..
2. При обратимых процессах уменьшение энтропии рабочей части системы, т.е. ΔSпр. равно увеличению энтропии среды, поэтому ΔS=0.
3. При необратимых процессах увеличение энтропии среды ΔSср. больше уменьшения энтропии рабочей части системы ΔSпр., поэтому ΔS>0.
4. Величину ΔSпр. можно вычислить по значениям абсолютных энтропий участников рассматриваемого процесса.
5. Точное вычисление ΔSпр. не всегда осуществимо вследствие неопределенности приемников и источников тепла.
6. Судить о направлении процесса по величине ΔSпр. невозможно. О направлении процесса можно судить только по величине ΔS, определяемой по уравнению ΔS = ΔSпр. + ΔSср..
