
- •Введение
- •Лекция 1. Нулевое начало термодинамики
- •1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
- •1.1. Основные определения химической термодинамики
- •1.2. Нулевое начало термодинамики
- •Лекция 2. Первое начало термодинамики. Термохимия.
- •2.1. Внутренняя энергия, теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Применение первого начала термодинамики к химическим реакциям
- •2.4. Термохимия. Закон Гесса
- •2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Лекция 3. Второе начало термодинамики. Энтропия.
- •3.1. Второе начало термодинамики. 3.2. Необратимые процессы. Изменение энтропии в разных процессах. 3.3. Энергии Гиббса и Гельмгольца.
- •3.1. Второе начало термодинамики
- •3.2. Необратимые процессы. Изменение энтропии в разных процессах
- •3.3. Энергии Гиббса и Гельмгольца
- •Лекция 4. Третье начало термодинамики.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
- •4.2. Энтропия и термодинамическая вероятность
- •Лекция 5. Дисперсность и классификация коллоидных систем
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов. 5.2. Дисперсность коллоидных систем. 5.3. Классификация коллоидных систем.
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов
- •5.2. Дисперсность коллоидных систем
- •5.3. Классификация коллоидных систем
- •Лекция 6. Адсорбция
- •6.1. Основные определения. Изотерма адсорбции. 6.2. Уравнение Гиббса. 6.3. Поверхностно-активные вещества. 6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •6.1. Основные определения. Изотерма адсорбции
- •6.2. Уравнение Гиббса
- •6.3. Поверхностно-активные вещества
- •6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •Лекция 7. Электрокинетические свойства коллоидных систем
- •7.1. Виды электрокинетических явлений. 7.2. Двойной электрический слой и ζ-потенциал.
- •7.1. Виды электрокинетических явлений
- •7.2. Двойной электрический слой и ζ-потенциал
- •Литература
- •Содержание
Лекция 1. Нулевое начало термодинамики
1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
1.1. Основные определения химической термодинамики
Термодинамика изучает законы, описывающие обмен энергией между изучаемой системой и окружающей средой, в частности превращение тепловой энергии в другие формы энергии.
Термодинамика использует термодинамический метод, сущность которого состоит в обобщении опытных данных в виде законов – начал термодинамики (нулевое, первое, второе и третье начала термодинамики). Термодинамический метод применяют к системам, которые состоят из большого количества отдельных частиц, и он позволяет определить лишь возможности рассматриваемых процессов.
Химическая термодинамика применяет положения и законы общей термодинамики к изучению химических явлений. Применение химической термодинамики позволяет рассматривать процесс, не вдаваясь в механизм взаимодействия отдельных составных частей вещества. Зная законы химической термодинамики можно предвидеть, возможна ли данная реакция при данных условиях или невозможна, какие условия необходимо создать, чтобы реакция была возможной и чтобы выход продуктов был максимален.
Для вывода закономерностей химической термодинамики нужно знать начальное и конечное состояния системы, а также внешние условия, при которых протекает процесс (температура, давление и т.п.). Химическая термодинамика не позволяет делать какие-либо выводы о внутреннем строении вещества и механизме протекания процессов. В этом заключается ограниченность термодинамического метода. В химической термодинамике применяются те же понятия, что и в общей термодинамике.
Системой называется отдельное тело или группа тел, находящихся во взаимодействии и обособленных от окружающей среды реальной или воображаемой оболочкой (границей).
Изолированной системой называют такую систему, которая не обменивается теплотой и работой с окружающей средой, т.е. энергия и объем которой постоянны. Если через границу переходят энергия (теплота) и вещество (работа), то система называется открытой, если происходит переход только энергии, система называется закрытой. Теплота может поступать в закрытую систему или выделяться из нее.
Большинство промышленных аппаратов являются открытыми системами (бункеры для сыпучих материалов, теплообменники, наносы смесители и др.). К числу закрытых систем можно отнести, например консервную банку, содержимое которой за счет передачи теплоты может изменять свою температуру в зависимости от температуры окружающей среды. Изолированные системы практически отсутствуют, а примерами таких систем могут служить кабина космического корабля и помещения подводной лодки.
Гомогенной системой называют систему, между частями которой нет поверхностей раздела, т.е. она состоит из одной фазы.
Гетерогенной называют систему, состоящую из различных по свойствам частей, разграниченных поверхностями раздела, т.е. состоящей из двух и более фаз.
Фаза – однородная часть системы, обладающая одинаковым составом, физическими и химическими свойствами и отделенная от других частей поверхностью раздела. Фаза может состоять из одного или нескольких компонентов (если фаза, например раствор). Если рассмотреть стакан кофе (растворимого), то его содержимое является гомогенной системой, состоящей из одной фазы, в состав которой входит несколько компонентов (вода, растворенный в ней кофе и сахар). Если же в стакане вместо растворимого кофе будет молотый, то система будет гетерогенной.
Практически все сырье для производства продуктов питания представляют собой сложную гетерогенную систему. Например, семена и плоды масличных культур содержат до 50% жира и 40% различных белков. Готовые продукты питания, в основном, также представляю собой гетерогенные системы, так хлеб состоит из корки и мякиша, внутри которого содержатся газовые включения.
Состояние системы - совокупность физических и химических свойств, характеризующих эту систему. Состояние термодинамической системы характеризуется термодинамическими параметрами (переменными, функциями).
В таблице 1.1 представлены общепринятые термодинамические параметры.
Шесть параметров, представленных в таблице 1.1 достаточно для описания всех нужных нам термодинамических состояний. Однако, часто при математических операциях с этими параметрами некоторые их комбинации периодически повторяются. В таких случаях обычно вводят новую функцию: внутреннюю энергию - U, энтропию - S, энтальпию - Н, энергии Гиббса (G) и Гельмгольца (А), теплоемкости - Ср, Cv.
Таблица 1.1
Общепринятые термодинамические параметры (переменные, функции)
Параметр (переменная, функция) |
Определяющее уравнение |
Размерность |
давление, Р |
|
Па |
объем, V |
Трехмерное пространство, занимаемой системой |
м3 |
количество вещества, n |
где NA=6∙1023 – постоянная Авогадро |
моль |
температура, Т |
Состояние идеального газа:
Для тройной точки воды: Т=273,16 К |
К |
работа, W |
Работа,
совершаемая системой против внешнего
давления в дифференциальной форме:
|
Дж |
теплота, Q |
Число джоулей (калорий) тепла, перешедших в систему из окружающей среды |
Дж |
Различают интенсивные параметры (или факторы интенсивности) и экстенсивные (или факторы емкости). Интенсивные параметры не зависят от количества вещества в системе. К ним относятся, например, температура Т, давление р и др. Значения интенсивных параметров определяют в каждой точке системы: они могут быть одинаковыми во всей системе или изменяться от точки к точке в пределах одной системы. Экстенсивные параметры зависят от общего количества вещества в системе. К ним относятся объем V, число молей n и др.
Термодинамический процесс – всякое изменение в системе, связанное с изменением хотя бы одного из термодинамических параметров.
Если изменение параметра зависит только от начального и конечного состояний и не зависит от пути процесса, то такой параметр называется функцией состояния, а его бесконечно малое изменение есть полный дифференциал. Например, Т – термодинамическая температура, является функцией состояния, поэтому бесконечно малое изменение Т есть полный дифференциал, пишем dT; W – работа, не является функцией состояния, поэтому бесконечно малое изменение W не является полным дифференциалом, пишем δW.
Для иллюстрации особенностей функций состояния рассмотрим рис. 1
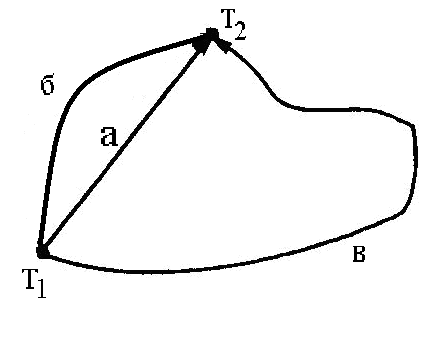
Рис. 1.1. Пути перехода из состояния 1 в состояние 2
Переход из состояния 1 в состояние 2 может быть осуществлен различными путями (на рис. 1 пути перехода обозначены через а, б, в). Состояние 1 характеризуется температурой Т1, а состояние 2 – температурой Т2, т.е. вне зависимости от пути перехода ΔТ = Т2 – Т1 , поэтому Т – функция состояния.
Круговым процессом, или циклом, называется процесс, при котором термодинамическая система, выйдя из некоторого начального состояния и претерпев ряд изменений, возвращается в то же самое состояние; в этом процессе изменение любого параметра состояния равно нулю.
В зависимости от условий протекания различают процессы изобарный (р = const), изотермический (Т = const), изохорный (V = const), изобарно-изотермический (р, Т = const) и др.
В термодинамических системах могут происходить обратимые и необратимые процессы.
Обратимый процесс – процесс, который можно в любой момент заставить протекать в обратном направлении, изменив какой-либо параметр на бесконечно малую величину. Например, при обратимом расширении газа процесс может быть остановлен в любой точке путем бесконечно малого увеличения давления, которое поршень оказывает на газ. Обратимый процесс часто определяют как ряд последовательных состояний равновесия. Такие процессы являются идеализацией реальных процессов; экспериментально к ним можно приблизиться, но никогда нельзя достигнуть. Чтобы провести конечный процесс обратимо нужно бесконечно большое время. Обратимые процессы важны для теории, потому что они дают наибольшую работу, которая может быть вообще получена при данном изменении от состояния 1 до состояния 2. Это как раз то количество работы, которое необходимо, чтобы вернуть систему в исходное состояние. При необратимом процессе равновесие нарушается, работы производится меньше, чем нужно затратить, чтобы вернуть систему в начальное состояние.
Если горячее и холодное тела привести в термический контакт, то теплота переходит от горячего тела к холодному. Этот процесс идет до установления термического равновесия, характеризуемого выравниванием температур обоих тел, и он необратим.
Химическая реакция взаимодействия водорода с кислородом будет необратимой, если ее провести «обычным способом», например, взорвать смесь искрой. Но эта реакция будет обратимой, если ее провести, например, в обратимо работающем электрохимическом элементе.
Некоторые процессы являются истинно необратимыми. Их никаким способом нельзя провести как обратимые. Это такие процессы, единственным результатом которых является превращение работы в теплоту (механическое трение твердых поверхностей, внутренне трение в жидкостях, газах, электрическое сопротивление и т.п.) Во всех необратимых процессах происходит выравнивание в системе давлений, температур, концентраций и других интенсивных параметров, т.е. осуществляется более равномерное распределение энергии и вещества. Необратимые самопроизвольные процессы протекают в направлении, которое приближает систему к состоянию равновесия.
