
- •Введение
- •Лекция 1. Нулевое начало термодинамики
- •1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
- •1.1. Основные определения химической термодинамики
- •1.2. Нулевое начало термодинамики
- •Лекция 2. Первое начало термодинамики. Термохимия.
- •2.1. Внутренняя энергия, теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Применение первого начала термодинамики к химическим реакциям
- •2.4. Термохимия. Закон Гесса
- •2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Лекция 3. Второе начало термодинамики. Энтропия.
- •3.1. Второе начало термодинамики. 3.2. Необратимые процессы. Изменение энтропии в разных процессах. 3.3. Энергии Гиббса и Гельмгольца.
- •3.1. Второе начало термодинамики
- •3.2. Необратимые процессы. Изменение энтропии в разных процессах
- •3.3. Энергии Гиббса и Гельмгольца
- •Лекция 4. Третье начало термодинамики.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
- •4.2. Энтропия и термодинамическая вероятность
- •Лекция 5. Дисперсность и классификация коллоидных систем
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов. 5.2. Дисперсность коллоидных систем. 5.3. Классификация коллоидных систем.
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов
- •5.2. Дисперсность коллоидных систем
- •5.3. Классификация коллоидных систем
- •Лекция 6. Адсорбция
- •6.1. Основные определения. Изотерма адсорбции. 6.2. Уравнение Гиббса. 6.3. Поверхностно-активные вещества. 6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •6.1. Основные определения. Изотерма адсорбции
- •6.2. Уравнение Гиббса
- •6.3. Поверхностно-активные вещества
- •6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •Лекция 7. Электрокинетические свойства коллоидных систем
- •7.1. Виды электрокинетических явлений. 7.2. Двойной электрический слой и ζ-потенциал.
- •7.1. Виды электрокинетических явлений
- •7.2. Двойной электрический слой и ζ-потенциал
- •Литература
- •Содержание
3.3. Энергии Гиббса и Гельмгольца
Многие процессы химической технологии протекают при постоянном давлении и температуре, если они проводятся в открытых аппаратах, или при постоянном объеме и температуре, если они проводятся в закрытых аппаратах, например, в автоклавах. В химической технологии о направлении процесса и равновесии в системе при р=const и T=const судят по энергии Гиббса, а при V=const и T=const - по энергии Гельмгольца. Это связано с тем, что на практике рассмотрение изолированных систем и использование ΔS в качестве критерия равновесия и направления процесса крайне неудобно, так как рассмотрение изолированной системы часто встречает большие затруднения. Но с помощью энтропии можно вычислить энергии Гиббса и Гельмгольца.
Работа процесса в общем случае состоит из полезной работы и механической работы расширения:
δW = δW ' +рdV (3.17)
в обратимом процессе полезная работа имеет наибольшее значение:
δWm = δWm ' +рdV
где Wm ' - максимальная полезная работа;
Wm - максимальная (общая) работа процесса.
Подставляя значение δW из (3.17) в уравнение TdS ≥ dU + δW, получим:
TdS ≥ dU + δW ' + рdV
или
- δW ' ≥ dU- TdS + рdV (3.18)
При постоянном давлении и температуре уравнение (3.18) для обратимого процесса можно представить в виде соотношения:
- δWm ' = d(U-TS+рV) (3.19)
а при V = const и T=const:
- δWm ' = d(U-TS) (3.20)
Обозначим
G = U -TS + рV (3.21)
A = U - TS (3.22)
Учитывая, что Н = U+ рV, получаем:
G = Н -TS ; G = А + рV (3.23)
где G - энергия Гиббса; А - энергия Гельмгольца. Учитывая, что величины U, H, S, р, V, Т - функции состояния, из соотношений (3.22) и (3.23) следует, что G и А также функции состояния.
Подставляя (3.22) и (3.23) в (3.19) и (3.20) получаем:
- dGP,T = δWm '; - ΔGP,T = Wm ' (3.24)
- dAV,T = δWm '; - ΔAV,T = Wm ' (3.25)
При постоянных давлении и температуре уменьшение энергии Гиббса для обратимого процесса равно максимальной полезной работе. При постоянных объеме и температуре уменьшение энергии Гельмгольца при обратимом процессе также равно максимальной полезной работе.
Чтобы выяснить свойства этих функций как критериев направления процесса и равновесия в системе, продифференцируем уравнения (3.21) и (3.22) для G и А, считая все параметры состояния (р, V, Т) переменными:
dG = (dU - TdS + рdV) - SdT + Vdр
dA = (dU - TdS) - SdT
Преобразуя эти уравнения с учетом неравенства (3.18), получаем:
dG ≤ - δW ' - SdT + Vdр (3.26)
dА ≤ - δW ' - SdT - PdV (3.27)
При постоянных давлении и температуре неравенство (3.26) принимает вид:
dGР,Т ≤ - δW ' (3.28)
а при постоянных объеме и температуре:
dА V,T ≤ - δW ' (3.29)
При протекании химической реакции единственным видом работы в большинстве случаев является работа расширения, т.е. δW ' =0, тогда вместо неравенств (3.26) - (3.29) имеем:
dG ≤ - SdT + Vdр (3.30)
dA ≤ -SdT-рdV (3.31)
dGP,T ≤ 0; - ΔGP,T ≤ 0 (3.32)
dAV,T ≤ 0; ΔAV,T ≤ 0 (3.33)
Из неравенств (3.32) и (3.33) видно, что энергия Гиббса системы при постоянных р и Т уменьшается при необратимых процессах и остается постоянной при обратимых процессах. Равновесное состояние системы соответствует минимуму энергии Гиббса; поэтому условием равновесия при постоянных р и Т будет dGP,T = 0.
Энергия Гельмгольца системы при постоянных V и Т уменьшается при необратимых процессах и остается постоянной при обратимых процессах; условие равновесия при постоянных V и Т выражается равенством dAV,T = 0.
Таким образом, энергии Гиббса и Гельмгольца являются критериями направления процесса и равновесия в системе при изобарно-изотермическом к изохорно-изотермическом условиях соответственно.
На рис. 3.2 представлено изменение трех критериев направления процесса и состояния равновесия системы (S, G, А).
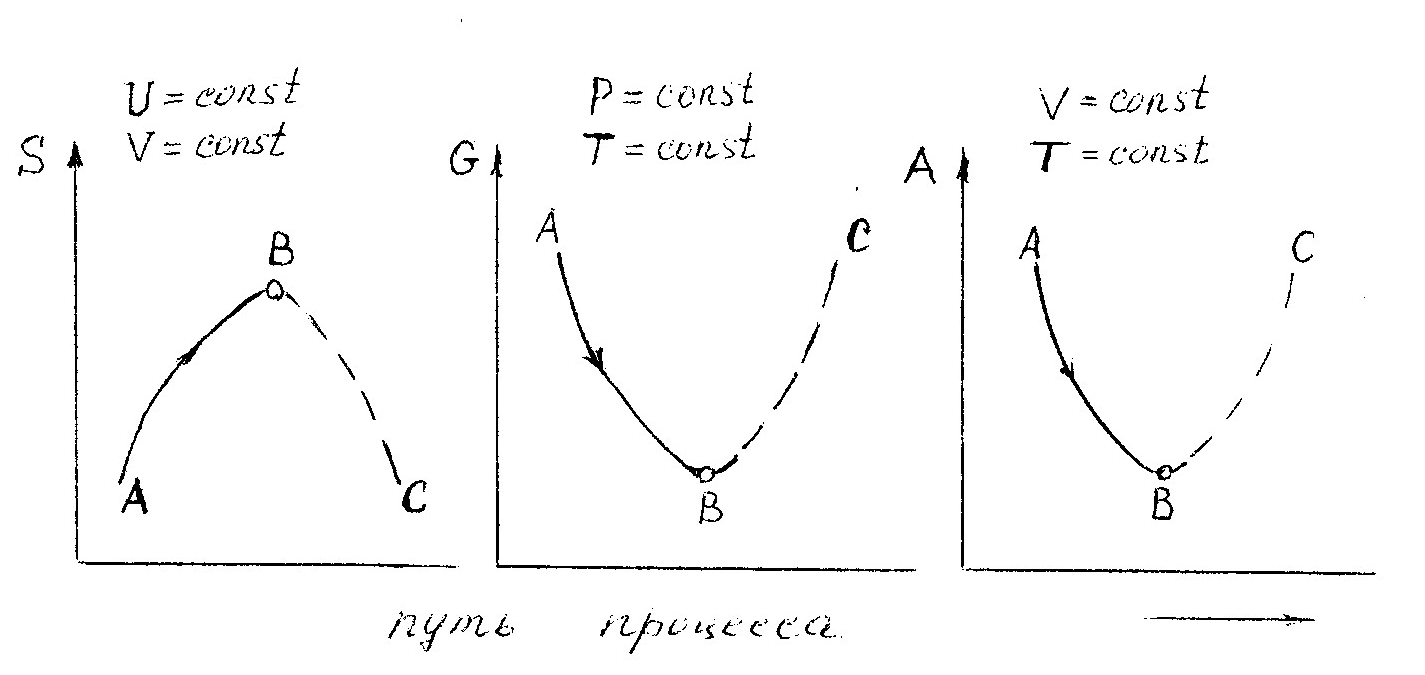
Рис. 3.2
По оси абсцисс отложен "путь процесса", под которым обычно понимают какую-либо величину, которая меняется при протекании процесса и может быть найдена опытным путем. Это может быть, например, изменение концентрации одного из реагентов в ходе реакции. На рис. 3.2 видно, что в состоянии равновесия системы (точка В) все три функции достигают экстремального значения: S - максимума, a G и А - минимума. Линии АВ соответствуют необратимому самопроизвольно идущему процессу, а линии ВС - несамопроизвольному процессу, для осуществления которого системе необходимо сообщить энергию извне.
В двух практически важных случаях полезная работа химической реакции равна нулю:
1) когда реакция проводится полностью необратимым путем;
2) когда система, в которой протекает химическая реакция, находится в состоянии устойчивого равновесия. Для изменения энергии Гельмгольца ΔА при V=const и Т = const:
ΔА = ΔU - TΔS
или учитывая (3.25) и (3.7) , имеем:
ΔU = - δWm ' +Qобр. = ΔА + TΔS (3.34)
Таким образом, изменение внутренней энергии при Т=const для обратимого процесса складывается из свободной энергии ΔА, которая может быть превращена в максимальную полезную работу, и связанной энергии TΔS, которая выделяется или поглощается в виде теплоты.
Так как в основном химические реакции идут в закрытых сосудах (р=const), то для ответа на вопрос пойдет или нет реакция необратимо самопроизвольно рассчитывают ΔG химической реакции. Так как энергия Гиббса является функцией состояния, то ΔG химической реакции можно определить пользуюсь следствием из закона Гесса. Например, для реакции
aA + bB = dD + fF
![]()
где.
![]() – стандартные
энергии Гиббса образования компонентов
А, В, D,
F
из простых веществ (приводятся в
справочниках).
– стандартные
энергии Гиббса образования компонентов
А, В, D,
F
из простых веществ (приводятся в
справочниках).
Если ∆G < 0 – реализуется самопроизвольный процесс в прямом направлении;
Если ∆G = 0 – система находится в динамическом равновесии, т.е. скорость реакции, идущей в прямом направлении равна скорости реакции, идущей в обратном направлении;
Если ∆G > 0 – реализуется самопроизвольный процесс в обратном направлении.
