
- •Введение
- •Лекция 1. Нулевое начало термодинамики
- •1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
- •1.1. Основные определения химической термодинамики
- •1.2. Нулевое начало термодинамики
- •Лекция 2. Первое начало термодинамики. Термохимия.
- •2.1. Внутренняя энергия, теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Применение первого начала термодинамики к химическим реакциям
- •2.4. Термохимия. Закон Гесса
- •2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Лекция 3. Второе начало термодинамики. Энтропия.
- •3.1. Второе начало термодинамики. 3.2. Необратимые процессы. Изменение энтропии в разных процессах. 3.3. Энергии Гиббса и Гельмгольца.
- •3.1. Второе начало термодинамики
- •3.2. Необратимые процессы. Изменение энтропии в разных процессах
- •3.3. Энергии Гиббса и Гельмгольца
- •Лекция 4. Третье начало термодинамики.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
- •4.2. Энтропия и термодинамическая вероятность
- •Лекция 5. Дисперсность и классификация коллоидных систем
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов. 5.2. Дисперсность коллоидных систем. 5.3. Классификация коллоидных систем.
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов
- •5.2. Дисперсность коллоидных систем
- •5.3. Классификация коллоидных систем
- •Лекция 6. Адсорбция
- •6.1. Основные определения. Изотерма адсорбции. 6.2. Уравнение Гиббса. 6.3. Поверхностно-активные вещества. 6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •6.1. Основные определения. Изотерма адсорбции
- •6.2. Уравнение Гиббса
- •6.3. Поверхностно-активные вещества
- •6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •Лекция 7. Электрокинетические свойства коллоидных систем
- •7.1. Виды электрокинетических явлений. 7.2. Двойной электрический слой и ζ-потенциал.
- •7.1. Виды электрокинетических явлений
- •7.2. Двойной электрический слой и ζ-потенциал
- •Литература
- •Содержание
2.2. Первое начало термодинамики
Взаимосвязь между внутренней энергией, работой и теплотой устанавливается на основе первого начала термодинамики. Первое начало термодинамики представляет собой постулат, вытекающий из многовекового опыта человечества.
Многочисленными опытами было показано, что различные виды энергии переходят друг в друга в эквивалентных количествах. В результате обобщенных исследований был открыт и сформулирован закон сохранения энергии, который является одним из важнейших законов природы:
в замкнутой системе сумма всех видов энергии постоянна; при их взаимопревращениях энергия не теряется и не создается.
Этот закон был назван Р. Клаузиусом первым началом термодинамики.
Существует несколько формулировок первого начала термодинамики, которые равноценны друг другу и выражают одну и ту же суть – неуничтожимость и эквивалентность энергии при взаимных переходах различных ее видов друг в друга:
разные формы энергии переходят друг в друга в строго эквивалентных количествах;
в любой изолированной системе запас внутренней энергии остается постоянным;
вечный двигатель первого рода невозможен, т.е. невозможно построить машину, которая давала бы механическую работу, не затрачивая на это соответствующего количества теплоты.
Рассмотрим термодинамическую систему с внутренней энергией U. Простейшая термодинамическая система представляет собой сосуд с газом, в который помещен поршень (рис.2.1).
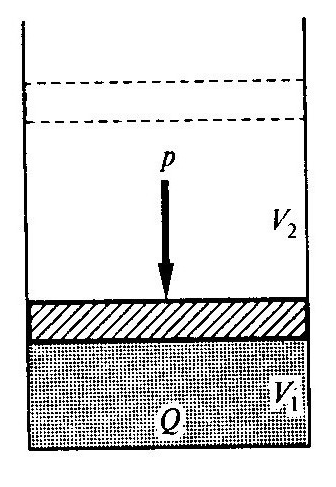
Рис. 2.1. Термодинамическая система
При подводе к сосуду теплоты Q газ нагревается, внутренняя энергия U увеличивается, газ расширяется и поршень поднимается, т.е. объем газа увеличивается от V1 до V2. Значит совершается работа W против внешнего давления.
Условились считать положительной теплоту, полученную системой, и работу, совершенную системой. Тогда формулировка первого начала термодинамики следующая: полученная системой извне теплота Q расходуется на приращение внутренней энергии ΔU и работу W, совершенную системой.
Тогда для конечного изменения состояния системы можно записать:
![]()
или в дифференциальной форме, учитывая, что Q и W не являются функциями состояния,
![]() (2.4)
(2.4)
Уравнение (2.4) – это математическое выражение первого начала термодинамики.
Первое начало термодинамики может быть сформулировано иначе следующим образом: внутренняя энергия является функцией состояния, т. е. ее изменение не зависит от пути процесса, а зависит только от начального и конечного состояния системы.
2.3. Применение первого начала термодинамики к химическим реакциям
Так как для подавляющего большинства химических реакций единственной работой является работа расширения, то уравнение (2.4) примет следующий вид:
![]() (2.5)
(2.5)
Так как химические реакции протекают либо в изобарных (р=const, открытый сосуд), либо в изохорных (V=const, закрытый сосуд) условиях, рассчитаем тепловой эффект таких процессов (изобарного и изохорного). Для этого уравнение (2.5) следует проинтегрировать в пределах от состояний 1 (исходные вещества) до состояния 2 (продукты реакции).
Пусть реакция протекает в закрытом сосуде (изохорные условия), т.е. V=const, тогда dV=0 и слагаемое pdV превращается в ноль, т.е.
![]() ,
(2.6)
,
(2.6)
так как dU – есть полный дифференциал. Таким образом, теплота изохорного процесса равна приращению внутренней энергии системы, а следовательно QV становится функцией состояния.
Теперь рассчитаем тепловой эффект изобарного процесса (реакция идет в закрытом сосуде). Так как р=const, то при интегрировании уравнения (2.5) р можно вынести за знак интеграла. В результате получим:
![]() ,
так как dV
– есть полный дифференциал. После
объединения параметров со значком «2»
и параметров со значком «1» получим:
,
так как dV
– есть полный дифференциал. После
объединения параметров со значком «2»
и параметров со значком «1» получим:
![]() (2.7)
(2.7)
Обозначим U+pV=H и назовем это энтальпия. Так как U, p, V являются функциями состояния, то H тоже является функцией состояния.
Подставим в уравнение (2.7) вместо скобок H2 и H1, получим:
![]() (2.8)
(2.8)
Следовательно Qp становится функцией состояния.
Таким образом тепловой эффект изобарного и изохорного процессов, т.е. процессов характерных для химических реакций, становится функцией состояния.
Для бесконечно малого изменения теплоты в изохорном и изобарном процессах можно записать:
![]() ;
;
![]() (2.9)
(2.9)
Существенное различие между величинами внутренней энергии и энтальпии можно обнаружить только в газообразных системах. В системах, в состав которых входят твердые или жидкие вещества, эти величины имеют практически одинаковое значение.
Эти выводы являются физическим смыслом основного закона термохимии – закона Гесса.
