
- •Введение
- •Лекция 1. Нулевое начало термодинамики
- •1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
- •1.1. Основные определения химической термодинамики
- •1.2. Нулевое начало термодинамики
- •Лекция 2. Первое начало термодинамики. Термохимия.
- •2.1. Внутренняя энергия, теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Применение первого начала термодинамики к химическим реакциям
- •2.4. Термохимия. Закон Гесса
- •2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Лекция 3. Второе начало термодинамики. Энтропия.
- •3.1. Второе начало термодинамики. 3.2. Необратимые процессы. Изменение энтропии в разных процессах. 3.3. Энергии Гиббса и Гельмгольца.
- •3.1. Второе начало термодинамики
- •3.2. Необратимые процессы. Изменение энтропии в разных процессах
- •3.3. Энергии Гиббса и Гельмгольца
- •Лекция 4. Третье начало термодинамики.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
- •4.2. Энтропия и термодинамическая вероятность
- •Лекция 5. Дисперсность и классификация коллоидных систем
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов. 5.2. Дисперсность коллоидных систем. 5.3. Классификация коллоидных систем.
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов
- •5.2. Дисперсность коллоидных систем
- •5.3. Классификация коллоидных систем
- •Лекция 6. Адсорбция
- •6.1. Основные определения. Изотерма адсорбции. 6.2. Уравнение Гиббса. 6.3. Поверхностно-активные вещества. 6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •6.1. Основные определения. Изотерма адсорбции
- •6.2. Уравнение Гиббса
- •6.3. Поверхностно-активные вещества
- •6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •Лекция 7. Электрокинетические свойства коллоидных систем
- •7.1. Виды электрокинетических явлений. 7.2. Двойной электрический слой и ζ-потенциал.
- •7.1. Виды электрокинетических явлений
- •7.2. Двойной электрический слой и ζ-потенциал
- •Литература
- •Содержание
2.4. Термохимия. Закон Гесса
Термохимией называется раздел химической термодинамики, в котором рассматривается применение первого начала (закон Гесса) для вычисления тепловых эффектов различных физико-химических процессов: химических реакций, фазовых переходов, процессов кристаллизации, растворения и др. Для практики наибольший интерес имеют термохимические расчеты теплового эффекта химической реакции.
Тепловым эффектом химической реакция называется количество теплоты, которое выделяется или поглощается при химической реакции. Данное определение верно при соблюдении следующих условий:
1. Объём или давление постоянны (р=const или V=const).
2. Единственной работой является работа расширения.
3. Температуры продуктов реакции и исходных веществ равны.
Тепловые эффекты химической реакции при V = const и p = const:
![]() ;
;
![]()
В эндотермических реакциях теплота поглощается и, в соответствии с общими правилами знаков для переданной теплоты, значения ΔU или ΔН положительны.
В экзотермических реакциях теплота выделяется, и значения ΔU или ΔН отрицательны.
В термохимии часто используются термохимическими уравнениями, т.е. уравнениями химической реакции, в которых указан тепловой эффект и агрегатные состояния реагирующих веществ.
В качестве примера термохимической реакции можно привести реакцию спиртового брожения глюкозы, которая является одной из основных реакций в винодельческой технологии:
C6H12O6 (т) → C2H5OH (ж) + 2CO2 (г); ΔН=-71,56 кДж/моль
где ΔН – тепловой эффект реакции в изобарно-изотермических условиях;
т, ж, г – соответственно твердое, жидкое, газообразное агрегатные состояние.
В 1840 г. Г.И. Гесс описал закон, получивший его имя и являющийся основным законом термохимии. Закон Гесса устанавливает, что если из данных исходных веществ можно различными путями получить заданные конечные продукты реакции, то независимо от путей получения, т.е. от вида промежуточных реакций, суммарный тепловой эффект для всех путей будет одним и тем же.
Иначе говоря, тепловой эффект химических реакций зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Приемы использования закона Гесса при расчете тепловых эффектов реакций можно рассмотреть на примере реакции окисления железа.
Железо, реагируя с кислородом, может образовать оксид железа (III):
2Fe (т) +
![]() О2(г)
→ Fe2О3
(т), ΔН = -821 кДж
О2(г)
→ Fe2О3
(т), ΔН = -821 кДж
Эта же реакция может осуществляться другим путем с образованием промежуточного продукта - оксида железа (II):
2Fe (т) + О2(г) → 2FeО (т), ΔН2 = -527 кДж
2FeO (т) +
![]() О2
(г) → Fe2O3
(т), ΔН3
= -294 кДж
О2
(г) → Fe2O3
(т), ΔН3
= -294 кДж
Все эти реакции протекают при р = const, причем начальные и конечные состояния (температура, агрегатное состояние и др.) для них одинаковы. При помощи закона Гесса можно определить тепловой эффект одной из этих реакций (например, первой), если известны тепловые эффекты двух других реакций. Для этого используют два приема.
Алгебраическое сложение термохимических уравнений.
После алгебраического сложения уравнений второй и третьей реакций и сокращения одинаковых слагаемых получим:
2Fe (т) + О2(г) → Fe2О3 (т), ΔН2 + ΔН3
Полученное уравнение совпадает с первым. Отсюда в соответствии с законом Гесса получаем:
ΔН2 + ΔН3 = ΔН1
Действительно, ΔН2 + ΔН3 = -527 + (-294) = -821 кДж, что совпадает со значением ΔН1= -821 кДж.
2. Составление термохимических схем.
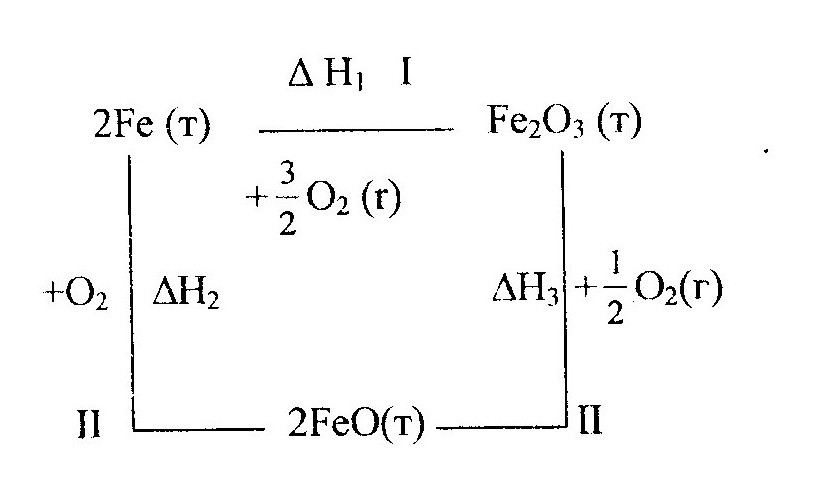
Тепловой эффект первой реакции по первому пути (I) равен сумме тепловых эффектов второй и третьей реакции по второму пути (II).
Термохимия позволяет вычислять тепловые эффекты процессов, для которых отсутствуют экспериментальные данные. Это относится не только к химическим реакциям, но и к процессам растворения, испарения, сублимации, кристаллизации и др. Большое практическое значение имеют расчеты тепловых эффектов химических реакций по теплотам образования и сгорания, которые можно найти в справочниках.
Теплотой образования называют тепловой эффект при образовании из простых веществ, одного моля соединения. При этом теплота образования простых веществ (N2, H2, О2 и др.) принимается равной нулю. Стандартные теплоты образования вычисляются при стандартных условиях: 298 К и 0,1013 МПа (1атм). Простые вещества рассматриваются в том агрегатном состоянии и в той модификации, в каких они устойчивы при стандартных условиях. Например, стандартная теплота образования карбоната кальция - это тепловой эффект реакции:
Са (т) + С (графит)
+1,5 О2
(г) = СаСО3
(т),
![]() = -1206 кДж
= -1206 кДж
По сравнительно небольшому числу стандартных теплот образования можно вычислить тепловые эффекты многих химических реакций. При этом пользуются первым следствием, которое вытекает из закона Гесса: тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэфициентов:
![]() (2.10)
(2.10)
где ΔН0 – тепловой эффект реакции при стандартных условиях;
νпр.-стехиометрические коэффициенты продуктов реакции;
νисх.-стехиометрические коэффициенты исходных веществ
Например, для реакции типа
aA + bB = dD + fF
тепловой эффект согласно первому следствию из закона Гесса будет:
![]()
Тепловые эффекты химических реакций с участием органических соединений удобно вычислять по теплотам сгорания, которые легко определяются из опыта.
Теплотой сгорания называется тепловой эффект при постоянном давлении реакции окисления кислородом одного моля химического соединения с образованием продуктов сгорания. В качестве продуктов сгорания элементов С, Н, N, S, и С1 принимают СО2, Н2О (ж), SО2(г), N2(г),HCl(г).
В таблице даются теплоты сгорания при стандартных условиях (298 К и 0,1013 МПа). Например, стандартная теплота сгорания анилина представляет собой тепловой эффект реакции (при 298 К и 0,1013 МПа):
C6Н5NH2(ж)
+
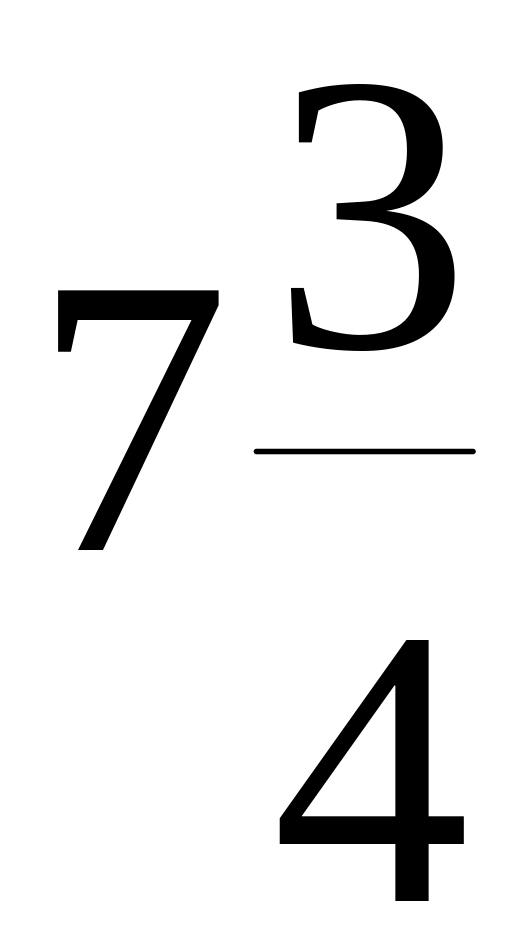 О2(г)
→ 6СО2(г)
+
О2(г)
→ 6СО2(г)
+
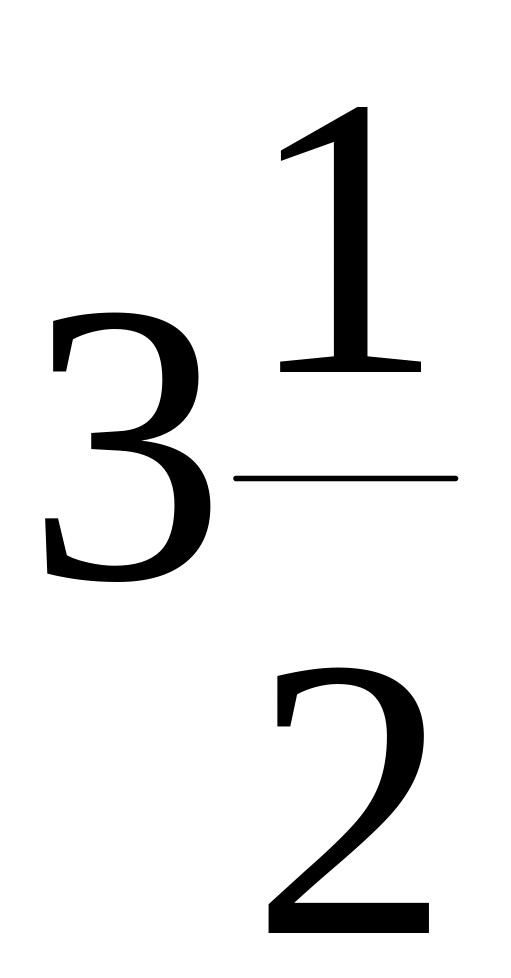 Н2О(ж)
+
Н2О(ж)
+![]() N2,
N2,
![]() =
- 396 кДж/моль
=
- 396 кДж/моль
Вычисление теплового эффекта реакции по теплотам сгорания производится по второму следствию, вытекающему из закона Гесса: тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэфициентов:
![]() (2.11)
(2.11)
Так для реакции типа
aA + bB = dD + fF
тепловой эффект согласно второму следствию из закона Гесса будет:
![]()
