
- •Введение
- •Лекция 1. Нулевое начало термодинамики
- •1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
- •1.1. Основные определения химической термодинамики
- •1.2. Нулевое начало термодинамики
- •Лекция 2. Первое начало термодинамики. Термохимия.
- •2.1. Внутренняя энергия, теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Применение первого начала термодинамики к химическим реакциям
- •2.4. Термохимия. Закон Гесса
- •2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Лекция 3. Второе начало термодинамики. Энтропия.
- •3.1. Второе начало термодинамики. 3.2. Необратимые процессы. Изменение энтропии в разных процессах. 3.3. Энергии Гиббса и Гельмгольца.
- •3.1. Второе начало термодинамики
- •3.2. Необратимые процессы. Изменение энтропии в разных процессах
- •3.3. Энергии Гиббса и Гельмгольца
- •Лекция 4. Третье начало термодинамики.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
- •4.2. Энтропия и термодинамическая вероятность
- •Лекция 5. Дисперсность и классификация коллоидных систем
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов. 5.2. Дисперсность коллоидных систем. 5.3. Классификация коллоидных систем.
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов
- •5.2. Дисперсность коллоидных систем
- •5.3. Классификация коллоидных систем
- •Лекция 6. Адсорбция
- •6.1. Основные определения. Изотерма адсорбции. 6.2. Уравнение Гиббса. 6.3. Поверхностно-активные вещества. 6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •6.1. Основные определения. Изотерма адсорбции
- •6.2. Уравнение Гиббса
- •6.3. Поверхностно-активные вещества
- •6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •Лекция 7. Электрокинетические свойства коллоидных систем
- •7.1. Виды электрокинетических явлений. 7.2. Двойной электрический слой и ζ-потенциал.
- •7.1. Виды электрокинетических явлений
- •7.2. Двойной электрический слой и ζ-потенциал
- •Литература
- •Содержание
2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
При термохимических и термодинамических расчетах используются теплоемкости газообразных, твердых, жидких тел. Теплоемкостью называют количество теплоты, необходимое для повышения температуры системы на 1 К. Различают удельную и молярную теплоемкости.
Удельной теплоемкостью (с) называется количество теплоты, необходимое для нагревания единицы массы вещества на 1 K.
Молярной теплоемкостью (С) количество теплоты, необходимое для нагревания одного моля вещества на 1К.
При физико-химических и термодинамических расчетах, как правило, пользуются молярной теплоемкостью. В зависимости от условий нагревания или охлаждения вещества различают теплоемкость при постоянном объеме (СV) и теплоемкость при постоянном давлении (СР).
Различают истинную и среднюю теплоемкости. Истинной молярной теплоемкостью называют отношение бесконечно малого количества теплоты, которое нужно подвести к одному молю вещества, к бесконечно малому приращению температуры, которое при этом наблюдается.
![]() , Дж/(моль∙К)
, Дж/(моль∙К)
Средней молярной
теплоемкостью
(![]() )
в интервале температур от Т1
до Т2
называют отношение конечного количества
теплоты, подведенного к одному молю
вещества, к разности температур Т2
- Т1:
)
в интервале температур от Т1
до Т2
называют отношение конечного количества
теплоты, подведенного к одному молю
вещества, к разности температур Т2
- Т1:
![]()
Для изохорного и изобарного процессов согласно уравнению (2.9) следует:
![]() ;
;
![]() (2.12)
(2.12)
Если постоянство объема или давления указано, то частную производную по температуре можно заменить полной производной и написать (для n молей вещества):
при
V= const
![]()
при
Р
= const
![]()
или в интегральной форме:
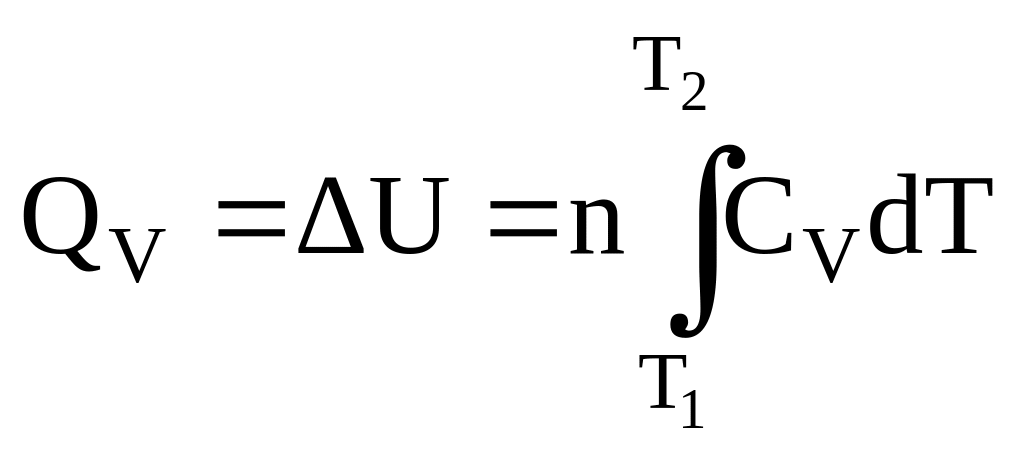
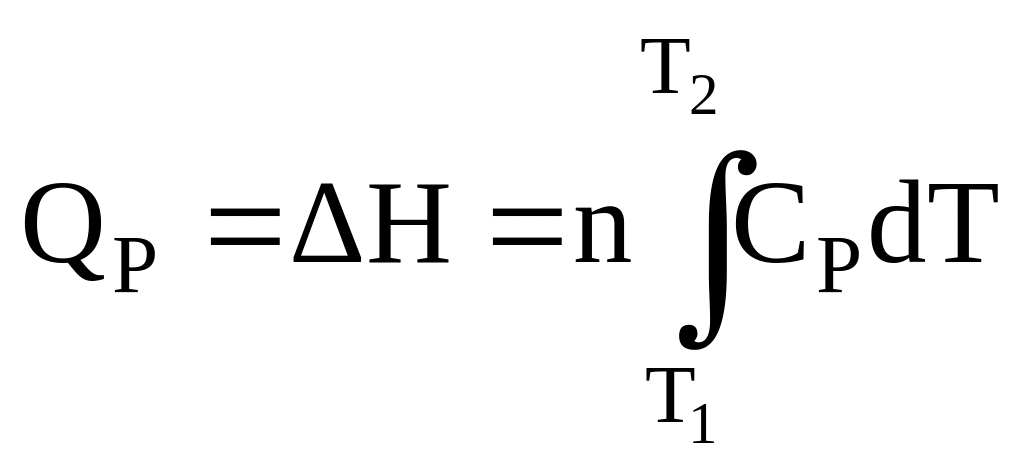
Если теплоемкость в рассматриваемом интервале температур можно считать приближенно постоянной, то, интегрируя, получаем:
![]() ;
;
![]() (2.13)
(2.13)
СР всегда больше CV, так как нагревание вещества при постоянном давлении сопровождается работой расширения. Для твердых и жидких тел разность СР - CV мала, так как их объем почти не меняется от температуры. Для газов разность СР - CV достаточно велика и ее надо учитывать. Для идеальных газов, учитывая, что их внутренняя энергия не зависит от объема и давления:
СР - CV = R = 8,314 Дж/(моль∙К) (2.14)
Рассмотрим
зависимость теплоты процесса при р
= const от
температуры. Возьмем частную производную
по температуре от теплоты процесса ΔН
при р = const
или от
теплоты
процесса ΔU
при V
= const
учитывая, (2.12) и свойство коммутативности
операторов Δ и
![]() ,
т.е.
,
т.е.
![]() ,
[действительно
,
[действительно
![]() ]:
]:
![]()
![]()
Отсюда получаем:
![]() ;
;
![]() (2.15)
(2.15)
где ΔCp и ΔCV – изменения молярной теплоемкости в результате протекания процесса при р = const или V = const.
Уравнения (2.15) называют уравнениями Кирхгофа; из них следует, что температурный коэффициент процесса (теплового эффекта реакции, фазового перехода и т.п.) равен изменению теплоемкости в результате протекания этого процесса.
Для химической реакции типа
aA + bB = dD + fF
изменение теплоемкости ΔCp определяется выражением:
![]()
или
![]()
где
![]() и
и![]() –
сумма теплоемкостей продуктов реакции
и исходных веществ с учетом стехиометрических
коэффициентов.
–
сумма теплоемкостей продуктов реакции
и исходных веществ с учетом стехиометрических
коэффициентов.
Из уравнения (2.15) следует, что если изменение теплоемкости ΔCp во время процесса положительно, то и тепловой эффект с ростом температуры становится более положительным:
при ΔCp
> 0
![]()
и наоборот
при ΔCp
< 0
![]()
Если теплоемкость во время процесса не меняется, т.е. сумма теплоемкостей продуктов реакции равна сумме теплоемкостей исходных веществ, то тепловой эффект процесса не зависит от температуры:
при ΔCp
= 0
![]() и ΔН = const.
и ΔН = const.
Если известен тепловой эффект процесса при стандартных условиях (рассчитывается по следствиям из закона Гесса) ΔН0 при Т0 = 298.15 К, то для вычисления теплового эффекта процесса ΔН2 при Т2 уравнение Кирхгофа (2.15) нужно проинтегрировать в пределах от Т0 до Т2:
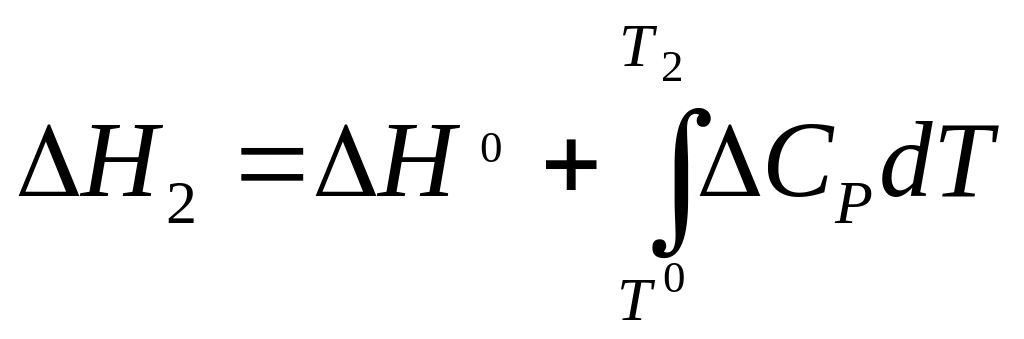
Для простейшего случая можно пренебречь изменением самих теплоемкостей с температурой (например, когда расчет производится для небольшого интервала температур) и рассматривать ΔCp = const, тогда
ΔН2 = ΔН0 + ΔCp (Т2 – Т0) (2.16)
При необходимости учесть изменения самих теплоемкостей с температурой до интегрирования подставляют выражения Cp или CV как функции температуры, пользуясь обычно приближенными эмпирическими уравнениями.
