
- •Введение
- •Лекция 1. Нулевое начало термодинамики
- •1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
- •1.1. Основные определения химической термодинамики
- •1.2. Нулевое начало термодинамики
- •Лекция 2. Первое начало термодинамики. Термохимия.
- •2.1. Внутренняя энергия, теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Применение первого начала термодинамики к химическим реакциям
- •2.4. Термохимия. Закон Гесса
- •2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Лекция 3. Второе начало термодинамики. Энтропия.
- •3.1. Второе начало термодинамики. 3.2. Необратимые процессы. Изменение энтропии в разных процессах. 3.3. Энергии Гиббса и Гельмгольца.
- •3.1. Второе начало термодинамики
- •3.2. Необратимые процессы. Изменение энтропии в разных процессах
- •3.3. Энергии Гиббса и Гельмгольца
- •Лекция 4. Третье начало термодинамики.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
- •4.2. Энтропия и термодинамическая вероятность
- •Лекция 5. Дисперсность и классификация коллоидных систем
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов. 5.2. Дисперсность коллоидных систем. 5.3. Классификация коллоидных систем.
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов
- •5.2. Дисперсность коллоидных систем
- •5.3. Классификация коллоидных систем
- •Лекция 6. Адсорбция
- •6.1. Основные определения. Изотерма адсорбции. 6.2. Уравнение Гиббса. 6.3. Поверхностно-активные вещества. 6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •6.1. Основные определения. Изотерма адсорбции
- •6.2. Уравнение Гиббса
- •6.3. Поверхностно-активные вещества
- •6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •Лекция 7. Электрокинетические свойства коллоидных систем
- •7.1. Виды электрокинетических явлений. 7.2. Двойной электрический слой и ζ-потенциал.
- •7.1. Виды электрокинетических явлений
- •7.2. Двойной электрический слой и ζ-потенциал
- •Литература
- •Содержание
Лекция 4. Третье начало термодинамики.
4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
Химическая термодинамика позволяет рассчитывать константы равновесия реакции без проведения опытов по изучению равновесия в рассматриваемой смеси реагентов. Для такого расчета нужно знать абсолютные значения энтропии химических соединений, участвующих в реакции. Подставляя в выражение для энергии Гиббса G = H - TS энтальпию Н и энтропию S, в виде Н = Н0 + H* и S = S0 + S*
получаем G = (Н0 + H*) - T(S0 + S*) ,
где Н0 и S0 - энтальпия и энтропия при абсолютном нуле; Н* и S* - разность между энтальпией или энтропией при данной температуре и абсолютном нуле. Учитывая, что Н0 и S0 от температуры не зависят, имеем
dG = dH* - TdS* - (S0 + S*)dT (4.1)
Поэтому, как следует из уравнения (4.1), при термодинамических расчетах зависимости энергии Гиббса от температуры нужно знать энтропию при абсолютном нуле.
Планк (1912) предположил, что энтропия индивидуального кристаллического вещества в виде идеального твердого тела при абсолютном нуле равна нулю (постулат Планка).
Идеальным твердым телом называется твердое вещество с идеальной кристаллической решеткой, в которой все узлы заняты атомами или молекулами. Для твердых растворов и стеклообразных веществ энтропия при абсолютном нуле не равна нулю. В математической форме постулат Планка записывается следующим образом:
При T
= 0 S0
= 0;
![]() (4.2)
(4.2)
Следовательно, с
учетом постулата Планка абсолютная
энтропия одного моля какого-либо
газообразного вещества при температуре
Т будет равна сумме изменений энтропии
при переходе вещества из одного
агрегатного состояния в другое и при
нагревании твердого, жидкого и
газообразного веществ от абсолютного
нуля до Т. В соответствии с формулами
![]()
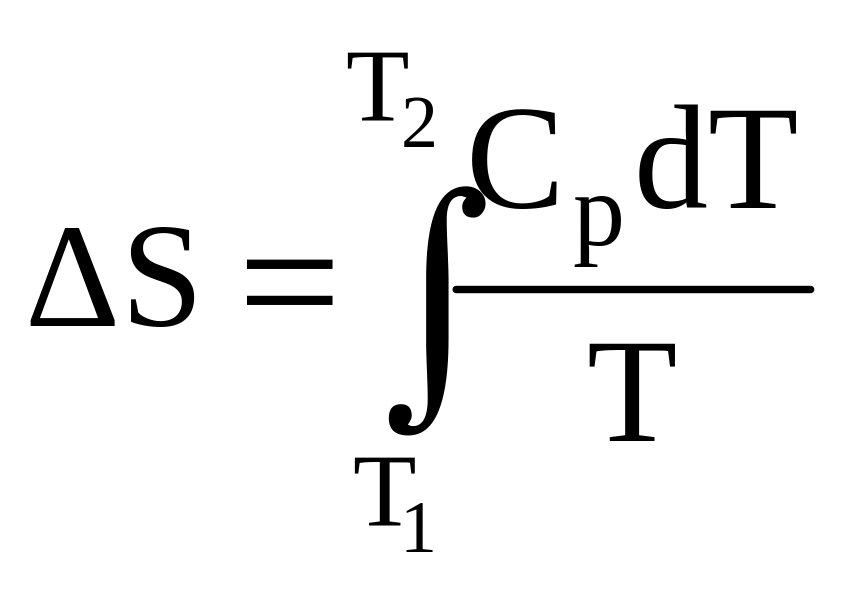 и (4.2) можно записать:
и (4.2) можно записать:
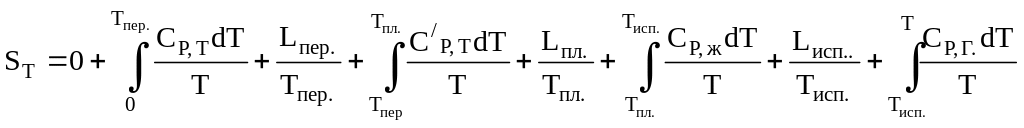 (4.3)
(4.3)
где Lпер.,Tпер. - теплота и температура полиморфного превращения; Lпл.,Tпл. - теплота и температура плавления; Lисп.,Tисп. - теплота и температуры испарения; СР,Т, С/Р,Т - молярная теплоемкость двух полиморфных модификаций; СР,Ж, СР,Г - молярные теплоемкости жидкого и газообразного состояний вещества.
Из постулата Планка вытекает ряд следствий.
1 . Для абсолютной энтропии идеального твердого тела получаем:
![]() (4.4)
(4.4)
2. Из (4.4) следует, что при приближении к абсолютному нулю теплоемкость идеального твердого тела также стремится к нулю:
![]()
так как иначе при Т = 0 выражение под интегралом в (4.4) обратилось бы в бесконечность, а согласно постулату Планка при Т → 0 энтропия должна стремиться к нулю. Следовательно, при Т = 0 также и СР = 0, т. е. никакие процессы не могут снизить температуру до абсолютного нуля - принцип недостижимости абсолютного нуля.
Это связано с тем, что теплоемкости всех веществ при приближении к абсолютному нулю становятся бесконечно малыми, в связи с чем невозможно с помощью конечного числа операций понизить температуру до абсолютного нуля. В настоящее время достигнута температура около 10-5 К.
Принцип недостижимости абсолютного нуля температуры связан с тепловой теоремой Нернста (1906 г.), называемой также третьим началом термодинамики. Сопоставление экспериментальных величин ΔН и ΔG для реакций, протекающих в конденсированных системах, показывает, что в области низких температур при приближении к абсолютному нулю значения ΔН и ΔG сближаются. Нернст постулирует в своей теореме следующее утверждение: вблизи абсолютного нуля закономерны равенства
![]() и
и
![]() ,
,
которые и являются
математическим выражением третьего
начала термодинамики. Из уравнений
Нернста в соответствии с
![]() следует, что вблизи абсолютного нуля
все реакции, совершающиеся в конденсированных
системах, не сопровождаются изменением
энтропии, т. е. для них ΔS=0.
Планк, расширяя этот вывод, сформулировал
свой постулат (4.2), позволивший вычислять
абсолютные энтропии веществ при любой
температуре. Тепловую теорему Нернста,
т. е. третье начало термодинамики, можно
считать следствием постулата Планка,
который является более широким
термодинамическим обобщением.
следует, что вблизи абсолютного нуля
все реакции, совершающиеся в конденсированных
системах, не сопровождаются изменением
энтропии, т. е. для них ΔS=0.
Планк, расширяя этот вывод, сформулировал
свой постулат (4.2), позволивший вычислять
абсолютные энтропии веществ при любой
температуре. Тепловую теорему Нернста,
т. е. третье начало термодинамики, можно
считать следствием постулата Планка,
который является более широким
термодинамическим обобщением.
