- •Химическая Кинетика, равновесия, термодинамика
- •1. Основные понятия кинетики [1, § 57; 2, § 6.2, 6.2.1]
- •1.1. Химическая кинетика
- •1.2. Понятие скорости реакции
- •2. Зависимость скорости гомогенной реакции
- •2.3. Лабораторная работа: определение порядка реакции тиосульфата натрия с кислотой в растворе
- •2.3.1. Постановка задачи
- •2.3.2. Зависимость скорости реакции от концентрации ионов водорода
- •2.3.3. Зависимость скорости реакции от концентрации ионов тиосульфата
- •3. Зависимость скорости реакции от температуры
- •3.3. Лабораторная работа: влияние температуры на скорость реакции
- •4. Катализ [1, § 60; 2, § 6.2.6]
- •5. Особенности кинетики гетерогенных реакций [1, § 61; 2, § 6.2.4]
- •5.1. Общие сведения
- •5.3. Реакции, лимитируемые химическим взаимодействием
- •5.4. Реакции, лимитируемые диффузией в растворе реагента
- •5.5. Реакции, лимитируемые образованием зародышей новой фазы
- •5.6. Демонстрационные опыты
- •6. Обзор факторов, влияющих на скорость
- •7. Общие сведения о Химическом равновесии [1, § 63; 2, § 6.2.8]
- •7.1. Истинное и ложное равновесия
- •7.2. Закон действующих масс (здм) для равновесия
- •7.3. Стандартные состояния веществ и стандартное представление
- •8. Частные случаи констант равновесия
- •8.1. Гомогенные равновесия в растворах электролитов
- •8.2. Гетерогенные равновесия
- •8.3. Квазихимические равновесия в кристаллах
- •9. Факторы, влияющие на смещение равновесия.
- •9.2. Влияние концентрации
- •9.3. Влияние разбавления раствора
- •9.4. Влияние давления
- •9.5. Влияние температуры
- •9.6. Факторы, влияющие на кинетику, но не на равновесие
- •9.7. Выбор оптимальных условий проведения реакций
- •10. Задачи и упражнения по химическому равновесию
- •11. Лабораторная работа по химическому равновесию
- •11.1. Прогноз направления реакций и его экспериментальная проверка
- •11.2. Влияние температуры и концентраций на химическое равновесие
- •12. Введение в химическую термодинамику.
- •12.1. Общие сведения
- •12.2. Первое начало термодинамики. Энтальпия
- •12.3. Закон Гесса и стандартные теплоты образования веществ
- •12.4. Ещё три следствия из закона Гесса
- •13. Направление процессов.
- •13.1. Второе начало термодинамики. Энтропия.
- •13.2. Критерии самопроизвольного протекания процессов
- •13.3. Связь между стандартным изменением энергии Гиббса и константой равновесия
- •13.4. Задачи и упражнения по термодинамике
9. Факторы, влияющие на смещение равновесия.
Принцип Ле Шателье [1, § 64; § 6.2.9]
9.1. Смещение равновесия – это изменение состояния равновесия (изменение равновесного соотношения количеств исходных веществ и продуктов) при изменении условий. Качественно это описывается хорошо известным принципом Ле Шателье:
Если система находится в равновесии, то при изменении какого-либо из параметров равновесия (температуры, давления, концентрации) состояние изменяется в таком направлении, чтобы ослабить внесенное изменение. Это самая общая формулировка, а теперь рассмотрим ее частные, более конкретные варианты. При этом постараемся избегать выражений «вправо», «влево», «продукты», «исходные вещества», «прямая реакция», «обратная реакция» т.к. они условны, зависят от способа записи уравнения, а пока уравнение не записано, они не имеют смысла. Обсуждая влияние какого–то параметра, мы, естественно, предполагаем, что все прочие параметры неизменны.
Попутно заметим, что в формулировке этого принципа фраза «какое-либо воздействие» [1, 2] вместо «изменение какого-либо из параметров равновесия» может приводить к ошибкам. Воздействием является, например, введение дополнительного количества твёрдого реагента, введение инертного вещества, освещение, но не следует думать, что от этого начнётся расходование этого твёрдого реагента или инертного вещества или поглощение света. Указанные «воздействия» не меняют параметры равновесия и не влияют на него.
9.2. Влияние концентрации
При возрастании концентрации какого-то из веществ (исходных или продуктов) равновесие смещается в сторону его расходования, а при уменьшении концентрации – в сторону его образования. Это непосредственно следует из закона действия масс. Если существует равновесие aA + bB = xX + yY, то справедливо равенство
[X]0x[Y]0y / ([A]0a[B]0b) = K,
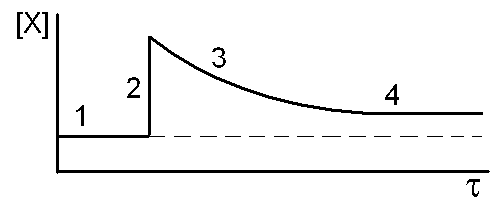
где нижний индекс ноль соответствует равновесному состоянию. Допустим, мы растворили без изменения объёма добавочное количество вещества Х, так что его концентрация стала выше, а остальные концентрации пока не изменились (момент 2 на рис. 4).
Тогда дробь стала больше константы равновесия, то есть равновесие нарушилось. Чтобы его восстановить, дробь должна уменьшиться. Ускоряется обратный процесс, реакция идет так, чтобы концентрации в числителе уменьшились, а в знаменателе увеличились. Рано или поздно дробь возвращается к исходному значению, то есть устанавливается новое равновесие с новыми концентрациями (помечены индексом 1): [X]1 > [X]0, [Y]1 < [Y]0, [A]1 > [A]0, [B]1 > [B]0.
|
Рис. 4. Схема изменения концентрации вещества Х во времени:
|
Можно ли в формулировке правила заменить “возрастание концентрации вещества” на “добавление вещества”? Нет, это может привести к ошибкам. Добавка вещества не всегда ведет к возрастанию его концентрации. Если вещество составляет отдельную твердую или жидкую фазу, то его концентрация постоянна и не подставляется в выражение закона действия масс, а автоматически учитывается в величине К. Поэтому добавка новых кусков твердой фазы не меняет концентраций и не смещает равновесия. Но даже если вещество растворимо, то не всякая его добавка ведет к росту его концентрации. Пример из практикума.
Студент: Что–то у меня реакция не идет.
Преподаватель: Там нужна высокая концентрация кислоты; добавьте еще.
Студент подливает из банки с надписью 0,1 М HCl. Естественно, от этого концентрация кислоты скорее понизится, т.к. в исходной смеси она, вероятно, была выше 0,1 М.