
- •Инструментальные методы анализа
- •1. Введение 2
- •2. Классификация инструментальных методов анализа 3
- •3. Электрохимические методы анализа 16
- •Введение
- •Классификация инструментальных методов анализа
- •Основные характеристики аналитических методов
- •Характеристики наиболее распространенных инструментальных методов анализа
- •Критерии оценки правильности результатов аналитических измерений
- •Метрологические характеристики аналитических методов
- •Статистическая обработка результатов анализа
- •Оценка пригодности экспериментальных данных
- •Доверительные интервалы и оценка их величины
- •Интерпретация результатов анализа
- •Расчет и статистическая оценка параметров градуировочного графика
- •Коридор ошибок
- •Преобразование функций к линейному виду.
- •Электрохимические методы анализа
- •Теоретические основы
- •Электрохимические системы
- •Типы электродов, используемых в электрохимических методах анализа
- •Классификация обратимых электродов
- •Потенциометрия
- •Основы метода
- •Типы электродов
- •Теория селективности мембранных электродов
- •Потенциометрические измерения
- •Кривые титрования.
- •Способы нахождения конечной точки титрования
- •Аппаратурное оформление потенциометрии
- •Вольтамперометрия
- •Явления на электродах электрохимической ячейки при прохождении постоянного электрического тока
- •Электродная поляризация
- •Основы метода
- •Iпреддиф.
- •Градуировка оборудования
- •Разновидности вольтамперометрического анализа
- •Аппаратурное оформление.
- •Амперометрическое титрование
- •Кулонометрия
- •Теоретические основы метода. Электролиз.
- •Кулонометрический анализ.
- •Кулонометрическое титрование.
- •Кондуктометрия
- •Электрическая проводимость растворов электролитов.
- •Кондуктометрический анализ
Градуировка оборудования
Метод калибровочных кривых. Готовят ряд эталонных растворов определяемого вещества, концентрация которых точно известна. Строят калибровочный график в координатах h - C, где h - высота вольтамперометрической кривой, равная величине Iпред.диф., С - концентрация, моль/л. Затем снимают вольтамперную кривую исследуемого раствора и, определив ее высоту h, находят концентрацию анализируемого раствора по калибровочному графику.
Метод стандарта. Готовят один эталонный раствор, снимают вольтамперную кривую и такую же кривую для анализируемого раствора. Зная концентрацию стандартного раствора (Сст) и определив высоту волны стандартного (hст) и анализируемого (hx) растворов, можно расчитать концентрацию определяемого вещества по формуле
Сх = hxCст/hст.
Метод добавок. Вначале снимают вольтамперную кривую анализируемого раствора, затем в ячейку прибавляют по каплям стандартный раствор определяемого иона с точно известной концентрацией с таким расчетом, чтобы высота волны возросла вдвое. Снимают вольтамперную кривую полученного раствора и делают расчет по формулам
Cx/Cст = hx/hст
hcт = hобщ - hx,
где Сх - концентрация определяемого иона, мг/л; hx - высота волны анализируемого иона, мм; Сст - концентрация добавляемого иона, мг/л; hст - высота волны стандартного раствора, мм.
Концентрацию определяемого иона, введенного в ячейку в виде стандартного раствора, вычисляют по формуле
Сст = С’стVст/(Vст + Vx),
где С’ст - первоначальная концентрация стандартного раствора, мг/л; Vст - количество стандартного раствора, добавленного в ячейку, мл; Vx - объем анализируемого раствора в ячейке, мл.
Разновидности вольтамперометрического анализа
Основной задачей вольтамперометрического анализа является качественный и количественный анализ исследуемого раствора. Если качественный анализ по потенциалу полуволны затруднений не вызывает, то для проведения количественного анализа существует ряд методов.
Вольтамперометрия с линейной разверткой потенциала. Сущность данного способа анализа заключается в том, что напряжение на микроэлектрод и вспомогательный электрод подается со скоростью изменения до 100 В/с, а полученная вольтамперная кривая регистрируется на осциллографе. Это дает возможность изучать процессы, мгновенно протекающие на микроэлектроде (до 10-7 с), а также повышает чувствительность метода, поскольку i-max на осциллограммах в несколько раз больше Iпред.диф, получаемого на полярограммах. Значительно более высокие, чем в классическом методе вольтамперометрии, скорости изменения поляризующего напряжения приводят к изменению формы вольтамперной кривой: вместо волны наблюдается кривая с четко выраженным максимумом (пиком).
Потенциал максимума Еmax используется для качественного анализа, т.е. он характеризует природу вещества. Максимальная высота пика h, соответствующая Iпред.диф., пропорциональна концентрации вещества, окисляющегося или восстанавливающегося на микроэлектроде. Определив высоту пика, рассчитывают концентрацию вещества в растворе по формуле
Iпред.диф = 2.72105 z3/2 S D1/2 V1/2 C,
где V - скорость изменения поляризующего напряжения.
Переменнотоковая вольтамперометрия. В классическом способе вольтамперометрии на электроды ячейки подается постоянный ток с изменяющимся во времени напряжением. В данном способе анализа на электроды подается медленно меняющееся во времени постоянное напряжение и переменное напряжение небольшой амплитуды (до 50 мВ). Это дает возможность уменьшит почти до нуля конденсаторный ток, который сильно искажает форму вольтамперных кривых при малых концентрациях вещества в растворе, вследствие чего увеличивается чувствительность и разрешающая способность данного способа анализа. Вольтамперная кривая имеет форму кривой с максимумом, и содержит такую же аналитическую информацию.
Метод инверсионной вольтамперометрии Сущность метода. Предварительно из перемешиваемого анализируемого раствора определяемый элемент концентрируется на поверхности рабочего электрода при потенциале, несколько более отрицательном, чем потенциал полуволны определяемого иона. Затем выделившееся вещество анодно растворяется при потенциале, непрерывно меняющемся от значения, при котором проводилось катодное выделение, до более положительных потенциалов. В результате кривая анодного тока имеет вид характерного зубца, глубина l которого соответствует Iпред.диф. и пропорциональна концентрации определяемого иона в растворе при условии постоянства других факторов. Значение Emin характеризует природу вещества.
I,mA I,mA
E, V
Emin









l

h
E, V
Emax I,mA
E, V
h
Emax



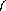


Рис. Вольтамперные кривые: а - с линейной разверткой напряжения;
б - переменно-токовая; в - инверсионная
В общем случае электрохимически или химически определяемые элементы концентрируются на электроде (стационарном ртутном, графитовом, ртутно-графитовом, стеклоуглеродном, платиновом и т.д.) в виде атомов нулевой валентности, твердых растворов или интерметаллических соединений, адсорбированных комплексных ионов или органических веществ. После окончании концентрирования проводится электрохимическое растворение концентрата с поверхности электрода при наложении на электрод потенциала (чаще линейно меняющегося) и регистрируется полезный сигнал (вольтамперная кривая).
Накопление на электроде в виде металла нулевой валентности является основным при определении Li, K, Na, Rb, Cs, Mn, Zn, Cd, Pb, Cu, Hg, Ag, Au, Pd, Ga, Bi, Ge, Tl, In, Te, Fe, Ni, Co, Sb, Sn.
Процессы образования гидридов используются при концентрировании на электродах таких элементов, как As, Se, Te, Ge, Sb, Sn.
Повышение степени концентрирования достигается выбором оптимального материала электрода, рН раствора, введением связывающих добавок - элементов, образующих с определяемым сравнительно прочные соединения на поверхности электрода, что эффективно при определении As, Se платиновых элементов.
Из теоретических расчетов могут быть определены условия, при которых величина тока максимальна в заданных областях изменения таких параметров, как скорость изменения потенциала, частота и амплитуда переменного тока, размер и форма электрода, толщина слоя раствора, коэффициенты диффузии атомов металла в электроде и ионов в растворе, константа скорости электродного процесса и коэффициент переноса электрона, состав, кинетические и термодинамические параметры комплексов в растворе и интерметаллических соединений в ртути и др.
Экспериментальные исследования относятся в основном к выбору условий, определяющих максимальный сигнал в стадии концентрирования. Это природа, состав и рН фонового электролита, поверхность электрода, время и потенциал электролиза, интенсивность перемешивания раствора и др.
Помехой в методе ИВА является прежде всего остаточный ток, его диффузионная и емкостная составляющие. Снижение диффузионной составляющей помехи достигается очисткой фонового электролита от растворенного кислорода, чаще всего барботажем газообразного аргона или азота, снижением «холостого» или «контрольного» опыта более глубокой очисткой ячейки, воды и фоновых электролитов.
Снижение второй компоненты остаточного тока - емкостной составляющей - достигается использованием специальных аппаратурных устройств, фазовой селекцией, отсечкой емкостного тока и т.д.
Инверсионная вольтамперометрия чвляется современным и активно развивающимся методом контроля тяжелых металлов. Метод позволяет определять около неорганических катионов и анионов. В отношении предела обнаружения метод ИВА относится к наиболее высокочувствительным методам (чувствительность находится в диапазоне 0.0001-500 мг/кг, точность 2-20%), включающим нейтронно-активационный и масс-спектральный анализ, атомную абсорбцию.
Число определяемых из одной полярограммы (вольтамперограммы) элементов не превышает 4 - 5. Обычно это Cu, Pb, Cd, Zn, Mn в нейтральных фоновых электролитах. Нахождение других элементов, например Bi, Sb, Sn, требует перехода к кислым средам. Определение элементов более электроотрицательных, чем ртуть, основано на использовании ртутных (пленочных или сферических) или ртутно-графитовых электродов, а более электроположительных, чем ртуть, проводится на твердых, преимущественно графитовых, электродах.
