
- •Руководство к выполнению
- •Настоящее практическое пособие составлено согласно учебной программе курсов. Термохимия
- •Калориметр и методика калориметрических измерений
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение теплоты гидратации соли.
- •Методика выполнения работы Определение постоянной калориметра
- •Форма отчета
- •Навески солей, взятые для растворения
- •Результаты калориметрических опытов при определении теплоты гидратации соли
- •Лабораторная работа № 2. Определение теплоты нейтрализации сильной кислоты сильным основанием.
- •Методика выполнения работы
- •Форма отчета
- •Результаты калориметрических опытов при определении теплоты нейтрализации сильных кислот сильным основанием
- •Химическое равновесие контрольные вопросы
- •Лабораторная работа № 3. Изучение равновесия гомогенной реакции в растворе.
- •Методика выполнения работы
- •Форма отчета
- •Фазовое равновесие контрольные вопросы
- •Лабораторная работа № 4. Растворение фенола в воде.
- •Методика выполнения работы
- •Форма отчета
- •Экспериментальные данные для построения диаграммы «состав — температура растворения» двойной жидкой системы вода — фенол.
- •Лабораторная работа № 5. Изучение кристаллизации вещества из растворов при низких температурах.
- •Методика выполнения работы
- •Форма отчета
- •Температура при охлаждении смеси
- •Результаты определения температуры кристаллизации
- •Лабораторная работа № 6. Определение коэффициента распределения.
- •Методика выполнения работы
- •Форма отчета
- •Определение коэффициента распределения органической кислоты между двумя несмешивающимися жидкостями: водой и эфиром
- •Молекулярные растворы Термометр Бекмана
- •Криоскоп
- •Контрольные вопросы
- •Лабораторная работа № 7.
- •Форма отчета
- •Криоскопические константы некоторых растворителей
- •Лабораторная работа № 8. Криоскопический метод определения молекулярной массы вещества по Расту (микрометод).
- •Методика выполнения работы
- •Форма отчета
- •Определение молекулярной массы исследуемого вещества по методу Раста
- •Лабораторная работа № 9. Изучение равновесия жидкость — пар в двойных жидких системах.
- •Методика выполнения работы
- •Форма отчета
- •Химическая кинетика контрольные вопросы
- •Лабораторная работа № 10. Определение порядка реакции окисления йодид-ионов ионами трехвалентного железа.
- •Методика выполнения работы
- •Определение частного порядка по отношению к I-.
- •Форма отчета
- •Лабораторная работа № 11. Изучение скорости реакции разложения комплексного оксалата марганца.
- •Фотоэлектрокалориметр фэк-м
- •Методика выполнения работы
- •Сосуд для
- •Форма отчета
- •Лабораторная работа № 12. Изучение скорости реакции разложения мурексида в кислой среде.
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 13. Определение константы скорости омыления уксусноэтилового эфира в присутствии гидроксид- ионов.
- •Омыление этилацетата протекает по уравнению
- •Методика выполнения работы
- •Форма отчета
- •Результаты обратного титрования при определении константы скорости омыления сложного эфира в присутствии щелочи
- •Лабораторная работа № 14. Определение скорости разложения пероксида водорода в присутствии катализатора.
- •Методика выполнения работы
- •Форма отчета
- •Свойства электролитов контрольные вопросы
- •Методы и аппаратура, применяемые для измерения электропроводности растворов электролитов
- •Определение константы электролитического сосуда и измерение удельной электропроводности растворов электролита.
- •Удельная электропроводность водных растворов кСl при концентрации 1/50 и 1/100 моль/л
- •Константа сосуда рассчитывается по уравнению
- •Лабораторная работа № 15. Определение коэффициента электропроводности сильного электролита.
- •Методика выполнения работы
- •Измерение удельной электропроводности воды
- •Форма отчета
- •Лабораторная работа № 16. Определение растворимости и произведения растворимости труднорастворимой соли.
- •Тогда из уравнения следует
- •Методика выполнения работы
- •Форма отчета
- •Определение константы электролитического сосуда и удельной электропроводности дистиллированной воды и исследуемой соли
- •Лабораторная работа № 17. Определение буферной емкости потенцометрическим методом.
- •Измерение рН с помощью стеклянного электрода
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 18. Потенциометрическое титрование кислот щелочью.
- •Кривая потенциометрического Дифференциальная кривая
- •Методика выполнения работы
- •1. Потенциометрическое титрование сильной кислоты щелочью.
- •2. Потенциометрическое титрование слабой кислоты щелочью.
- •3. Потенциометрическое титрование смеси кислот (сильная плюс слабая).
- •4. Потенциометрическое определение концентрации кислот во фруктах и овощах.
- •Форма отчета
- •Результаты потенциометрического титрования
- •Электрохимия лабораторная работа № 19. Приготовление медного кулонометра.
- •Методика выполнения работы
- •Медный кулонометр
- •Проверка калибровки амперметра
- •Форма отчета
- •Лабораторная работа № 20. Выход по току.
- •Методика выполнения работы
- •Форма отчета
- •Адсорбция
- •Лабораторная работа № 21. Адсорбция на границе жидкость – газ. Влияние жирных кислот на поверхностное натяжение воды.
- •Влияние жирных кислот на поверхностное натяжение воды
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 22.
- •Методика выполнения работы
- •Форма отчета
- •Свойства коллоидных растворов контрольные вопросы
- •Лабораторная работа № 23. Получение золей и их коагуляция.
- •Методика выполнения работы Получение золей при химических реакциях
- •Определение знака заряда золей методом капиллярного анализа
- •Определение порога коагуляции золей
- •Форма отчета
- •Коагуляция золя гидрата оксида железа (III) под влиянием электролитов
- •Коагуляция золя берлинской лазури под влиянием электролитов
- •Рекомендуемая литература
Фазовое равновесие контрольные вопросы
1. Что такое фаза, компонент, степень свободы?
2. Как изображается графически равновесие систем одновариантных, двухвариантных и безвариантных?
3. От чего зависит продолжительность эвтектической остановки?
4. Что такое правило рычага?
5. В чем заключается физико-химический метод анализа?
6. На чем основан термический анализ? Можно ли предвидеть характер кривых охлаждения?
7. Какой вид имеют диаграммы равновесия двух веществ: 1) с простой эвтектикой; 2) если вещества образуют между собой устойчивое химическое соединение; соединение, которое разлагается, не достигнув температуры плавления (на диаграмме скрытый максимум); 3) когда два вещества неограниченно растворяются в твердом и жидком виде; ограниченно растворяются в твердом виде; ограниченно растворяются в жидком виде?
На каждой диаграмме показать значение отдельных площадей, линии, точек, число компонентов, степеней свободы, фаз, их состав и весовое соотношение; начали и конец плавления любого сплава. Построить кривые охлаждения сплавов различных составов и объяснить при этом процессы, протекающие на отдельных участках кривых охлаждении. Сплавы каких составов будут иметь постоянную температуру плавления?
8. В чем различие понятий «эвтектическая точка», «эвтектическая температура» и «эвтектика».
9. Приведите конкретные примеры различной взаимной растворимости двух жидкостей.
10. Начертите диаграмму ограниченной растворимости двух жидкостей с нижней критической точкой и проведите на диаграмме конноды (ноды). Может ли коннода идти наклонно относительно оси состава? Что она соединяет?
11. Что такое сопряженные фазы (слои)?
12. Приведите формулировку правила, определяющего относительные количества сопряженных фаз?
13. Что называется экстракцией? Какой закон лежит в основе процесса экстрагирования?
14. Одинаков ли эффект извлечения брома из водного раствора, содержащего 30 г брома в 1 л воды, при однократной и трехкратной экстракции одним и тем же количеством сероуглерода. Ответ подтвердите расчетом (коэффициент распределения равен 0,0125 при 20° С).
Лабораторная работа № 4. Растворение фенола в воде.
Цель работы:
1. Изучить взаимную растворимость воды и фенола при различных температурах.
2. Построить диаграмму «состав — температура растворения» двойной жидкой системы вода — фенол и определить критическую точку растворения.
Приборы и посуда:
Прибор для изучения взаимной растворимости жидкостей визуально-политермическим методом;
Пипетка.
Реактивы и материалы:
Фенол;
Дистиллированная вода.
Методика выполнения работы
В работе предлагается политермический метод исследования. В данном случае его можно назвать визуально-политермическим, так как смесь фенола и воды определенного состава нагревают или охлаждают и определяют визуально, при какой температуре начнется расслоение в системе или наоборот — взаимное растворение.
Изменение состава системы можно проводить двумя путями: или добавляя к навеске воды различные количества фенола, или добавляя различные количества воды к навеске фенола. Второй путь более удобный, так как позволяет исследовать диаграмму взаимной растворимости, использовав максимально для работы две навески фенола. Необходимое количество воды можно брать по объему, добавляя ее пипеткой. Поэтому предлагаемая методика упрощает эксперимент и значительно экономит время.
При работе с фенолом строго соблюдать правила по технике безопасности. Необходимо помнить, что, помимо токсичности, фенол вызывает тяжелые химические ожоги кожи, глаз. Тяжесть ожогов значительно повышается, если фенол или раствор нагрет. При попадании фенола на кожу, в глаза немедленно промыть пораженный участок большим количеством воды.
Д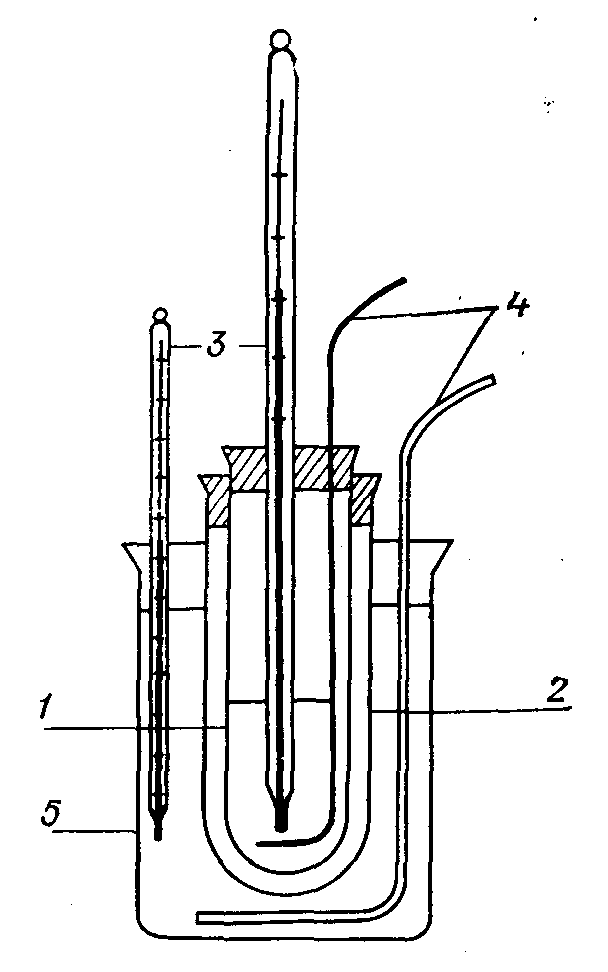 ля
изучения взаимной растворимости
жидкостей визуально-политермическим
методом удобно пользоваться прибором,
изображенным на рис. 6.
ля
изучения взаимной растворимости
жидкостей визуально-политермическим
методом удобно пользоваться прибором,
изображенным на рис. 6.
Пробирка 1 (объемом 40—50 мл), в которую помещается смесь, заключается в воздушную муфту 2. Воздушная прослойка между пробиркой и муфтой способствует более равномерному нагреванию и охлаждению смеси. В качестве водяной бани используется стеклянный стакан емкостью 1,5—2 л, который заполняется дистиллированной водой. Температура воды в бане поддерживается ~ 80° С. В качестве охладительной смеси используется смесь снега или толченого льда с хлористым натрием ( tпл. = – 4, –5° С).
Изучение диаграммы «состав — температура растворения» лучше проводить двум студентам. Первому предлагается исследовать 8—9 точек, например от 80 — до 45% фенола (исходная навеска 4 г), другому — 8—9 точек от 45 до 5% фенола (исходная навеска 1,5 г), а потом следует построить диаграмму, используя данные обоих студентов.
Рис. 6. Прибор
для изучения взаимной растворимости
жидкостей визуально-политермическим
методом.
∑V(Н2О) = 1,00+0,33+0,38 = 1,71 мл.
Фенол — твердое легкоплавкое вещество (температура плавления 42° С), которое в присутствии небольших количеств воды плавится при комнатной температуре. Для исследования берут исходную навеску фенола 4 г в пробирку 1. Добавляют необходимое количество воды, например 20% по весу, т. е. 1 мл. Встряхивают, вставляют алюминиевую мешалку 4 (рис. 6), (исследуемая смесь не действует на Аl) и закрывают пробирку корковой пробкой с обычным термометром 3 (рис.6), шкала которого градуирована от 0 до +100° С. Ртутный шарик термометра погружают в среднюю часть жидкой смеси.
Если приготовленная смесь гетерогенна, т. е. представляет собой две фазы (мутно-молочная смесь), то опыт начинают с нагревания в водяной бане и определения температуры взаимного растворения. Если приготовленная смесь гомогенна, т. е. представляет собой одну фазу (прозрачный раствор), опыт начинают с охлаждения в охладительной смеси и определения температуры расслоения. Укрепив пробирку в воздушной муфте, опускают ее или в охладительную смесь, или в водяную баню. При непрерывном перемешивании смеси фенола с водой отмечают температуру, при которой происходит изменение фазового равновесия, хорошо заметное по изменению внешнего вида смеси и цвета: гетерогенное равновесие (2 фазы) — смесь мутно-молочная, непрозрачная; гомогенное равновесие (1 фаза) — раствор прозрачный, розового цвета. Фиксируют температуру фазового перехода. Далее опыт проводят в обратном направлении, т. е. если первоначально смесь нагревали и отмечали температуру взаимного растворения, то затем ее охлаждают и отмечают температуру расслоения. Разность температур взаимного растворения и расслоения не должна превышать 0,5°. Указанная методика позволяет получать точки взаимного расслоения и растворения с точностью до 0,2— 0,5°. Повторяют опыт с той же смесью 2—3 раза. Результаты определений заносят в табл. I (см. форму отчета).
Затем в смесь фенола с водой добавляют пипеткой необходимое количество воды, встряхивают и определяют температуру взаимного растворения и расслоения и т. д.
При изучении взаимной растворимости составов, содержащих от 45 до 5 % фенола, исходят из навески 1,5 г фенола. Методика работы та же.
