
- •Руководство к выполнению
- •Настоящее практическое пособие составлено согласно учебной программе курсов. Термохимия
- •Калориметр и методика калориметрических измерений
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение теплоты гидратации соли.
- •Методика выполнения работы Определение постоянной калориметра
- •Форма отчета
- •Навески солей, взятые для растворения
- •Результаты калориметрических опытов при определении теплоты гидратации соли
- •Лабораторная работа № 2. Определение теплоты нейтрализации сильной кислоты сильным основанием.
- •Методика выполнения работы
- •Форма отчета
- •Результаты калориметрических опытов при определении теплоты нейтрализации сильных кислот сильным основанием
- •Химическое равновесие контрольные вопросы
- •Лабораторная работа № 3. Изучение равновесия гомогенной реакции в растворе.
- •Методика выполнения работы
- •Форма отчета
- •Фазовое равновесие контрольные вопросы
- •Лабораторная работа № 4. Растворение фенола в воде.
- •Методика выполнения работы
- •Форма отчета
- •Экспериментальные данные для построения диаграммы «состав — температура растворения» двойной жидкой системы вода — фенол.
- •Лабораторная работа № 5. Изучение кристаллизации вещества из растворов при низких температурах.
- •Методика выполнения работы
- •Форма отчета
- •Температура при охлаждении смеси
- •Результаты определения температуры кристаллизации
- •Лабораторная работа № 6. Определение коэффициента распределения.
- •Методика выполнения работы
- •Форма отчета
- •Определение коэффициента распределения органической кислоты между двумя несмешивающимися жидкостями: водой и эфиром
- •Молекулярные растворы Термометр Бекмана
- •Криоскоп
- •Контрольные вопросы
- •Лабораторная работа № 7.
- •Форма отчета
- •Криоскопические константы некоторых растворителей
- •Лабораторная работа № 8. Криоскопический метод определения молекулярной массы вещества по Расту (микрометод).
- •Методика выполнения работы
- •Форма отчета
- •Определение молекулярной массы исследуемого вещества по методу Раста
- •Лабораторная работа № 9. Изучение равновесия жидкость — пар в двойных жидких системах.
- •Методика выполнения работы
- •Форма отчета
- •Химическая кинетика контрольные вопросы
- •Лабораторная работа № 10. Определение порядка реакции окисления йодид-ионов ионами трехвалентного железа.
- •Методика выполнения работы
- •Определение частного порядка по отношению к I-.
- •Форма отчета
- •Лабораторная работа № 11. Изучение скорости реакции разложения комплексного оксалата марганца.
- •Фотоэлектрокалориметр фэк-м
- •Методика выполнения работы
- •Сосуд для
- •Форма отчета
- •Лабораторная работа № 12. Изучение скорости реакции разложения мурексида в кислой среде.
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 13. Определение константы скорости омыления уксусноэтилового эфира в присутствии гидроксид- ионов.
- •Омыление этилацетата протекает по уравнению
- •Методика выполнения работы
- •Форма отчета
- •Результаты обратного титрования при определении константы скорости омыления сложного эфира в присутствии щелочи
- •Лабораторная работа № 14. Определение скорости разложения пероксида водорода в присутствии катализатора.
- •Методика выполнения работы
- •Форма отчета
- •Свойства электролитов контрольные вопросы
- •Методы и аппаратура, применяемые для измерения электропроводности растворов электролитов
- •Определение константы электролитического сосуда и измерение удельной электропроводности растворов электролита.
- •Удельная электропроводность водных растворов кСl при концентрации 1/50 и 1/100 моль/л
- •Константа сосуда рассчитывается по уравнению
- •Лабораторная работа № 15. Определение коэффициента электропроводности сильного электролита.
- •Методика выполнения работы
- •Измерение удельной электропроводности воды
- •Форма отчета
- •Лабораторная работа № 16. Определение растворимости и произведения растворимости труднорастворимой соли.
- •Тогда из уравнения следует
- •Методика выполнения работы
- •Форма отчета
- •Определение константы электролитического сосуда и удельной электропроводности дистиллированной воды и исследуемой соли
- •Лабораторная работа № 17. Определение буферной емкости потенцометрическим методом.
- •Измерение рН с помощью стеклянного электрода
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 18. Потенциометрическое титрование кислот щелочью.
- •Кривая потенциометрического Дифференциальная кривая
- •Методика выполнения работы
- •1. Потенциометрическое титрование сильной кислоты щелочью.
- •2. Потенциометрическое титрование слабой кислоты щелочью.
- •3. Потенциометрическое титрование смеси кислот (сильная плюс слабая).
- •4. Потенциометрическое определение концентрации кислот во фруктах и овощах.
- •Форма отчета
- •Результаты потенциометрического титрования
- •Электрохимия лабораторная работа № 19. Приготовление медного кулонометра.
- •Методика выполнения работы
- •Медный кулонометр
- •Проверка калибровки амперметра
- •Форма отчета
- •Лабораторная работа № 20. Выход по току.
- •Методика выполнения работы
- •Форма отчета
- •Адсорбция
- •Лабораторная работа № 21. Адсорбция на границе жидкость – газ. Влияние жирных кислот на поверхностное натяжение воды.
- •Влияние жирных кислот на поверхностное натяжение воды
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 22.
- •Методика выполнения работы
- •Форма отчета
- •Свойства коллоидных растворов контрольные вопросы
- •Лабораторная работа № 23. Получение золей и их коагуляция.
- •Методика выполнения работы Получение золей при химических реакциях
- •Определение знака заряда золей методом капиллярного анализа
- •Определение порога коагуляции золей
- •Форма отчета
- •Коагуляция золя гидрата оксида железа (III) под влиянием электролитов
- •Коагуляция золя берлинской лазури под влиянием электролитов
- •Рекомендуемая литература
Форма отчета
Указать цель работы.
Составить блок схему исследования.
3. Начертить схему калориметра.
4. Таблица I.
5. Таблица II.
Таблица I
Навески солей, взятые для растворения
|
Масса, г |
Соль | ||
|
для определения константы |
безводная |
кристаллогидрат | |
|
пробирки с солью |
|
|
|
|
пустой пробирки |
|
|
|
|
навески |
|
|
|
Таблица II
Результаты калориметрических опытов при определении теплоты гидратации соли
|
Периоды калориметрического опыта |
Время от начала опыта, мин |
Изменение температуры °С при растворении в воде соли | ||
|
для определения К |
безводной |
кристаллогидрата | ||
|
Предварительный (5 мин) |
1 |
|
|
|
|
2 |
|
|
| |
|
3 |
|
|
| |
|
4 |
|
|
| |
|
5 |
|
|
| |
|
Главный (время растворения соли) |
|
|
|
|
|
Заключительный (5 мин) |
|
|
|
|
6. На основании полученных данных построить на миллиметровой бумаге график t°=f(τ) (рис. 4) для определения действительного изменения температуры при растворении соли, по которой проводилось определение константы калориметра.
На рис. 4 отрезок АВ показывает изменение температуры предварительного периода (аb), ВС—главного периода (bс) и СD – заключительного (сd).
Чтобы определить Δt°, главный период опыта (bс) делят на две части и через середину восстанавливают перпендикуляр. Далее кривые АВ и СD продолжают до пересечения с этим перпендикуляром. Расстояние между полученными точками МN соответствует тому изменению температуры, которое имело
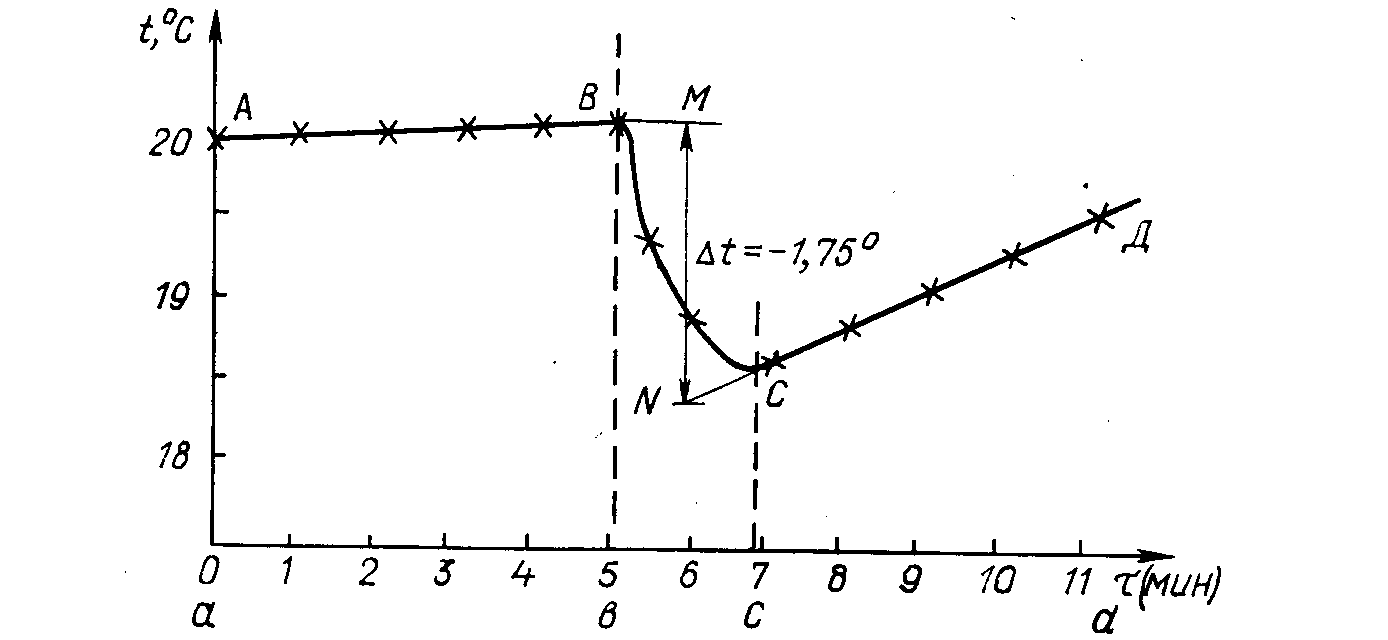
Рис. 4. График для определения действительного
изменения температуры в ходе опыта.
бы место, если бы удалось сократить до нуля продолжительность главного периода, а следовательно, устранить в этот период влияние теплообмена с окружающей средой. Отрезок МN и будет равен действительному изменению температуры Δt°.
Удобный масштаб для построения графиков:
ось абсцисс 1 см = 2 мин; ось ординат 1 см = 1° С, если Δt° 5— 10°С;
1 см = 0,5° С, если Δt° 1—4ºС;
или 1 см = 0,2° С, если Δt° 0,1—1С°.
Определив Δt°, необходимо рассчитать постоянную калориметра. Тепловой эффект растворения данной навески соли (так как для растворения брали не 1 моль соли, а меньше) равен:
Q
= Qраств.
соли·![]() ,
(3)
,
(3)
где Qраств. соли — тепловой эффект растворения 1 моль соли;
mсоли и Mсоли — масса и молекулярная масса соли.
Поэтому, исходя из уравнений (2) и (3), постоянная калориметра определяется уравнением
![]() .
(4)
.
(4)
7. Построить графики для определения Δt° при растворении безводной соли и ее кристаллогидрата. Рассчитать теплоты растворения безводной соли и ее кристаллогидрата по уравнению (4) для данного разбавления раствора l (см. уравнение 2).
8. Сравнить кривые изменения температуры при растворении безводной соли и ее кристаллогидрата, дать объяснение наблюдаемым различиям. Записать уравнение реакции гидратации соли.
9. Привести термохимическую схему, иллюстрирующую расчет теплоты гидратации по закону Гесса, и рассчитать тепловой эффект гидратации соли по уравнению (1).
10. Вывод.
