
- •Руководство к выполнению
- •Настоящее практическое пособие составлено согласно учебной программе курсов. Термохимия
- •Калориметр и методика калориметрических измерений
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение теплоты гидратации соли.
- •Методика выполнения работы Определение постоянной калориметра
- •Форма отчета
- •Навески солей, взятые для растворения
- •Результаты калориметрических опытов при определении теплоты гидратации соли
- •Лабораторная работа № 2. Определение теплоты нейтрализации сильной кислоты сильным основанием.
- •Методика выполнения работы
- •Форма отчета
- •Результаты калориметрических опытов при определении теплоты нейтрализации сильных кислот сильным основанием
- •Химическое равновесие контрольные вопросы
- •Лабораторная работа № 3. Изучение равновесия гомогенной реакции в растворе.
- •Методика выполнения работы
- •Форма отчета
- •Фазовое равновесие контрольные вопросы
- •Лабораторная работа № 4. Растворение фенола в воде.
- •Методика выполнения работы
- •Форма отчета
- •Экспериментальные данные для построения диаграммы «состав — температура растворения» двойной жидкой системы вода — фенол.
- •Лабораторная работа № 5. Изучение кристаллизации вещества из растворов при низких температурах.
- •Методика выполнения работы
- •Форма отчета
- •Температура при охлаждении смеси
- •Результаты определения температуры кристаллизации
- •Лабораторная работа № 6. Определение коэффициента распределения.
- •Методика выполнения работы
- •Форма отчета
- •Определение коэффициента распределения органической кислоты между двумя несмешивающимися жидкостями: водой и эфиром
- •Молекулярные растворы Термометр Бекмана
- •Криоскоп
- •Контрольные вопросы
- •Лабораторная работа № 7.
- •Форма отчета
- •Криоскопические константы некоторых растворителей
- •Лабораторная работа № 8. Криоскопический метод определения молекулярной массы вещества по Расту (микрометод).
- •Методика выполнения работы
- •Форма отчета
- •Определение молекулярной массы исследуемого вещества по методу Раста
- •Лабораторная работа № 9. Изучение равновесия жидкость — пар в двойных жидких системах.
- •Методика выполнения работы
- •Форма отчета
- •Химическая кинетика контрольные вопросы
- •Лабораторная работа № 10. Определение порядка реакции окисления йодид-ионов ионами трехвалентного железа.
- •Методика выполнения работы
- •Определение частного порядка по отношению к I-.
- •Форма отчета
- •Лабораторная работа № 11. Изучение скорости реакции разложения комплексного оксалата марганца.
- •Фотоэлектрокалориметр фэк-м
- •Методика выполнения работы
- •Сосуд для
- •Форма отчета
- •Лабораторная работа № 12. Изучение скорости реакции разложения мурексида в кислой среде.
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 13. Определение константы скорости омыления уксусноэтилового эфира в присутствии гидроксид- ионов.
- •Омыление этилацетата протекает по уравнению
- •Методика выполнения работы
- •Форма отчета
- •Результаты обратного титрования при определении константы скорости омыления сложного эфира в присутствии щелочи
- •Лабораторная работа № 14. Определение скорости разложения пероксида водорода в присутствии катализатора.
- •Методика выполнения работы
- •Форма отчета
- •Свойства электролитов контрольные вопросы
- •Методы и аппаратура, применяемые для измерения электропроводности растворов электролитов
- •Определение константы электролитического сосуда и измерение удельной электропроводности растворов электролита.
- •Удельная электропроводность водных растворов кСl при концентрации 1/50 и 1/100 моль/л
- •Константа сосуда рассчитывается по уравнению
- •Лабораторная работа № 15. Определение коэффициента электропроводности сильного электролита.
- •Методика выполнения работы
- •Измерение удельной электропроводности воды
- •Форма отчета
- •Лабораторная работа № 16. Определение растворимости и произведения растворимости труднорастворимой соли.
- •Тогда из уравнения следует
- •Методика выполнения работы
- •Форма отчета
- •Определение константы электролитического сосуда и удельной электропроводности дистиллированной воды и исследуемой соли
- •Лабораторная работа № 17. Определение буферной емкости потенцометрическим методом.
- •Измерение рН с помощью стеклянного электрода
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 18. Потенциометрическое титрование кислот щелочью.
- •Кривая потенциометрического Дифференциальная кривая
- •Методика выполнения работы
- •1. Потенциометрическое титрование сильной кислоты щелочью.
- •2. Потенциометрическое титрование слабой кислоты щелочью.
- •3. Потенциометрическое титрование смеси кислот (сильная плюс слабая).
- •4. Потенциометрическое определение концентрации кислот во фруктах и овощах.
- •Форма отчета
- •Результаты потенциометрического титрования
- •Электрохимия лабораторная работа № 19. Приготовление медного кулонометра.
- •Методика выполнения работы
- •Медный кулонометр
- •Проверка калибровки амперметра
- •Форма отчета
- •Лабораторная работа № 20. Выход по току.
- •Методика выполнения работы
- •Форма отчета
- •Адсорбция
- •Лабораторная работа № 21. Адсорбция на границе жидкость – газ. Влияние жирных кислот на поверхностное натяжение воды.
- •Влияние жирных кислот на поверхностное натяжение воды
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 22.
- •Методика выполнения работы
- •Форма отчета
- •Свойства коллоидных растворов контрольные вопросы
- •Лабораторная работа № 23. Получение золей и их коагуляция.
- •Методика выполнения работы Получение золей при химических реакциях
- •Определение знака заряда золей методом капиллярного анализа
- •Определение порога коагуляции золей
- •Форма отчета
- •Коагуляция золя гидрата оксида железа (III) под влиянием электролитов
- •Коагуляция золя берлинской лазури под влиянием электролитов
- •Рекомендуемая литература
Лабораторная работа № 2. Определение теплоты нейтрализации сильной кислоты сильным основанием.
Цель работы:
1. Определить константу калориметра.
2. Определить тепловой эффект реакции нейтрализации сильных кислот сильными основаниями.
Приборы и посуда:
Калориметр;
Прибор для забора жидкости в пипетку.
Реактивы и материалы:
Раствор сильной кислоты;
Раствор сильного основания.
Сильные электролиты в водных растворах (ε ~ 80) полностью диссоциированы на ионы, поэтому реакция нейтрализации сильной кислоты сильным основанием сводится к соединению 1 моль эквивалента ионов водорода (точнее гидратированных ионов водорода) с 1 моль эквивалентов гидроксид-ионов:
Н+ + ОН- → Н2О + Qнейтр.
Следовательно, независимо от природы кислоты и основания, нейтрализация сводится к образованию 1 моль воды. Тепловой эффект этой реакции называют теплотой нейтрализации.
Теплота нейтрализации слабых кислот сильными основаниями или сильных кислот слабыми основаниями заметно отличается, что вызвано малой степенью диссоциации слабых электролитов.
Методика выполнения работы
Получают у преподавателя задание, например: определить тепловой эффект реакции нейтрализации при взаимодействии гидроксида натрия с соляной и серной кислотами или азотной кислоты с гидроксидом натрия и гидроксидом калия и т. д.
Вначале определяют постоянную калориметра К, как описано выше (см. лабораторную работу №1), при объеме воды во внутреннем сосуде 250 мл.
а) Затем в чистый внутренний стакан (см. лабораторную работу № 1, рис. 3)- наливают 250 мл 0,2 н. раствора щелочи (КОН или NaОН по указанию преподавателя). Раствор щелочи должен быть титрован и иметь комнатную температуру.
Помещают в раствор мешалку, закрывают калориметр крышкой и вставляют нормальный термометр № 2 с интервалом измерений от —2 до +52° С. Ртутный шарик термометра должен находиться в средней части жидкости.
Концентрированные кислоты хранятся под тягой. В пипетку под тягой набирают, например, 10 мл концентрированной соляной кислоты (плотность 1,19—1,18). При этом необходимо пользоваться пипеткой с резиновой грушей, которая сжимается лапкой, закрепленной в штативе (рис. 5). При отсутствии такого устройства можно использовать мерный цилиндр на 10 см. Кислоту переносят в чистую сухую пробирку 5, плотно закрывают ее пробкой, выносят из-под тяги и помещают в калориметр (рис. 4).
Приступают к калориметрическим измерениям. По окончании предварительного периода, на 6-й минуте пробирку 5 вынимают из калориметра и кислоту осторожно выливают в раствор щелочи (не обливать кислотой крышку калориметра!). Пустую пробирку 5 закрывают пробкой.
Отверстие в крышке калориметра также закрывают пробкой, раствор продолжают перемешивать и следят за ходом температуры в главном (фиксировать температуру через 0,5 мин!) и заключительном периодах. Результаты калориметрических измерений заносят в табл. II отчета.
Рис. 5. Простейшее
приспособление для забора жидкости в
пипетку.
Т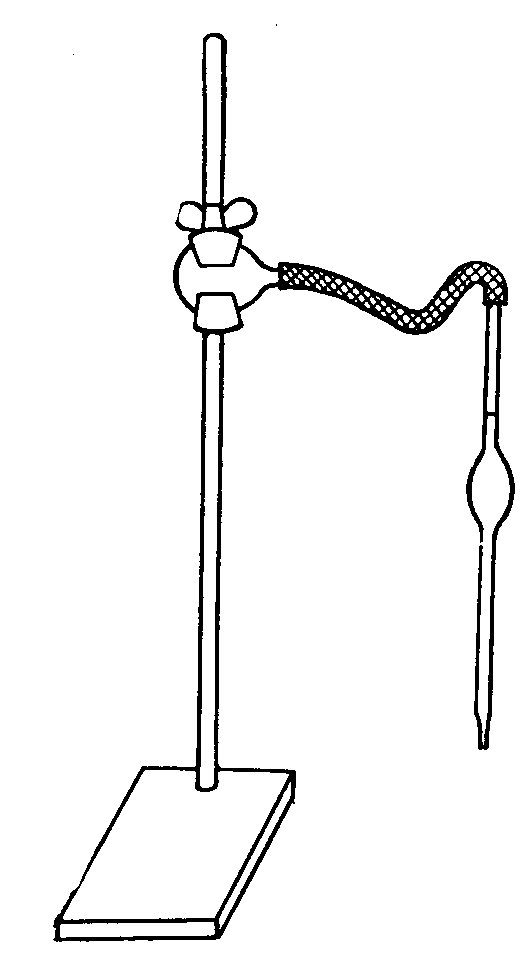 ак
как щелочь уже сильно разбавлена, третий
тепловой эффект очень мал, и поэтому им
можно пренебречь. Второй тепловой эффект
— теплоту разведения кислоты в
воде—необходимо учитывать, ввиду того
что он значителен. Для его определения
в калориметрический стакан наливают
250 мл дистиллированной воды, в пробирку
вносят такой же объем кислоты, как при
определении Δt°
сумм.
(в нашем примере 10 мл концентрированной
НС1), и проводят калориметрический опыт
аналогично предыдущему, занося
экспериментальные данные в табл. II.
ак
как щелочь уже сильно разбавлена, третий
тепловой эффект очень мал, и поэтому им
можно пренебречь. Второй тепловой эффект
— теплоту разведения кислоты в
воде—необходимо учитывать, ввиду того
что он значителен. Для его определения
в калориметрический стакан наливают
250 мл дистиллированной воды, в пробирку
вносят такой же объем кислоты, как при
определении Δt°
сумм.
(в нашем примере 10 мл концентрированной
НС1), и проводят калориметрический опыт
аналогично предыдущему, занося
экспериментальные данные в табл. II.
б) Аналогично определяют теплоту нейтрализации серной или азотной кислоты той же щелочью. Для опыта используют концентрированные кислоты (ρ(H2SO4) ≈1,8; ρ(HNO3) ≈ 1,4); объем H2SO4 и HNO3 уменьшают до 5 мл.
С концентрированными кислотами следует обращаться осторожно. Не набирать концентрированную кислоту в пипетку ртом!
Концентрированные кислоты, особенно азотная и серная, вызывают тяжелые химические ожоги кожи, особенно они опасны для глаз. При случайном попадании концентрированных кислот на кожу, в глаза надо немедленно промыть пораженное место большим количеством проточной воды (под краном) и обработать нейтрализующим раствором (2% раствором гидрокарбоната натрия).
