
- •Руководство к выполнению
- •Настоящее практическое пособие составлено согласно учебной программе курсов. Термохимия
- •Калориметр и методика калориметрических измерений
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение теплоты гидратации соли.
- •Методика выполнения работы Определение постоянной калориметра
- •Форма отчета
- •Навески солей, взятые для растворения
- •Результаты калориметрических опытов при определении теплоты гидратации соли
- •Лабораторная работа № 2. Определение теплоты нейтрализации сильной кислоты сильным основанием.
- •Методика выполнения работы
- •Форма отчета
- •Результаты калориметрических опытов при определении теплоты нейтрализации сильных кислот сильным основанием
- •Химическое равновесие контрольные вопросы
- •Лабораторная работа № 3. Изучение равновесия гомогенной реакции в растворе.
- •Методика выполнения работы
- •Форма отчета
- •Фазовое равновесие контрольные вопросы
- •Лабораторная работа № 4. Растворение фенола в воде.
- •Методика выполнения работы
- •Форма отчета
- •Экспериментальные данные для построения диаграммы «состав — температура растворения» двойной жидкой системы вода — фенол.
- •Лабораторная работа № 5. Изучение кристаллизации вещества из растворов при низких температурах.
- •Методика выполнения работы
- •Форма отчета
- •Температура при охлаждении смеси
- •Результаты определения температуры кристаллизации
- •Лабораторная работа № 6. Определение коэффициента распределения.
- •Методика выполнения работы
- •Форма отчета
- •Определение коэффициента распределения органической кислоты между двумя несмешивающимися жидкостями: водой и эфиром
- •Молекулярные растворы Термометр Бекмана
- •Криоскоп
- •Контрольные вопросы
- •Лабораторная работа № 7.
- •Форма отчета
- •Криоскопические константы некоторых растворителей
- •Лабораторная работа № 8. Криоскопический метод определения молекулярной массы вещества по Расту (микрометод).
- •Методика выполнения работы
- •Форма отчета
- •Определение молекулярной массы исследуемого вещества по методу Раста
- •Лабораторная работа № 9. Изучение равновесия жидкость — пар в двойных жидких системах.
- •Методика выполнения работы
- •Форма отчета
- •Химическая кинетика контрольные вопросы
- •Лабораторная работа № 10. Определение порядка реакции окисления йодид-ионов ионами трехвалентного железа.
- •Методика выполнения работы
- •Определение частного порядка по отношению к I-.
- •Форма отчета
- •Лабораторная работа № 11. Изучение скорости реакции разложения комплексного оксалата марганца.
- •Фотоэлектрокалориметр фэк-м
- •Методика выполнения работы
- •Сосуд для
- •Форма отчета
- •Лабораторная работа № 12. Изучение скорости реакции разложения мурексида в кислой среде.
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 13. Определение константы скорости омыления уксусноэтилового эфира в присутствии гидроксид- ионов.
- •Омыление этилацетата протекает по уравнению
- •Методика выполнения работы
- •Форма отчета
- •Результаты обратного титрования при определении константы скорости омыления сложного эфира в присутствии щелочи
- •Лабораторная работа № 14. Определение скорости разложения пероксида водорода в присутствии катализатора.
- •Методика выполнения работы
- •Форма отчета
- •Свойства электролитов контрольные вопросы
- •Методы и аппаратура, применяемые для измерения электропроводности растворов электролитов
- •Определение константы электролитического сосуда и измерение удельной электропроводности растворов электролита.
- •Удельная электропроводность водных растворов кСl при концентрации 1/50 и 1/100 моль/л
- •Константа сосуда рассчитывается по уравнению
- •Лабораторная работа № 15. Определение коэффициента электропроводности сильного электролита.
- •Методика выполнения работы
- •Измерение удельной электропроводности воды
- •Форма отчета
- •Лабораторная работа № 16. Определение растворимости и произведения растворимости труднорастворимой соли.
- •Тогда из уравнения следует
- •Методика выполнения работы
- •Форма отчета
- •Определение константы электролитического сосуда и удельной электропроводности дистиллированной воды и исследуемой соли
- •Лабораторная работа № 17. Определение буферной емкости потенцометрическим методом.
- •Измерение рН с помощью стеклянного электрода
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 18. Потенциометрическое титрование кислот щелочью.
- •Кривая потенциометрического Дифференциальная кривая
- •Методика выполнения работы
- •1. Потенциометрическое титрование сильной кислоты щелочью.
- •2. Потенциометрическое титрование слабой кислоты щелочью.
- •3. Потенциометрическое титрование смеси кислот (сильная плюс слабая).
- •4. Потенциометрическое определение концентрации кислот во фруктах и овощах.
- •Форма отчета
- •Результаты потенциометрического титрования
- •Электрохимия лабораторная работа № 19. Приготовление медного кулонометра.
- •Методика выполнения работы
- •Медный кулонометр
- •Проверка калибровки амперметра
- •Форма отчета
- •Лабораторная работа № 20. Выход по току.
- •Методика выполнения работы
- •Форма отчета
- •Адсорбция
- •Лабораторная работа № 21. Адсорбция на границе жидкость – газ. Влияние жирных кислот на поверхностное натяжение воды.
- •Влияние жирных кислот на поверхностное натяжение воды
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 22.
- •Методика выполнения работы
- •Форма отчета
- •Свойства коллоидных растворов контрольные вопросы
- •Лабораторная работа № 23. Получение золей и их коагуляция.
- •Методика выполнения работы Получение золей при химических реакциях
- •Определение знака заряда золей методом капиллярного анализа
- •Определение порога коагуляции золей
- •Форма отчета
- •Коагуляция золя гидрата оксида железа (III) под влиянием электролитов
- •Коагуляция золя берлинской лазури под влиянием электролитов
- •Рекомендуемая литература
Форма отчета
Указать цель работы.
Составить блок-схему исследования.
Привести уравнение реакции омыления сложного эфира.
4. Таблица I.
Таблица I
Результаты обратного титрования при определении константы скорости омыления сложного эфира в присутствии щелочи
Температура опыта ...
Раствор эфира (250 мл) содержит ... мл эфира.
Концентрация соляной кислоты ...
Сщ/Ск = ...
Vо
= 10![]() =…….
=…….
Момент смешения ... час ... мин.
|
№ пробы |
Время |
Количество параллельных проб |
Обратное титрование |
Количество кислоты в момент τ Vτ
= Vτ,к
- Vτ,щ
|
Vτ - V∞ |
Значение константы k | |||
|
астрономическое
|
От начала опыта τ, мин.
|
Объем кислоты Vτ,к |
Количество щелочи | ||||||
|
Vτ,щ |
Vτ,щ | ||||||||
|
|
|
|
1 |
10 |
|
|
|
|
|
|
2 |
10 |
|
| ||||||
|
1 |
10 |
|
| ||||||
|
2 |
10 |
|
| ||||||
|
1 |
10 |
|
| ||||||
|
2 |
10 |
|
| ||||||
6. Рассчитать по уравнению (1) константы скорости омыления для температур Т1 , Т2 и определить среднее значение k1 и k2.
7. Рассчитать энергию активации реакции по уравнению
Е
=
![]() .
.
8. Рассчитать температурный коэффициент реакции исходя из уравнения
lg
kТ2
= lg kТ1
+![]() lg
γ.
lg
γ.
9. Построить график Vτ = f(τ), характеризующий изменение скорости процесса омыления во времени для двух температур Т1 и Т2 . Сопоставить скорости реакции.
10. Вывод.
Лабораторная работа № 14. Определение скорости разложения пероксида водорода в присутствии катализатора.
Цель работы:
Ознакомиться с газометрическим методом изучения кинетики реакции.
Определить несколькими методами порядок реакции, аналитически и графически определить среднюю константу скорости.
Приборы и посуда:
Установка для изучения скорости разложения Н2О2 газометрическим методом (рис. 12).
Реактивы и материалы:
1. Раствор пероксида водорода;
2. Катализатор.
Пероксид водорода в водных растворах самопроизвольно медленно разлагается по уравнению
Н2О2 → Н2О + 1/2О2
В присутствии катионов и анионов, некоторых органических веществ, а также ряда твердых веществ разложение перекиси водорода значительно ускоряется. Следовательно, эта реакция в водных растворах может быть гомогенной или гетерогенной каталитической реакцией в зависимости от взятого катализатора.
За ходом реакции наблюдают по измерениям объема выделившегося кислорода через различные промежутки времени от начала реакции.
Методика выполнения работы
Реакционный сосуд 1 (рис.12) наполнить катализатором так, чтобы высота воздушного пространства между уровнем жидкости и пробкой не превышала 2 см и поместить его в термостат 4, настроенный на заданную температуру. Уравнительный сосуд 3 и бюретку 2 наполнить водой. Уровень воды в бюретке установить на уровне верхнего крана.
После 30 мин. термостатирования в реакционный сосуд влить определенное количество перекиси водорода. Раствор тщательно размешать стеклянной палочкой и реакционный сосуд закрыть пробкой. Верхний кран в течение 1—2 мин держать открытым (для вытеснения воздуха выделяющимся кислородом из реакционного сосуда), затем его закрыть, соединив таким образом реакционный сосуд с газовой бюреткой. Установить одинаковые уровни жидкости в бюретке и уравнительном сосуде, произвести первое измерение и записать уровень по бюретке и время на часах. Каждое следующее измерение сопровождается такой записью, причем уровень жидкости в бюретке и уравнительном сосуде непрерывно поддерживаются одинаковыми.
Ц Рис.
12. Схема установки для изучения скорости
разложения Н2О2
газометрическим методом.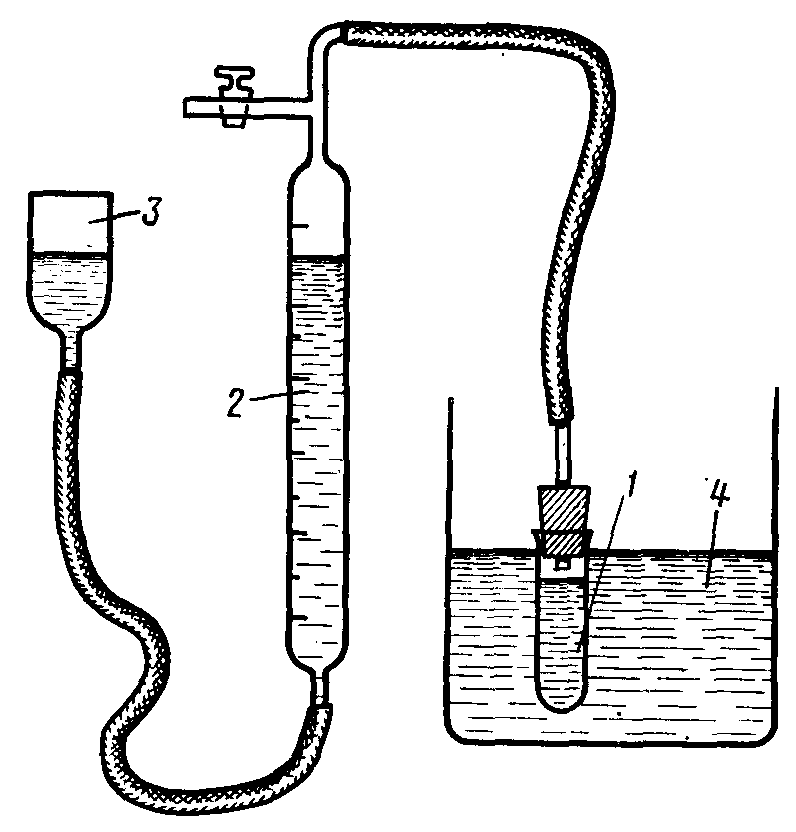
После полного разложения перекиси водорода реакционный сосуд охладить до температуры термостата, выдержать в нем в течение 25—30 мин и при равенстве уровней жидкости в бюретке и в уравнительном сосуде замерить уровень жидкости в бюретке.
При обработке экспериментальных данных за начало реакции принимать третье или четвертое измерение (т. е. измерения в условиях уже установившегося режима).
