
- •Руководство к выполнению
- •Настоящее практическое пособие составлено согласно учебной программе курсов. Термохимия
- •Калориметр и методика калориметрических измерений
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение теплоты гидратации соли.
- •Методика выполнения работы Определение постоянной калориметра
- •Форма отчета
- •Навески солей, взятые для растворения
- •Результаты калориметрических опытов при определении теплоты гидратации соли
- •Лабораторная работа № 2. Определение теплоты нейтрализации сильной кислоты сильным основанием.
- •Методика выполнения работы
- •Форма отчета
- •Результаты калориметрических опытов при определении теплоты нейтрализации сильных кислот сильным основанием
- •Химическое равновесие контрольные вопросы
- •Лабораторная работа № 3. Изучение равновесия гомогенной реакции в растворе.
- •Методика выполнения работы
- •Форма отчета
- •Фазовое равновесие контрольные вопросы
- •Лабораторная работа № 4. Растворение фенола в воде.
- •Методика выполнения работы
- •Форма отчета
- •Экспериментальные данные для построения диаграммы «состав — температура растворения» двойной жидкой системы вода — фенол.
- •Лабораторная работа № 5. Изучение кристаллизации вещества из растворов при низких температурах.
- •Методика выполнения работы
- •Форма отчета
- •Температура при охлаждении смеси
- •Результаты определения температуры кристаллизации
- •Лабораторная работа № 6. Определение коэффициента распределения.
- •Методика выполнения работы
- •Форма отчета
- •Определение коэффициента распределения органической кислоты между двумя несмешивающимися жидкостями: водой и эфиром
- •Молекулярные растворы Термометр Бекмана
- •Криоскоп
- •Контрольные вопросы
- •Лабораторная работа № 7.
- •Форма отчета
- •Криоскопические константы некоторых растворителей
- •Лабораторная работа № 8. Криоскопический метод определения молекулярной массы вещества по Расту (микрометод).
- •Методика выполнения работы
- •Форма отчета
- •Определение молекулярной массы исследуемого вещества по методу Раста
- •Лабораторная работа № 9. Изучение равновесия жидкость — пар в двойных жидких системах.
- •Методика выполнения работы
- •Форма отчета
- •Химическая кинетика контрольные вопросы
- •Лабораторная работа № 10. Определение порядка реакции окисления йодид-ионов ионами трехвалентного железа.
- •Методика выполнения работы
- •Определение частного порядка по отношению к I-.
- •Форма отчета
- •Лабораторная работа № 11. Изучение скорости реакции разложения комплексного оксалата марганца.
- •Фотоэлектрокалориметр фэк-м
- •Методика выполнения работы
- •Сосуд для
- •Форма отчета
- •Лабораторная работа № 12. Изучение скорости реакции разложения мурексида в кислой среде.
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 13. Определение константы скорости омыления уксусноэтилового эфира в присутствии гидроксид- ионов.
- •Омыление этилацетата протекает по уравнению
- •Методика выполнения работы
- •Форма отчета
- •Результаты обратного титрования при определении константы скорости омыления сложного эфира в присутствии щелочи
- •Лабораторная работа № 14. Определение скорости разложения пероксида водорода в присутствии катализатора.
- •Методика выполнения работы
- •Форма отчета
- •Свойства электролитов контрольные вопросы
- •Методы и аппаратура, применяемые для измерения электропроводности растворов электролитов
- •Определение константы электролитического сосуда и измерение удельной электропроводности растворов электролита.
- •Удельная электропроводность водных растворов кСl при концентрации 1/50 и 1/100 моль/л
- •Константа сосуда рассчитывается по уравнению
- •Лабораторная работа № 15. Определение коэффициента электропроводности сильного электролита.
- •Методика выполнения работы
- •Измерение удельной электропроводности воды
- •Форма отчета
- •Лабораторная работа № 16. Определение растворимости и произведения растворимости труднорастворимой соли.
- •Тогда из уравнения следует
- •Методика выполнения работы
- •Форма отчета
- •Определение константы электролитического сосуда и удельной электропроводности дистиллированной воды и исследуемой соли
- •Лабораторная работа № 17. Определение буферной емкости потенцометрическим методом.
- •Измерение рН с помощью стеклянного электрода
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 18. Потенциометрическое титрование кислот щелочью.
- •Кривая потенциометрического Дифференциальная кривая
- •Методика выполнения работы
- •1. Потенциометрическое титрование сильной кислоты щелочью.
- •2. Потенциометрическое титрование слабой кислоты щелочью.
- •3. Потенциометрическое титрование смеси кислот (сильная плюс слабая).
- •4. Потенциометрическое определение концентрации кислот во фруктах и овощах.
- •Форма отчета
- •Результаты потенциометрического титрования
- •Электрохимия лабораторная работа № 19. Приготовление медного кулонометра.
- •Методика выполнения работы
- •Медный кулонометр
- •Проверка калибровки амперметра
- •Форма отчета
- •Лабораторная работа № 20. Выход по току.
- •Методика выполнения работы
- •Форма отчета
- •Адсорбция
- •Лабораторная работа № 21. Адсорбция на границе жидкость – газ. Влияние жирных кислот на поверхностное натяжение воды.
- •Влияние жирных кислот на поверхностное натяжение воды
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 22.
- •Методика выполнения работы
- •Форма отчета
- •Свойства коллоидных растворов контрольные вопросы
- •Лабораторная работа № 23. Получение золей и их коагуляция.
- •Методика выполнения работы Получение золей при химических реакциях
- •Определение знака заряда золей методом капиллярного анализа
- •Определение порога коагуляции золей
- •Форма отчета
- •Коагуляция золя гидрата оксида железа (III) под влиянием электролитов
- •Коагуляция золя берлинской лазури под влиянием электролитов
- •Рекомендуемая литература
Форма отчета
Указать цель работы.
Составить блок схему исследования.
3. Привести схему криоскопа.
4. Таблица I.
5. Таблица II.
Таблица I
Навески растворителя и вещества,
взятые для криоскопического определения молекулярной массы
|
Масса, г |
Растворитель А |
Исследуемое вещество В |
|
пробирки с веществом пустой пробирки навески |
|
|
Таблица II
Определение приближенной и точной температуры
замерзания растворителя и раствора по термометру Бекмана
|
Показания термометра Бекмана |
Температура замерзания | ||||
|
приближенная |
точная | ||||
|
1 |
2 |
3 |
средняя | ||
|
tºзам. |
|
|
|
|
|
|
t зам. |
|
|
|
|
|
|
Депрессия |
Δtºзам. = tºзам. - tзам. | ||||
6. Исходя из второго закона Рауля, рассчитать:
а) молекулярную массу исследуемого вещества (неэлектролита) по уравнению
Δ tзам.=![]() ,
,
где К– криоскопическая константа, град/моль;m(в-ва) – масса вещества, г;M– молярная масса вещества, г/моль;m(р-ля) – масса растворителя, г.
Таблица III
Криоскопические константы некоторых растворителей
|
Растворитель |
tºзам., ºС |
К |
Растворитель |
tºзам., ºС |
К |
|
Вода |
0,0 |
1,86 |
Фенол |
42,7 |
7,80 |
|
Бензол |
5,5 |
5,10 |
Нафталин |
80,1 |
6,90 |
|
Нитробензол |
5,7 |
6,90 |
Камфора |
178,4 |
40,0 |
или б) для электролита определить степень диссоциации исходя из изотонического коэффициента
Δ tзам.=![]() ;
;
α =
![]() ,
,
где n– число ионов на которые распадается электролит.
7. Вывод.
Лабораторная работа № 8. Криоскопический метод определения молекулярной массы вещества по Расту (микрометод).
Цель работы:
Определить криоскопическую константу камфоры и молекулярную массу исследуемого вещества.
Приборы и посуда:
1. Пробирка (2 шт);
2. Технохимические весы;
3. Парафиновая баня;
4. Ступка с пестиком;
Бюкс (2 шт);
Стеклянные капилляры;
Прибор для определения молекулярной массы по методу Раста.
Реактивы и материалы:
Камфора;
Нафталин;
Исследуемое вещество.
Метод Раста основан на применении камфоры в качестве растворителя, криоскопическая постоянная которого очень велика (К ≈ 40°), т. е. в 8 раз больше, чем для бензола, и в 12 раз больше, чем для воды.
Камфора — природный или синтетический продукт, обладающий той особенностью, что температура плавления ее непостоянна (около 173°), следовательно, непостоянна и криоскопическая константа. Поэтому вначале необходимо определить температуру плавления и криоскопическую константу камфоры.
Методика выполнения работы
Для определения температуры плавления и криоскопической постоянной камфоры готовят 10 и 20% смеси с нафталином С10Н8. Если времени отводится мало, смеси могут быть приготовлены заранее лаборантом. В одну сухую пробирку на технохимических весах отвешивают 0,5 г нафталина и 4,5 г камфоры, в другую — соответственно 1 г и 4 г. Пробирки неплотно закрывают корковыми пробками и, встряхивая, нагревают на небольшой бане (глицериновой или парафиновой), избегая сильного перегревания. Выливают расплав из первой пробирки в ступку, перемешивают до затвердевания. Слегка растирают и переносят в бюкс № 1, то же самое проделывают со второй смесью и помещают ее в бюкс № 2. Приступают к определению температуры плавления чистой камфоры и смесей. Определение проводят обычным методом в тонких капиллярах (длина капилляров 4—5 см, диаметр 2 мм), капилляр с одной стороны должен быть запаян. Берут три капилляра, первый капилляр заполняют камфорой, второй и третий — приготовленными смесями. Капилляры должны быть пронумерованы. Например, карандашом по срезу капилляра ставят одну, две и три точки.
Д Рис.
9. Прибор для определения молекулярной
массы по
методу Раста.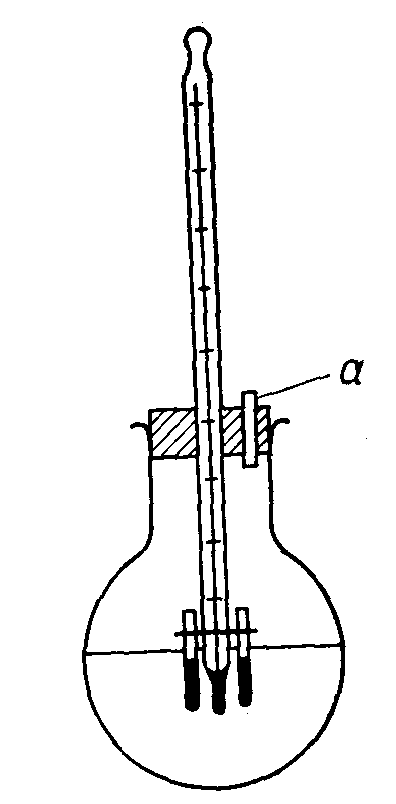
Все три капилляра прикрепляют маленьким резиновым кольцом (его получают, отрезая узкую полоску от бюреточной резиновой трубки) к нормальному термометру № 4 (с интервалом измерения от +98 до +202° С) так, чтобы слой вещества в капиллярах находился на уровне центра ртутного шарика термометра, и погружают в высокотемпературную баню. Баня — колба, лучше круглодонная из стекла пирекс, заполняется глицерином или парафином (рис. 9). Термометр лучше крепить в пробке, которой закрывают колбу (в пробку для сообщения с атмосферой вставлена стеклянная трубка а). При этом ртутный шарик должен быть в центре колбы.
До 120° нагревание можно производить быстро, а затем температура должна повышаться как можно медленнее (примерно 1° в 30—40 сек). Маленькое пламя горелки, находящееся на расстоянии ~ 7 см от колбы, дает необходимое медленное повышение температуры. Отмечают температуру исчезновения последнего кристалла в каждом капилляре. После этого начинают медленно охлаждать баню и регулировать пламя так, чтобы температура понижалась на 1° в 30—40 сек. Определяют температуру кристаллизации всех трех образцов по появлению первого кристалла.
Определение повторяют параллельно до получения совпадающих данных. Полученные данные заносят в табл. I (см. форму отчета).
Затем приступают к определению молекулярной массы неизвестного вещества, полученного у преподавателя. Для этого могут быть взяты: ацетанилид, ацетамид, бензойная кислота, бензофенон.
В сухую короткую пробирку высотой около 4 см, диаметром 1 см, взвешенную на аналитических весах, вносят ~ 0,1 г исследуемого вещества и взвешивают. В эту же пробирку добавляют 1 г камфоры и снова взвешивают. Результаты заносят в табл. I. Затем пробирку, зажав в пробиркодержателе, погружают в небольшую баню с парафином (или глицерином) и нагревают до расплавления камфоры, содержимое пробирки тщательно перемешивают небольшой стеклянной палочкой. Пробирку закрывают пробкой и оставляют охлаждаться. Остывший сплав в пробирке растирают стеклянной палочкой, набивают в четвертый капилляр и определяют температуру плавления смеси так, как описано выше.
