
- •Руководство к выполнению
- •Настоящее практическое пособие составлено согласно учебной программе курсов. Термохимия
- •Калориметр и методика калориметрических измерений
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение теплоты гидратации соли.
- •Методика выполнения работы Определение постоянной калориметра
- •Форма отчета
- •Навески солей, взятые для растворения
- •Результаты калориметрических опытов при определении теплоты гидратации соли
- •Лабораторная работа № 2. Определение теплоты нейтрализации сильной кислоты сильным основанием.
- •Методика выполнения работы
- •Форма отчета
- •Результаты калориметрических опытов при определении теплоты нейтрализации сильных кислот сильным основанием
- •Химическое равновесие контрольные вопросы
- •Лабораторная работа № 3. Изучение равновесия гомогенной реакции в растворе.
- •Методика выполнения работы
- •Форма отчета
- •Фазовое равновесие контрольные вопросы
- •Лабораторная работа № 4. Растворение фенола в воде.
- •Методика выполнения работы
- •Форма отчета
- •Экспериментальные данные для построения диаграммы «состав — температура растворения» двойной жидкой системы вода — фенол.
- •Лабораторная работа № 5. Изучение кристаллизации вещества из растворов при низких температурах.
- •Методика выполнения работы
- •Форма отчета
- •Температура при охлаждении смеси
- •Результаты определения температуры кристаллизации
- •Лабораторная работа № 6. Определение коэффициента распределения.
- •Методика выполнения работы
- •Форма отчета
- •Определение коэффициента распределения органической кислоты между двумя несмешивающимися жидкостями: водой и эфиром
- •Молекулярные растворы Термометр Бекмана
- •Криоскоп
- •Контрольные вопросы
- •Лабораторная работа № 7.
- •Форма отчета
- •Криоскопические константы некоторых растворителей
- •Лабораторная работа № 8. Криоскопический метод определения молекулярной массы вещества по Расту (микрометод).
- •Методика выполнения работы
- •Форма отчета
- •Определение молекулярной массы исследуемого вещества по методу Раста
- •Лабораторная работа № 9. Изучение равновесия жидкость — пар в двойных жидких системах.
- •Методика выполнения работы
- •Форма отчета
- •Химическая кинетика контрольные вопросы
- •Лабораторная работа № 10. Определение порядка реакции окисления йодид-ионов ионами трехвалентного железа.
- •Методика выполнения работы
- •Определение частного порядка по отношению к I-.
- •Форма отчета
- •Лабораторная работа № 11. Изучение скорости реакции разложения комплексного оксалата марганца.
- •Фотоэлектрокалориметр фэк-м
- •Методика выполнения работы
- •Сосуд для
- •Форма отчета
- •Лабораторная работа № 12. Изучение скорости реакции разложения мурексида в кислой среде.
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 13. Определение константы скорости омыления уксусноэтилового эфира в присутствии гидроксид- ионов.
- •Омыление этилацетата протекает по уравнению
- •Методика выполнения работы
- •Форма отчета
- •Результаты обратного титрования при определении константы скорости омыления сложного эфира в присутствии щелочи
- •Лабораторная работа № 14. Определение скорости разложения пероксида водорода в присутствии катализатора.
- •Методика выполнения работы
- •Форма отчета
- •Свойства электролитов контрольные вопросы
- •Методы и аппаратура, применяемые для измерения электропроводности растворов электролитов
- •Определение константы электролитического сосуда и измерение удельной электропроводности растворов электролита.
- •Удельная электропроводность водных растворов кСl при концентрации 1/50 и 1/100 моль/л
- •Константа сосуда рассчитывается по уравнению
- •Лабораторная работа № 15. Определение коэффициента электропроводности сильного электролита.
- •Методика выполнения работы
- •Измерение удельной электропроводности воды
- •Форма отчета
- •Лабораторная работа № 16. Определение растворимости и произведения растворимости труднорастворимой соли.
- •Тогда из уравнения следует
- •Методика выполнения работы
- •Форма отчета
- •Определение константы электролитического сосуда и удельной электропроводности дистиллированной воды и исследуемой соли
- •Лабораторная работа № 17. Определение буферной емкости потенцометрическим методом.
- •Измерение рН с помощью стеклянного электрода
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 18. Потенциометрическое титрование кислот щелочью.
- •Кривая потенциометрического Дифференциальная кривая
- •Методика выполнения работы
- •1. Потенциометрическое титрование сильной кислоты щелочью.
- •2. Потенциометрическое титрование слабой кислоты щелочью.
- •3. Потенциометрическое титрование смеси кислот (сильная плюс слабая).
- •4. Потенциометрическое определение концентрации кислот во фруктах и овощах.
- •Форма отчета
- •Результаты потенциометрического титрования
- •Электрохимия лабораторная работа № 19. Приготовление медного кулонометра.
- •Методика выполнения работы
- •Медный кулонометр
- •Проверка калибровки амперметра
- •Форма отчета
- •Лабораторная работа № 20. Выход по току.
- •Методика выполнения работы
- •Форма отчета
- •Адсорбция
- •Лабораторная работа № 21. Адсорбция на границе жидкость – газ. Влияние жирных кислот на поверхностное натяжение воды.
- •Влияние жирных кислот на поверхностное натяжение воды
- •Методика выполнения работы
- •Форма отчета
- •Лабораторная работа № 22.
- •Методика выполнения работы
- •Форма отчета
- •Свойства коллоидных растворов контрольные вопросы
- •Лабораторная работа № 23. Получение золей и их коагуляция.
- •Методика выполнения работы Получение золей при химических реакциях
- •Определение знака заряда золей методом капиллярного анализа
- •Определение порога коагуляции золей
- •Форма отчета
- •Коагуляция золя гидрата оксида железа (III) под влиянием электролитов
- •Коагуляция золя берлинской лазури под влиянием электролитов
- •Рекомендуемая литература
Руководство к выполнению
лабораторно-практических работ
по физической и коллоидной химии
для студентов специальности «Химия»
Данное пособие является руководством для подготовки и выполнения лабораторных работ по курсам физической и коллоидной химии для студентов специальности «Химия». Руководство включает следующие разделы: термохимия, фазовое и химическое равновесие, свойства молекулярных растворов, химическая кинетика, свойства электролитов, свойства электрохимических систем, адсорбция, поверхностные явления и свойства коллоидных систем. Для наиболее полного усвоения материала по каждой теме предусмотрены: краткая теоретическая часть, которая включает в себя основные понятия и закономерности изучаемых явлений, контрольные вопросы для проверки самостоятельной подготовки студента, подробные методики выполнения экспериментальных работ, предлагаются формы отчетности. Лабораторные работы, вошедшие в пособие, долгое время использовались в лабораторном практикуме на занятиях по физической и коллоидной химии.
Настоящее практическое пособие составлено согласно учебной программе курсов. Термохимия
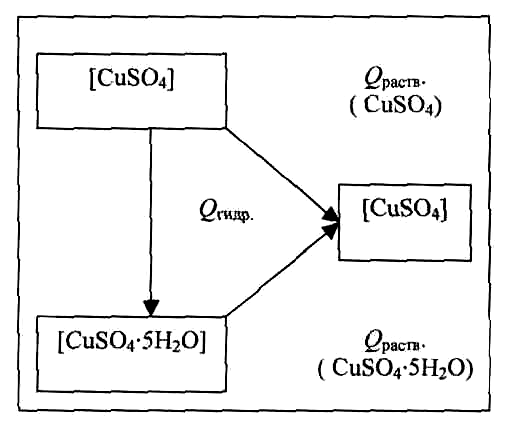
Основываясь на законе Гесса, можно вычислить теплоту гидратации соли, произведя измерение теплот растворения безводной соли и ее кристаллогидрата в достаточно больших количествах воды, чтобы полученный раствор в обоих случаях имел одинаковую концентрацию, и дальнейшее разбавление его происходило бы без теплового эффекта.
Например, раствор сульфата меди определенной концентрации можно получить двумя путями, которые графически представлены на рис. 1:
1) растворить определенное количество сульфата меди (например, 5 г) в данном количестве воды или
2
Рис.
1. Термохимическая схема, иллюстрирующая
расчет теплоты гидратации соли на
основе закона Гесса.
Согласно закону Гесса, тепловые эффекты первого и второго пути должны быть равны:
Qраств.(CuSO4) = Qгидр. + Qраств. (CuSO4·5H2O)
Откуда
Qгидр. = Qраств. (CuSO4) - Qраств. (CuSO4·5H2О)
Здесь также можно исходить из следствия закона Гесса, которое гласит: если два процесса идут из разных начальных состояний и приходят к одинаковому конечному, то разность их тепловых эффектов равна тепловому эффекту перехода из одного начального состояния в другое.
Для любого теплового эффекта гидратации соли имеем:
Qгидр. = Qраств. (соли) - Qраств. (кристаллогидрата)
При растворении твердого вещества в жидкости необходимо затратить энергию на разрушение кристаллической решетки и равномерное распределение частиц твердого тела (молекул, ионов) в растворителе – процесс эндотермический (-Q1). С другой стороны, при растворении происходит химическое взаимодействие растворяемого вещества и растворителя, сопровождающееся выделением энергии – процесс экзотермический(+Q2). Суммарный тепловой эффект процесса растворения зависит от соотношенияQ1иQ2и может быть как положительным, так и отрицательным.
Обычно определяют интегральную теплоту растворения – тепловой эффект, сопровождающий процесс растворения (при t° = const) 1 моль вещества в данном количестве растворителя с образованием раствора концентрации m. Величина теплового эффекта зависит от концентрации полученного раствора, т. е. для данной соли можно получить ряд теплот растворения, отвечающих различным концентрациям, т0, т1, т2 ... тп.
Тепловой эффект, полученный при растворении моль вещества в бесконечно большом количестве растворителя (концентрация т0 приближается к нулю), называется первой интегральной теплотой растворения ΔНm0. Практически для получения первой интегральной теплоты растворения достаточно взять 400 и более молей растворителя на 1 моль растворяемой соли, так как при дальнейшем разбавлении растворов ΔНm0 не меняется. Эти данные обычно приводятся в физико-химических справочниках
ΔНm0 = - Qm0.
При калориметрических измерениях для выражения концентраций пользуются так называемым «разбавлением» — l, представляющим отношение числа моль растворителя (воды) к числу моль растворенного вещества (соли, кислоты, щелочи), т. е.
![]()
 .
(1)
.
(1)
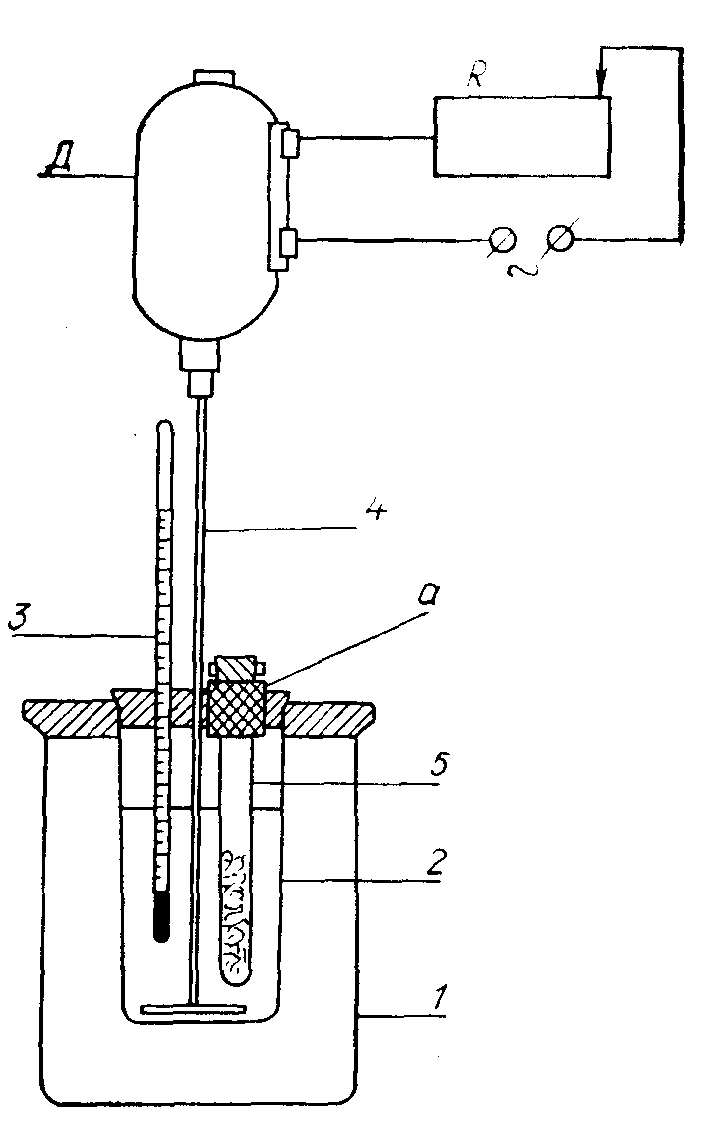
Рис. 3. Простейший
калориметр: 1
– батарейный стакан; 2– внутренний
сосуд; 3 – термометр; 4 – мешалка; 5 –
пробирка с веществом, на верхний край
которой надет кусок резиновой трубки
«а»; Д – электродвигатель; R
– реостат.
Н
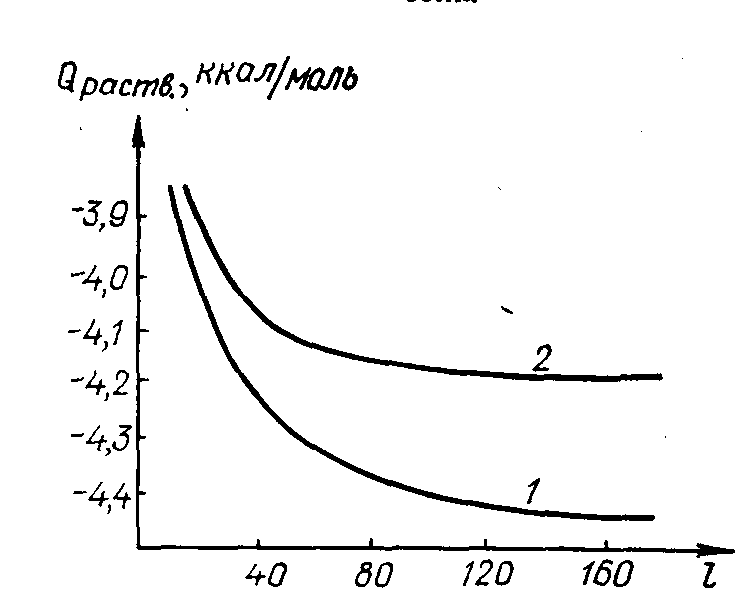
Рис.
2. Зависимость интегральной теплоты
растворения хлорида калия от величины
разбавления раствора l: 1 – при 18º С;
2 – при 25º С.
На рисунке 2 представлена зависимость интегральных теплот растворения хлорида калия от разбавления l при температурах 18° и 25° С.
